基于功能核酸的食品重金属污染快速检测进展
邓莎,董怡,任尧,邓锐杰,何强
(四川大学轻工科学与工程学院,四川成都 610065)
重金属具有毒性大、危害性持久及生物富集性强等特点,是土壤和水体的主要污染物[1,2],并可以通过转移到农作物、牲畜和鱼等食用动植物体内以及水源而转移到食品中,成为食品安全领域的一大严重问题。其中,铅离子(Pb2+)、汞离子(Hg2+)和镉离子(Cd2+)是三种广泛存在的金属污染物,其摄入会极大地危害人体健康,导致贫血、肌肉麻痹、脑神经永久性损伤等健康问题[3-5]。近年来,频发的“血铅”、“镉米”等重金属污染事件,造成了恶劣的社会影响。为防止摄入重金属,痕量重金属离子分析检测技术的建立显得尤为重要。传统的重金属分析方法包括原子吸收/发射光谱法[6]、电感耦合等离子体质谱法[7,8]等,尽管它们具有高准确性和高灵敏度的优点,但其样品前处理过程复杂、仪器昂贵、运行成本较高,难以实现食品样品的临场检测[9]。因此,目前亟需开发快速、可现场操作和可推广的食品重金属污染检测方法。
近年来,以功能核酸为基础的生物传感及分析技术引起广泛关注,在重金属检测领域展现出巨大潜力[10,11]。功能核酸是一类通过筛选获取的具备识别或者催化功能的核酸分子,主要包含核酸适配体、核酶及二者的复合物。核酸适配体是一类通过指数富集配体的系统进化(SELEX)技术筛选出的能高特异性结合靶分子的DNA或RNA分子[12];核酶是通过SELEX技术筛选出的具有催化活性和结构识别能力的DNA或RNA片段[13]。由于功能核酸分子对目标分子具有高度的选择性,以及其结构的可预测性与可设计性,目前被广泛用于包括真菌毒素和抗生素等食品污染物的检测[14],特别在重金属分析领域得到了较广泛应用。例如,Pb2+特异性核酶能够特异性地催化以Pb2+为辅因子的底物RNA裂解,比其它竞争金属离子的催化活性高40万倍[15],可用于铅污染检测。功能核酸对其靶标金属离子具有极高的亲和力,可被用于构建靶标金属离子触发的结构响应核酸探针,同时,可对核酸探针进行化学修饰和标记,通过结构响应输出检测信号,检测多种金属离子,包括Hg2+[16]、Pb2+[15]、Cd2+[17]、Mg2+[18]、Zn2+[19]和Cu2+[20]等。此外,由于核酸探针具备高的识别特异性,有望在复杂的食品样品中实现对靶标金属离子的精准识别和检测。本文综述了功能核酸用于重金属(铅、汞和镉)污染检测领域的应用进展,介绍了由功能核酸构建的荧光传感器和比色传感器,及功能核酸与纳米粒子复合构建的检测传感器,突出了功能核酸与微流控技术、与便携检测设备整合的检测平台,为临场的食品重金属污染分析提供重要思路。
1 基于核酸探针的食品重金属污染检测
1.1 铅污染
基于功能核酸的荧光传感器具有灵敏度高、检测快速的优势,在食品重金属污染检测中得到广泛应用。Li等[21]分别在底物链5’端和核酶链3’端修饰荧光基团和猝灭基团,开发了一种用于Pb2+检测的荧光响应探针。当底物链和“8-17”脱氧核酶链杂交,由于荧光能量转移导致荧光基团荧光信号淬灭。当体系中加入Pb2+后,核酶链被激活,将底物链切割成两个片段,降低底物链和核酶链的杂交稳定性,导致底物链脱离核酶链,进而恢复荧光信号。该荧光传感器的动态范围为10 nM~4 μM,并在4 ℃下具备良好的选择性。然而,该核酸探针存在较高的背景荧光信号,为降低背景信号,对底物链进行了双重修饰,分别在其5’端和3’端修饰荧光基团和猝灭基团,从而使背景荧光得到了显著抑制[22]。为进一步消除荧光背景,核酶底物链被设计成分子信标结构。分子信标是一类具有环状区和茎干区的寡核苷酸链,无靶分子存在时,分子信标两端的荧光基团和猝灭基团相互靠近,发生猝灭。通过设计酶链结构,使酶链与分子信标的环状区杂交,在Pb2+存在,核酶切割分子信标的环截面,导致荧光基团与猝灭基团分离并增强荧光型号,在过量的分子信标存在下,核酶可多次催化分子信标裂解,获得放大的荧光信号(如图1所示),该荧光传感器对Pb2+的检测限可达0.6 nM[23],并应用于自来水中铅污染分析。

图1 GR-5核酶-分子信标探针用于Pb2+检测[23]Fig.1 The mechanism of molecular beacon in Pb2+ detection[23]
纳米材料由于独特的光学、电学和磁学等性能,可作为优异的信号转导元件,广泛应用于新型传感器的构建。由于金纳米颗粒(AuNPs)的高荧光淬灭能力,Kim等开发了一种基于脱氧核酶和AuNPs的Pb2+检测荧光传感器[24],底物链通过硫醇键固定于AuNPs表面。当无Pb2+存在时,底物链与核酶链杂交吸附在AuNPs表面,荧光猝灭。加入Pb2+后,核酶链切割底物链导致其断裂,使荧光基团与AuNPs分离,显示出增强的荧光信号,该法检测限低至5 nM。利用单链DNA、双链DNA与氧化石墨烯不同的相互作用,Fan等构建了氧化石墨烯(GO)与核酶复合的探针,其机理是修饰了荧光基团的底物链与核酶链杂交形成双链DNA结构,其与GO相互作用弱,游离在溶液中,呈现强荧光信号;当体系中添加Pb2+触发核酶活性后,底物链被切割成两段,吸附到GO表面上,荧光显著猝灭。该氧化石墨烯(GO)/核酶复合探针的检测限低至0.5 nM[25]。
除上述核酶外,G-四链体也被应用于重金属铅离子污染的检测中。Pb2+可稳定G-四链体结构,利用Pb2+引发的G-四链体成型可构建Pb2+的快速传感分析。Xu等设计了一个双链核酸探针,其中一条链为G-四链体,在无Pb2+时,两条互补链杂交形成DNA双链,添加Pb2+后,其中一条链与Pb2+结合形成稳定的G-四链体结构,进一步与锌原卟啉相互作用,得到增强的荧光信号[26]。为输出响应信号,选用染料AMT作为荧光指示剂,该指示剂可与G-四链体形成络合物,导致荧光猝灭,加入Pb2+后,由于亲和力差异,导致指示剂被Pb2+置换出,显示出增强的荧光信号[27](如图2所示),该分析方法的检测限低至3.6 nM。

图2 利用AMT染料与G-四链体结合诱导猝灭的荧光Pb2+生物传感器示意图[27]Fig.2 Schematic representation of the proposed fluorescent Pb2+biosensor utilizing the binding-induced quenching of AMT to G-quadruplex[27]
此外,比色分析法作为一种简单、低成本且易于肉眼观察的检测法,在一定程度上可避免对检测设备的依赖。由于AuNPs具有高的消光系数和特殊的光学特性,常被用于比色分析[28]。Lu等使用核酶及其底物链与附着在AuNPs的DNA杂交,使AuNPs聚集成蓝色纳米颗粒组装体,当Pb2+存在时,底物链被核酶链切割,阻止AuNPs聚集,颜色从蓝色转变为红色[29],从而实现对Pb2+的可视化检测。这种底物链以“头尾”方式与DNA杂交,涉及退火过程。为了简化操作流程,该课题组引入了“尾尾”杂交设计的思路[30]。此外,利用盐诱导AuNPs聚集变色,构建一种不依赖AuNPs修饰的方法[31,32]。GR-5及“8-17”脱氧核酶均可在Pb2+的协同作用下使底物链裂解,改变AuNPs的聚集状态,导致体系颜色变化[33-35]。这种无标记的策略保持高灵敏度和良好的选择性,有助于临场铅污染可视化检测分析。
1.2 汞污染
目前已构建了一系列的Hg2+响应型核酸探针,用于汞污染的检测分析。Hg2+能特异性地连接两个胸腺嘧啶碱基(T),在DNA双链中形成稳定的T-Hg2+-T错配结构[36,37],这种错配碱基能稳定DNA双链,并且T-T碱基对只能由Hg2+稳定,确保了其对Hg2+良好的选择性。Ono和Togashi通过在富含T的寡核苷酸链两端修饰荧光基团和猝灭基团,开发了一种用于Hg2+检测的荧光传感器[38]。在添加Hg2+后,T-Hg2+-T错配使寡核苷酸链折叠成发夹状结构,荧光基团与猝灭基团靠近发生荧光共振能量转移导致荧光猝灭。然而,这种“turn-off”荧光信号的模式,可能会出现假阳性,为克服该问题,提出了一种基于“turn-on”信号的荧光传感器(如图3所示),即在无Hg2+时,荧光标记链与猝灭标记链杂交使荧光猝灭;Hg2+存在时,T-Hg2+-T错配结构导致非互补片段折叠成发夹状,并从荧光基团标记的链释放出猝灭基团标记链,从而增强荧光信号[39]。基于分子信标的传感器也被用于Hg2+分析,Hg2+可使分子信标打开,导致荧光团与猝灭剂远离并恢复荧光信号[40]。
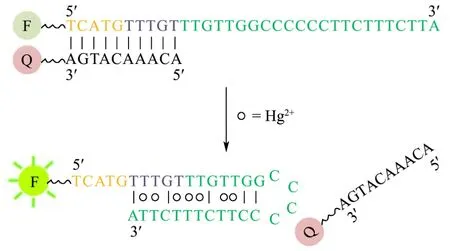
图3 基于链置换核酸探针的Hg2+荧光传感器[39]Fig.3 Schematic of the “turn-on” fluorescent mercury sensor[39]
上述荧光传感器通常需采用荧光基团或猝灭剂对核酸进行化学修饰。为避免核酸探针的化学修饰,引入了特异性核酸染料[41]。Yu等开发出一种基于靶向诱导的G-四链体结构转换的无标记Hg2+检测传感器[42]。在无Hg2+时,DNA探针在硫黄素T的辅助下折叠成G-四链体,并观察到高荧光信号。加入Hg2+后,G-四链体被Hg2+介导的T-T错配分解,导致荧光变弱。此外,利用AuNPs的荧光淬灭及与核酸探针的相互作用,构建了Hg2+荧光传感器[43]。为进一步提高检测灵敏度,复合纳米粒子如量子点与AuNPs被用于构建“turn-off”信号的荧光传感器[44],可检测水中低至6 nM水平的汞污染。
与Pb2+比色传感器类似,比色分析法在Hg2+检测中广泛使用。Lee等人报道了一种利用AuNPs显色的比色传感器[45](如图4)。AuNPs分别被两种具有T-T错配的单链DNA修饰,Hg2+的加入可促成T-Hg2+-T错配,从而导致分散的AuNPs发生聚集,颜色发生变化。通过监测溶液颜色的变化可测定Hg2+的浓度,该传感器的检测限为0.1 μM。但该方法对温度控制精度要求比较高,随后,通过引入适当的寡核苷酸链以及控制T-T错配的数量,使得该传感器在室温下实现可靠的检测[46]。同时,多种无标记比色传感器也被用于Hg2+检测,Willner报道[47],富含T的单链DNA在无Hg2+时保持单链状态,吸附在AuNPs的表面,静电排斥使AuNPs处于稳定分散状态,当加入Hg2+后,T-Hg2+-T形成诱导单链DNA形成发夹结构,从AuNPs表面脱去,导致AuNPs聚集,颜色由红色变为蓝色,其检测限可达10 nM。
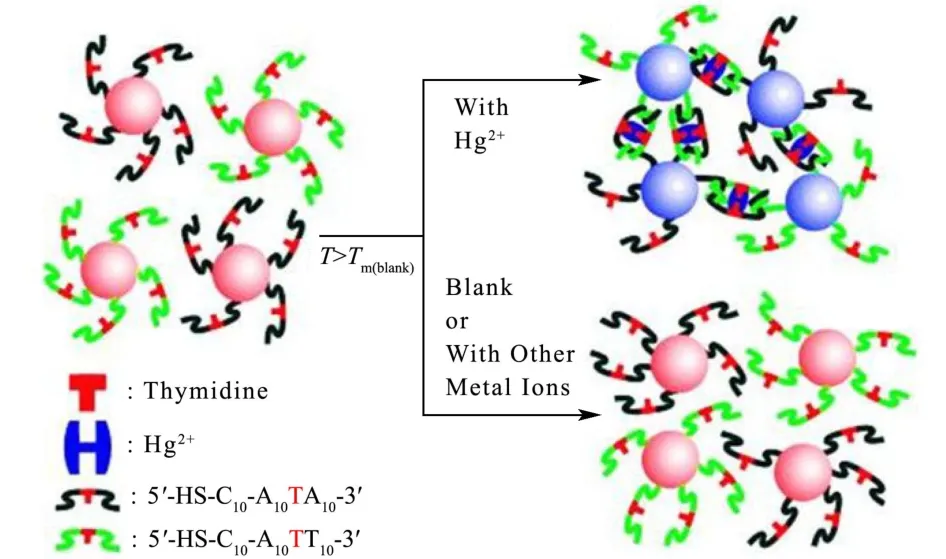
图4 核酸探针功能化的AuNPs用于比色检测Hg2+[45]Fig.4 Colorimetric detection of mercuric ion (Hg2+) using DNA-AuNPs[45]
1.3 镉污染
Cd2+特异性核酶被广泛应用于Cd2+的检测[48],但基于核酶的Cd2+检测传感平台可能存在一些缺点,由于DNA中功能基团的限制,很难将Cd2+这样的亲硫金属离子作为精准靶点,选择性较差。Liu等使用单一的硫代磷酸酯去修饰DNA以增强其对Cd2+的亲和力,该方法采用商业化碱基,不会使筛选过程复杂化,且对Cd2+具有高度的选择性。基于该核酶的传感器在缓冲液中的检测限为1.1 nM,在大米提取物中的检测限为1.6 nM[49]。Pei等采用靶向诱导释放链的方式构建了一种快速、特异性强的Cd2+检测发光生物传感器,在无Cd2+的情况下,两条标记链形成互补结构,荧光猝灭,加入Cd2+后,荧光修饰链折叠成发夹结构,不再与另一条带猝灭基团的链结合,依旧显示荧光信号[50]。为避免荧光基团、猝灭剂双重标记,Wang等报道了一种由Cd2+特异性适体构成的单标记多功能探针,Cd2+特异性适体能同时识别Cd2+并作为信号子。Cd2+可引起适体的构象转换,从一个随机的线性序列转变为一个茎环结构,荧光强度发生变化,从而建立测定Cd2+的荧光分析方法,该方法的检测限为2.15 nM[51]。
无标记Cd2+检测策略可以免除核酸探针的化学修饰,降低检测成本提高检测稳定性[52-54],Chen等开发了一种类发夹结构探针介导的头尾结合与分支迁移的无酶DNA扩增检测技术,以G-四链体为信号子,检测灵敏度高,检测限可达5 pm[55]。同样,利用G-四链体结构设计了一种超灵敏、无标记的Cd2+探针。在无Cd2+时,Cd2+特异性适体链段处于无规状态,加入Cd2+后,Gd2+适配体折叠成G-四链结构,与血红素相互作用使体系吸光度增加,检测限为0.15 nM。该方法避免了探针的标记且采用廉价的仪器直接定量分析,具有良好的动态范围[56]。类似地,通过Cd2+特异性适体诱导核酸适体的构象转换,利用两种未标记的寡核苷酸,以荧光染料 SYBR Green I作为信号子(如图5),构建了无标记核酸传感器,其检测限为0.34 μg/L,在湘江水,池塘水,自来水和矿井水检测中的回收率在98.57%~102.49%之间。该荧光传感器具有良好的选择性,无需对样品进行处理或靶向预富集便可检测实际样品中的Cd2+[57]。此外,纳米粒子也被用于Cd2+检测,Wang等通过构建特定适体与还原氧化石墨烯(rGO)/石墨氮化碳(g-C3N4)的复合体系,研制了一种电化学生物Cd2+传感器,检出限低至0.337 nM[58]。Guo等采用基于AuNPs的无标记比色法对Cd2+进行检测,设计了一种在高盐环境下利用AuNPs和谷胱甘肽(GSH)联合检测水和大米样品中Cd污染的简单、无标记比色法[59]。
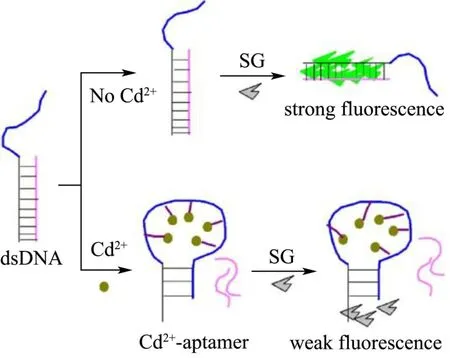
图5 以荧光染料 SYBR Green I作为信号分子的Cd2+检测生物传感器[57]Fig.5 The design principle for the Cd2+ determination with SYBR green I[57]
2 基于核酸探针的食品重金属污染检测
2.1 微流体芯片检测
由于高通量、快速、易于操作及良好的可靠性,基于功能核酸的微流体芯片在重金属离子检测方面引起越来越多的关注[60-62]。Shaikh等通过Pb2+特异性核酶构建了一种模块化结构的微流控芯片系统,该传感器可以在1 nL的溶液中可检测浓度低至500 nM的Pb2+[63]。Lu等介绍了一种实时监测Pb2+的微流体平台,其通过微流体装置表面的链霉亲和素将荧光标记的Pb2+特异性核酶固定在壁上,固定化的核酶保留了对Pb2+的检测活性。仅在Pb2+存在时,核酶才切割其互补底物链,同时荧光标记将切割事件转化为与Pb2+浓度成比例的光学信号[64]。基于T-Hg2+-T错配结构,Liu等开发了与微阵列技术兼容的荧光芯片传感器,可在“turn-on”或“turn-off”模式下对Hg2+进行无试剂、一步式的检测,“turn-off”模式比“turn-on”模式的灵敏度稍高,检测限分别为3.6 nM和8.6 nM,且通过检测饮用水和鲜奶中的加标Hg2+,证明了该芯片传感器在现场实际检测中具有巨大潜力[60]。利用微阵列结构,Ye等通过将Cu2+/Pb2+依赖的核酶与固定于玻片表面的底物结合,构建了一种多目标检测的微芯片传感器。在无金属离子的情况下,探针与底物杂交,产生强荧光信号;加入相应金属离子后,底物裂解,导致荧光强度发生显著变化,该传感器可对整个微阵列直接成像[65]。Lu等使用“8-17”核酶和AuNPs构建了用于检测Pb2+的侧向流动装置,检出限为0.5 μM,且无需使用任何仪器便可达到可视化效果[66]。为提高灵敏度,Chen等在微流体芯片检测技术中引入扩增策略,Pb2+将底物链切割成两个片段,释放出的裂解产物充当催化剂以触发核酸杂交、分支迁移和置换,从而放大信号,达到对Pb2+的扩增检测。此策略无需使用仪器即可目测低至浓度为10 pM的Pb2+[67]。基于相似的思路,一种通过核酸外切酶辅助信号放大的带状生物传感器使用AuNPs作为示踪剂(如图6),被用于水溶液中的Hg2+可视化检测,具有良好的回收率和准确性[68]。基于纸基的微流控分析设备具有制备简单、所需样品量少、可润湿性及易于存储的优点[69]。Zhang等报道了一种纸基微流控的电化学发光传感器,能同时检测Pb2+和Hg2+,首先将DNA链沉积到功能化的蜡纸上,通过Pb2+和Hg2+诱导功能核酸构象转变形成G-四链体和T-Hg2+-T错配结构,使Si@CNCs和Ru@AuNPs分别在阴极和阳极上显示出信号,实现了在一个纸工作区同时检测两种金属离子[70]。

图6 基于外切酶信号放大的胶体金试纸用于汞离子检测[68]Fig.6 Schematic illustration of the strip biosensor for the visual detection of the formed ssDNA product[68]
2.2 基于小型便携设备的检测平台
在食品重金属离子检测中,由于区域范围广、样品数量多,迫切需要快速、经济有效且可进行临场检测的便携式检测平台。Lu等采用生活中广泛使用的血糖仪作为检测平台对有毒金属离子(如Pb2+和Uo2+)进行检测,此传感器的机制是将具有特定识别功能的DNA-转化酶结合物固定在磁珠上,添加相应的金属离子后,底物被切割释放出侵入性DNA,与DNA-转化酶偶联物竞争磁珠上的DNA,诱导DNA-转化酶结合物从磁珠上释放,用磁铁除去磁珠后,含有结合物的溶液可以有效地催化蔗糖转化为葡萄糖。由于溶液中转化酶的浓度与样品中靶标的浓度成正比,因此血糖仪的读数可用于定量靶标浓度[71,72]。Tang等开发了两种基于血糖仪的便携式定量传感器。一种是利用Pb2+特异性核酶封端装载了葡萄糖的介孔二氧化硅纳米颗粒(MSN)(如图7所示),当引入Pb2+后,底物链被切割,导致葡萄糖从MSN中释放,通过检测所得溶液中释放的葡萄糖分子,可测定低至1 pM的Pb2+[73]。另一种设计是Pb2+特异性核酶固定在链霉亲和素修饰的微板上,利用单链DNA和转化酶标记的AuNPs作为信号转化载体,向微孔板中加Pb2+后,固定核酶的底物链被切割,微孔板中新生成的单链DNA,可再次与AuNPs上的单链DNA杂交,使微孔板携带上转化酶,转化酶可将蔗糖转化为葡萄糖,进而使用血糖仪读数,检测Pb2+。该法具有高度重现性和对目标Pb2+的高选择性,可用于监测加标饮用水样品中的Pb2+[74]。
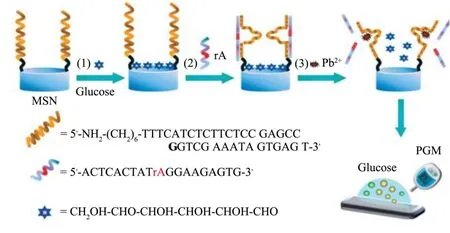
图7 基于MSN和便携式血糖仪的DNA生物传感器用于Pb2+检测的示意图[73]Fig.7 Schematic illustration of PGM-based Pb2+ sensor and measurement principle based on target-responsive release of glucose from DNAzyme-linked silica nanoparticles with a glucometer readout[73]
Chen等人提出了一种基于智能手机的比色传感策略,主要是利用T-Hg2+-T错配和AuNPs聚集状态不同所显示出的颜色不同,为避免使用复杂的设备并最大程度地减少数据分析和对传输功率的要求,将多个检测结果集中在基于纤维素的纸张分析设备上,随后通过智能手机云端进行数据的计算、传输和存储(如图8)。该法所提出的平台具有在资源受限的环境中进行灵敏且高通量的现场汞污染监测的能力,对于Hg2+加标的池塘水和河水,检测限为50 nM,且可在40 min的转换时间内同时执行多个测试[75]。类似的智能手机比色系统被用于水样中Cd2+的快速和高通量测定,Wang等基于适体功能化AuNPs开发出一种智能手机比色系统可在10 min内快速捕获并分析比色变化,该法具有较高的选择性和灵敏度,线性范围为2-20 μg/L,检出限为1.12 μg/L,实现Cd2+的定量检测,为实际应用中Cd2+的现场测定提供了参考[76]。此外,基于光盘的分析检测平台由于对不同场景的可扩展性以及对数据记录和读取的强大能力受到关注。Zhang等将DNA分子信标探针固定于数字视频光盘上制备了探针阵列,用于定量Hg2+和Pb2+。被固定在光盘上的DNA探针最初呈折叠发夹状,Hg2+和Pb2+的存在会导致发夹结构的“打开”形成稳定的G-四链体和T-Hg2+-T结构,末端生物素部分的暴露与AuNPs-链霉亲和素络合物结合,同时促使银沉积而增强识别型号,最后使用计算机驱动读取可量化的数字信号。该方法对Hg2+和Pb2+显示出较宽的响应范围和低检测限,且实现了对大米中重金属含量的测定[77]。小型便携设备检测平台的开发为重金属离子临场检测奠定了基础。

图8 基于智能手机的现场比色传感策略[75]Fig.8 Schematic illustration of the proposed on-site Hg2+sensing strategy[75]
3 结论
功能核酸具备良好的稳定性和对重金属离子的强亲和力,可以构建重金属传感检测平台,在食品重金属污染分析领域具有良好的应用前景。与其他重金属分析方法相比,核酸探针即使在复杂环境中也能保持对特定金属离子的选择性和检测稳定性,可应用于实际食品样品检测。同时,功能核酸与重金属离子的结合可引发信号转导,产生荧光、电化学和颜色变化等信号,实现高效快速的重金属污染检测。此外,将功能核酸和纳米材料整合至生物传感器中,利用纳米材料的光、电、磁性能,可显著提升检测灵敏度和响应速率,与血糖仪、智能手机等便携式设备联用开发,在重金属临场检测领域有一定的应用潜力。尽管目前基于功能核酸检测重金属离子的相关产品离商业化还有距离,但随着对功能核酸对靶点识别机制的研究以及核酸和纳米材料合成技术的迅速发展,基于功能核酸的分析方法的可靠性、稳定性和灵敏度将进一步提升,必将促进其在食品重金属污染领域的广泛应用。

