PCT、TNF-α和Th17在肝移植术后患者中的表达及对肝移植术后感染的预测价值
吴雅婷,师 婷,张 锦,高 娣
随着器官移植技术的进步,肝移植手术已逐渐成为终末期肝病患者的有效治疗手段[1]。然而,有相关研究发现,肝移植手术患者术前和术后补体和免疫球蛋白等水平较低,且术中大量输注血制品和过量使用麻醉剂,术后各种导管留置和呼吸机使用等,导致术后感染概率较大[2]。因此,如何降低肝移植术后感染情况,保证患者治疗效果是目前临床研究热点。
肝移植术后感染可使患者各种实验室指标发生变化[3]。降钙素原(procalcitonin,PCT)作为诊断细菌感染的敏感指标,广泛应用于临床,在多种感染性疾病中呈高表达状态[4]。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是人体内最常见的炎性因子。有文献报道TNF-α可促进自由基及炎性介质等释放,加重感染情况[5]。辅助性T淋巴细胞17(T helper cell 17,Th17)是近年新发现的一种CD4+细胞亚群,可特异性产生白细胞介素,在自身免疫性疾病和机体防御反应中具有重要的意义[6]。本研究探讨PCT、TNF-α和Th17在肝移植术后患者中的表达及对肝移植术后感染的预测价值,现报告如下。
1 资料与方法
1.1一般资料 选取2017年1月—2019年5月在空军军医大学第一附属医院西京医院行肝移植手术且符合纳入及排除标准的肝移植术后120例作为研究组,男81例,女39例;年龄34~65(51.41±5.71)岁;原发性肝癌合并肝硬化59例,肝硬化失代偿32例,原发性肝癌18例,先天性胆道疾病6例,转移性肝癌5例。另选取同期在该院进行体检的健康体检者98例作为对照组,男53例,女45例;年龄35~66(51.69±5.75)岁。根据是否发生术后感染[7]将肝移植术后120例分为感染组(69例)和未感染组(51例)两组。各组一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准同意执行。
1.2纳入及排除标准 纳入标准:①所有患者均顺利完成肝移植手术;②临床资料完整;③患者和(或)其家属签署相关知情同意书。排除标准:①合并肝肾功能严重不全及恶性肿瘤者;②合并精神疾病无法配合本研究开展者。
1.3研究方法 研究组术后均给予免疫抑制等对症支持治疗。收集所有入选者临床资料,比较研究组与对照组及感染组与未感染组PCT、TNF-α和Th17水平,应用多因素Logistic回归分析探讨肝移植术后感染的影响因素,应用受试者工作特征(ROC)曲线分析PCT、TNF-α、Th17及3项联合检测对肝移植术后感染的预测价值。
1.4检测方法和判断标准 研究组于肝移植术后次日,对照组于体检当日清晨抽取空腹静脉血5 ml,使用乙二胺四乙酸抗凝处理后,3000 r/min离心10 min,取上清液备用。应用德国罗氏公司生产的E601电化学发光自动免疫分析仪检测PCT水平;采用酶联免疫吸附试验检测TNF-α水平,试剂盒购自欣博盛生物科技有限公司;采用美国BD公司生产的流式细胞仪检测Th17水平。所有操作均严格按照仪器或试剂盒配套说明书由专业人员进行。
PCT判定标准[4]:PCT<0.5 ng/ml为正常,PCT≥0.5 ng/ml为升高。TNF-α判定标准[5]:TNF-α<30 pg/ml为正常,TNF-α≥30 pg/ml为升高。Th17判定标准[6]:Th17<1%为正常,Th17≥1%为升高。
术后长期使用抗菌药物标准[8]:采用世界卫生组织推荐的限定日剂量(DDD)、药物利用频度(DDDs)和药物利用指数(DUI)作为评价用药是否合理的依据,本研究DDD值以《新编药物学》[9]及药品说明书规定的日剂量为准,DDDs=总用药量/DDD,DUI=DDDs/总用药天数,DUI≤1为用药量基本合理。
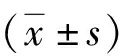
2 结果
2.1研究组和对照组PCT、TNF-α和Th17水平比较 研究组PCT、TNF-α和Th17水平高于对照组,差异有统计学意义(P<0.01),见表1。

表1 肝移植术后患者和健康体检者两组PCT、TNF-α和Th17水平比较
2.2感染组与未感染组PCT、TNF-α和Th17水平比较 感染组PCT、TNF-α和Th17水平高于未感染组,差异有统计学意义(P<0.01),见表2。

表2 肝移植术后感染与未感染两组PCT、TNF-α和Th17水平比较
2.3肝移植术后感染影响因素分析 多因素Logistic回归分析结果显示,术后长期使用抗菌药物、深静脉导管留置时间≥9 d和PCT、TNF-α、Th17水平升高为影响肝移植术后感染的独立危险因素(P<0.05或P<0.01),见表3。
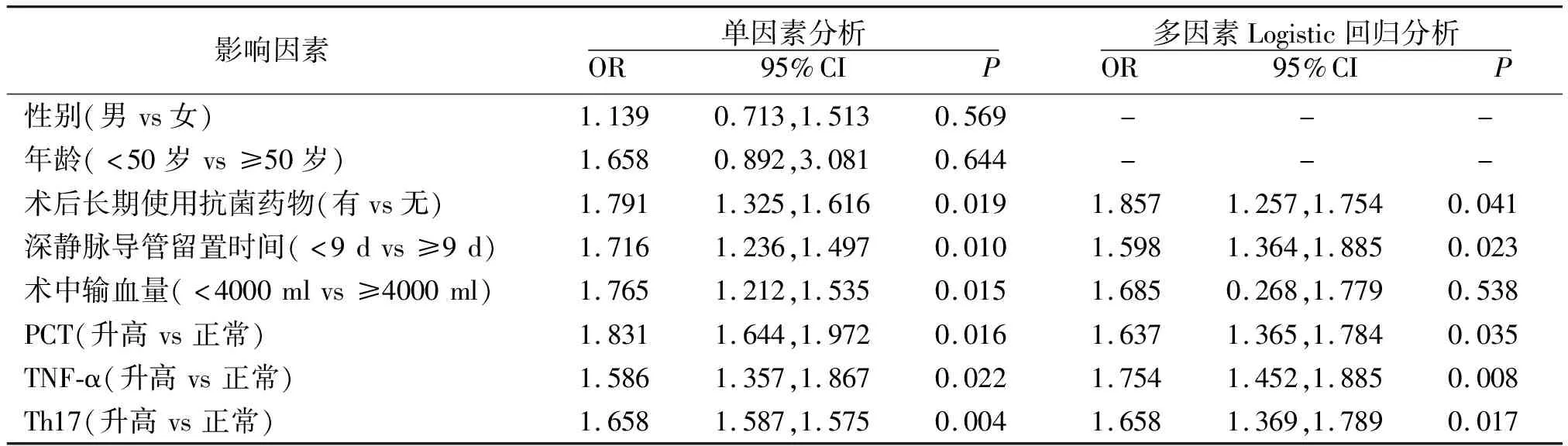
表3 肝移植术后感染影响因素分析
2.4PCT、TNF-α、Th17及3项联合检测对肝移植术后感染预测价值 ROC曲线分析结果显示,PCT、TNF-α、Th17及3项联合检测对肝移植术后感染预测价值的约登指数分别为0.626、0.638、0.624、0.788;曲线下面积分别为0.789、0.777、0.729和0.912,其中以PCT、TNF-α和Th17 3项联合检测的曲线下面积最大,见图1和表4。

表4 PCT、TNF-α、Th17及3项联合检测对肝移植术后感染预测价值的ROC曲线分析结果
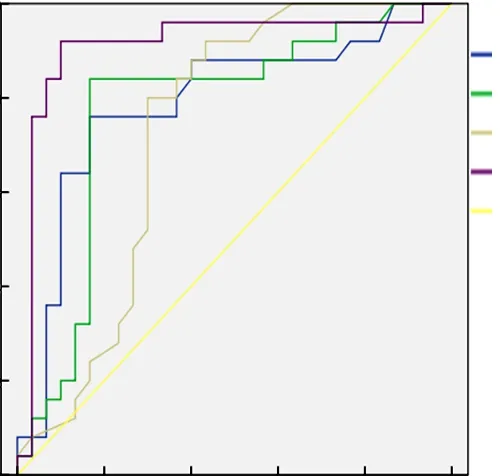
图1 PCT、TNF-α、Th17及3项联合检测对肝移植术后感染预测价值的ROC曲线
3 讨论
有研究报道,手术创伤和免疫抑制剂使用会削弱肝移植患者免疫系统,导致肝移植术后感染风险显著增加[10-13]。另有相关研究发现,细菌感染是导致肝移植术后死亡的主要原因之一[14-17]。因此,寻找快捷、可靠的术后感染诊断方法对肝移植患者具有重要意义。
PCT是一种无激素活性降钙素前体,正常情况下主要于甲状腺及肺部神经内分泌细胞表达并裂解成降钙素,一旦机体遭受细菌感染,PCT水平可快速上升,且其升高程度与感染呈正相关[18]。有相关研究显示,PCT水平变化与细菌感染密切相关,感染严重时PCT迅速升高,感染控制时PCT明显下降,其不受机体免疫抑制状态的影响[19]。Harputluoglu等[20]研究发现,PCT对感染诊断具有特异度高和敏感度好等优势。Ossami Saidy等[21]对肝移植术后感染进行研究发现,肝移植术后感染患者PCT水平显著高于未感染患者及正常人群,提示PCT对肝移植术后感染具有一定诊断价值。本研究结果显示,研究组PCT水平高于对照组,感染组PCT水平高于未感染组,差异有统计学意义,与上述Ossami Saidy等[21]的研究结果基本一致。本研究多因素Logistic回归分析结果显示,PCT水平升高为影响肝移植术后感染的独立危险因素,进一步证明PCT水平变化与肝移植术后感染密切相关,可作为评估肝移植术后感染的指标。
TNF-α是由单核细胞和巨噬细胞分泌的一种炎性介质。有研究证实TNF-α可诱导前列腺素E2、胶原酶的分泌和滑膜细胞的合成,促进炎症反应发生[22]。Dohna Schwake等[23]研究发现TNF-α可诱导上皮及内皮细胞使肾脏固有细胞异常增殖,造成炎性因子表达升高,直接损伤系膜细胞;且其还具有促纤维化作用。本研究结果显示,研究组TNF-α水平高于对照组,感染组TNF-α水平高于未感染组,差异有统计学意义;多因素Logistic回归分析结果显示,TNF-α水平升高为影响肝移植术后感染的独立危险因素。说明TNF-α水平升高与肝移植术后感染有密切关系。
Th17是由辅助性T淋巴细胞0在白细胞介素-6和白细胞介素-23的刺激下分化而成的辅助性T淋巴细胞,主要分泌白细胞介素-17、白细胞介素-21和白细胞介素-23等促炎因子,在自身免疫调节中起着重要作用。有文献报道,Th17在多发性硬化、类风湿性关节炎和过敏性疾病等自身免疫性疾病中表达增加[24]。近年,有学者研究发现,辅助性T淋巴细胞1是参与移植急性排斥反应的主要免疫细胞,Th17通过招募中性粒细胞促进炎症反应[25]。同时,有学者在动物实验中发现,Th17可诱导炎性细胞释放炎性因子,加重血管病变,导致受检者免疫系统损伤[26]。本研究结果显示,研究组Th17水平高于对照组,感染组Th17水平高于未感染组,差异有统计学意义;多因素Logistic回归分析结果显示,Th17水平升高为影响肝移植术后感染的独立危险因素。说明Th17与肝移植术后感染密切相关,肝移植术后感染患者Th17水平升高,但关于其具体机制现尚未明确,还需进一步深入研究。
此外,本研究ROC曲线分析结果显示,PCT、TNF-α、Th17及3项联合检测对肝移植术后感染预测价值的曲线下面积分别为0.789、0.777、0.729和0.912,其中以PCT、TNF-α和Th17 3项联合检测的曲线下面积最大。提示临床可通过PCT、TNF-α和Th17 3项联合检测提高对肝移植术后感染的预测价值。
综上所述,PCT、TNF-α和Th17在肝移植术后和肝移植术后感染患者中呈异常状态。术后长期使用抗菌药物、深静脉导管留置时间≥9 d和PCT、TNF-α、Th17水平升高为影响肝移植术后感染的独立危险因素。PCT、TNF-α和Th17 3项联合检测对肝移植术后感染有一定预测价值。

