胃息肉临床特点及相关危险因素分析*
黄琳凯 周英发 付文静 杨瑜 郭帆 朱家佳 胡顺航 丁丹丹
(郑州大学第二附属医院消化内科, 河南 郑州 450014)
胃息肉是指突出于胃黏膜表面的隆起性病变,通常无明显的的症状或体征。据统计,早期胃癌5年生存率约90%,而胃息肉作为癌前病变,近年来检出率逐年提高[1],因此胃息肉的防治对胃癌的预防意义重大。目前,对于胃息肉的诱因、病因以及危险因素尚缺乏共识。因此,本研究通过回顾性分析2014年1月~2019年12月我院消化内科胃息肉病例数据,探讨胃息肉的临床特点及相关危险因素,以期对胃息肉的预防及临床诊疗提供依据。现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月~2019年12月于郑州大学第二附属医院消化科行胃镜检查的15312例患者资料,其中胃息肉患者1424例(胃息肉组),无胃息肉患者13888例(无息肉组)。搜集两组患者相关临床资料,分析胃息肉的临床特点及相关危险因素。纳入标准:①胃息肉组经病理确诊胃息肉。②同期行幽门螺杆菌(Helicobacter pylori,Hp)、血压、血糖及血脂测定。排除标准:①临床资料不完整。②合并消化道肿瘤、胃部手术史、遗传性胃肠道息肉综合征。
1.2 研究方法 通过医院病历系统收集研究对象的一般临床资料(性别、年龄、饮酒状态、吸烟状态)、胃息肉病理资料、胃黏膜情况、Hp感染情况,以及血糖、血脂情况等。其中,①胃息肉通过胃镜检查发现,并于镜下行息肉切除送病理确诊;胃黏膜状态通过胃镜镜下判断是否存在萎缩;Hp感染通过 C13或C14 呼气试验测定,患者检查前需停用抗生素 4 周以上,停用质子泵抑制剂、H2 受体拮抗剂或铋剂 2 周以上。C13和C14试剂盒阳性判断值分别为≥4.0、≥100 时,可判定受检查者 Hp 阳性。②血压测定通过电子血压计测量获得,平静状态下收缩压≥140 mmHg或舒张压≥90 mmHg或既往有高血压病史现需药物维持血压正常可诊断为高血压。③血脂测定通过抽取空腹静脉血,总胆固醇≥5.2 mmol/L,低密度脂蛋白≥3.4 mmol/L,或甘油三酯≥2.3 mmol/L或既往有高脂血症病史现需药物维持血脂正常诊断为高脂血症。④血糖情况通过抽取空腹静脉血,监测2次空腹血糖≥7.0 mmol/L或既往有糖尿病病史现需药物维持血糖正常可诊断为糖尿病。
1.3 胃息肉的病理分型 目前国内常用的胃息肉病理分型[2]为增生性息肉、胃底腺息肉、腺瘤性息肉、炎症性息肉,见图1。
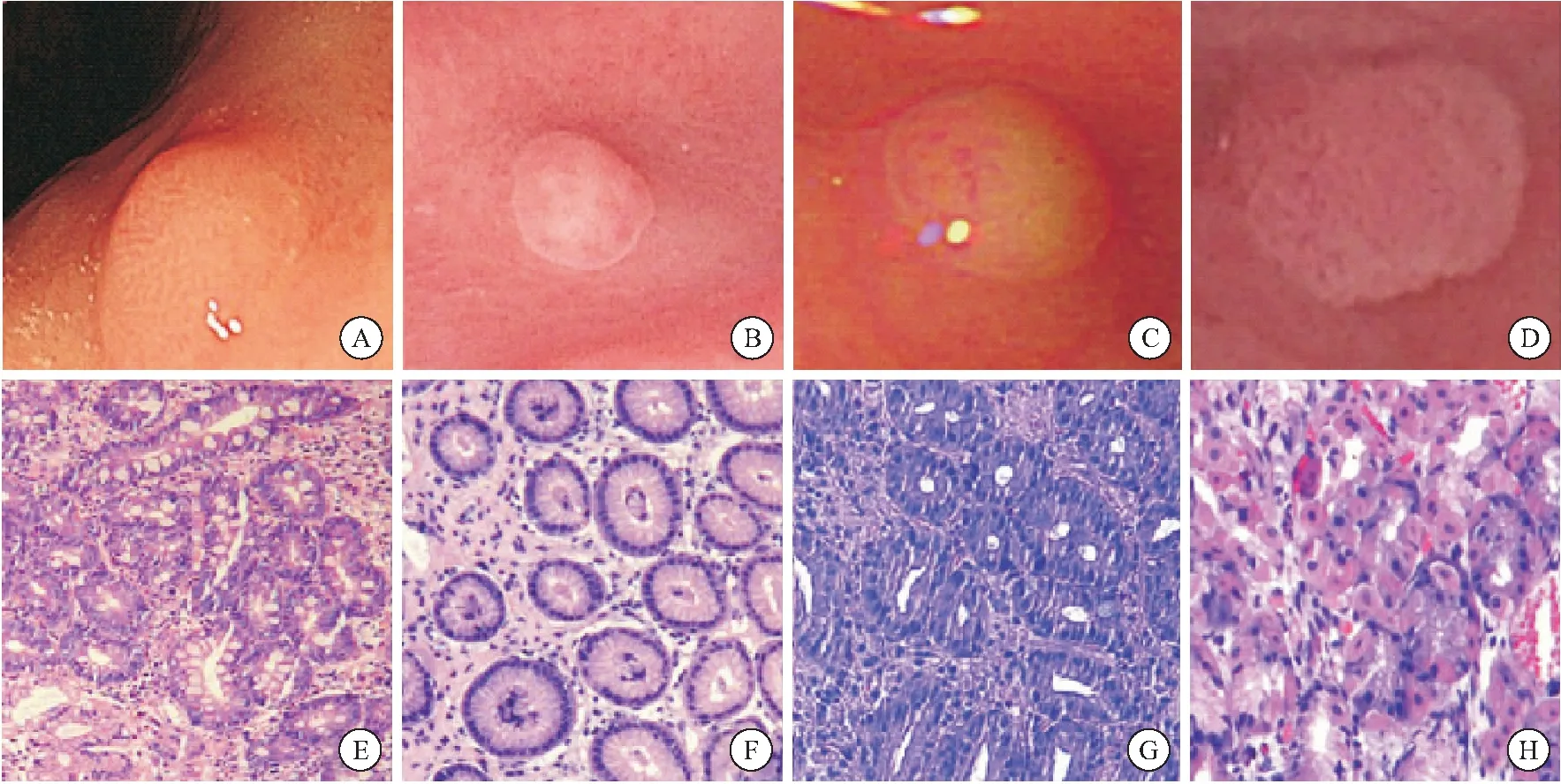
图1 不同病理类型胃息肉内镜特点及组织学特征(100×)

2 结果
2.1 胃息肉患者的一般情况 息肉组中男、女患者分别为455例(32.0%)、969例(68.0%),其中息肉多发生于40~60岁女性,而腺瘤性息肉全部发生40岁以上的患者,见表1。
2.2 胃息肉的个数和大小及构成 胃息肉以单发息肉常见,765例,占胃息肉总数的53.7%;而胃底腺息肉以多发常见,279例,占该病理类型的52.8%;息肉直径<5 mm的有1192例,占胃息肉总数的83.7%,而腺瘤性息肉直径>5 mm的有32例,占该病理类型的68.1%(表1)。
2.3 胃息肉的发生部位及构成 胃底和胃体是胃息肉的主要发生部位,分别为656例(46.1%)、543例(38.1%);其中胃底腺息肉、增生性息肉分布在胃底和胃体的例数分别为592例、425例,占各自病理类型的100%、77.7%;而腺瘤性息肉分部在胃窦的例数为37例,占该病理类型的总数的78.7%(表1)。
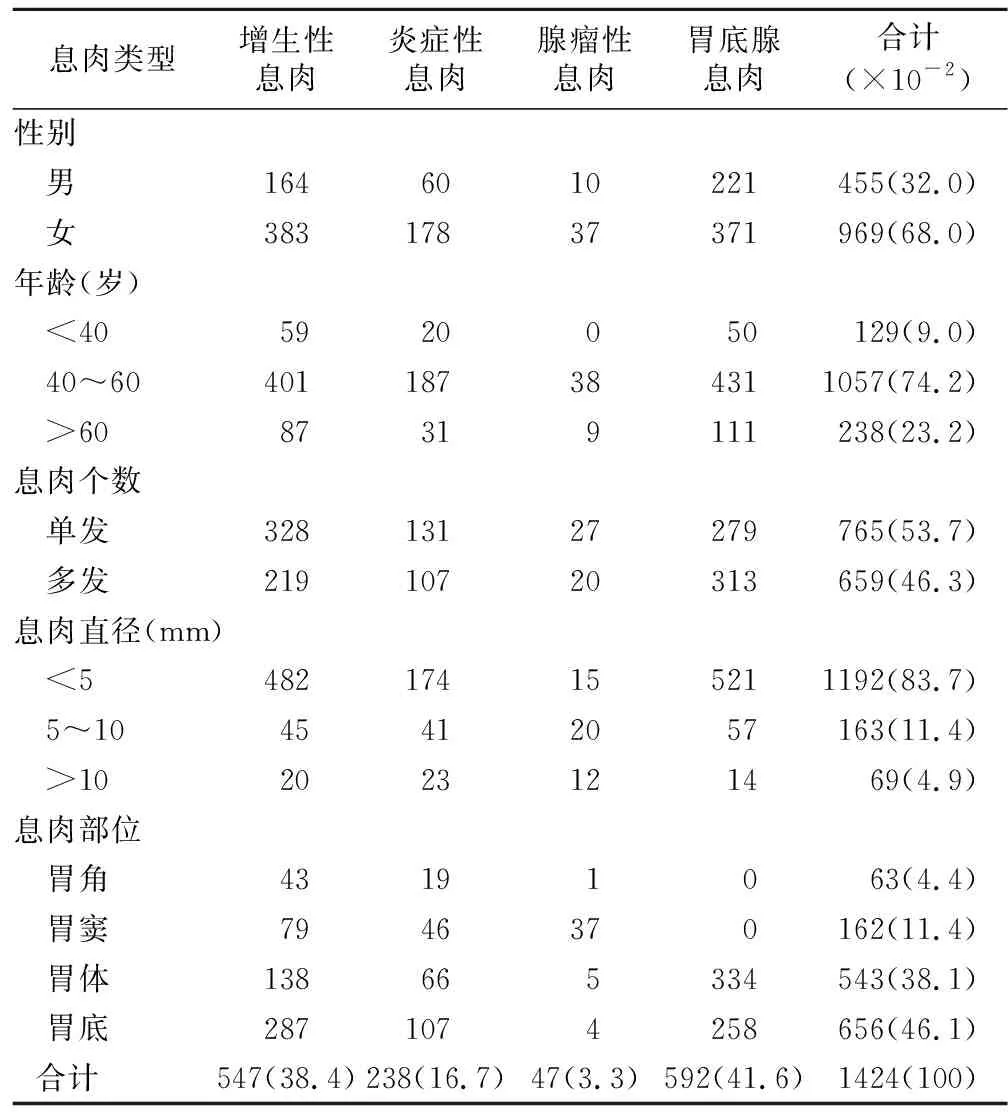
表1 胃息肉患者一般资料及其病理特点
2.4 胃息肉的病理类型及构成 以胃底腺息肉、增生性息肉居多,各占胃息肉总数的41.6%和38.4%;近年来胃底腺息肉构成比有明显提高,从2014年48例(该年度胃息肉总数的26.2%)到2019年的156例(该年度胃息肉总数的51.3%)(图2)。

图2 2014~2019年胃息肉病理类型变化
2.5 胃息肉组及无息肉组一般资料 息肉组1424例,女性969例;无息肉组13888例,女性6835例,息肉组女性比例高于无息肉组(P<0.05)。息肉组平均年龄高于无息肉组(P<0.05)。息肉组在吸烟、饮酒、高血压、高脂血症、糖尿病、胃黏膜萎缩等方面明显高于无息肉组(P<0.05),而在Hp感染方面比较差异无统计学意义(P>0.05),见表2。

表2 两组一般资料比较[n(×10-2)]
2.6 胃息肉危险因素分析 将单因素分析P<0.15的因素纳入logistic回归分析,逐步回归分析得出女性、吸烟、饮酒、糖尿病、胃黏膜萎缩、年龄是胃息肉发病的相关危险因素,见图3。
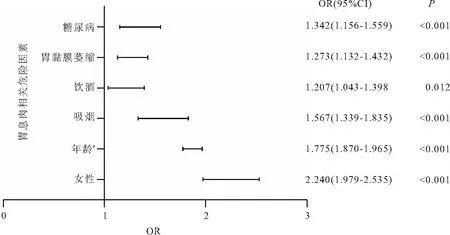
图3 胃息肉危险因素Logistic回归分析
3 讨论
胃息肉是突出于胃腔的隆起性病变,大多为良性病变,但仍有部分存在恶变的可能。本研究发现胃息肉的检出率约为9.3%,明显高于Olmez等[3]报道的0.3%~6.7%,说明胃息肉发病率在不同地域、种族、人群中存在差异。本研究发现胃息肉多发生在中年女性,男女比例1∶2.13,40岁以上患者高达90.9%,单发息肉占胃息肉总数的53.7%,胃息肉大小多<5 mm,占胃息肉组总数的83.7%,与国内相关报道[4-5]基本一致。过去增生性息肉最为常见,增生性息肉占息肉总数的30%~93%,这类息肉通常伴有Hp感染[6],随着标准化根除Hp,增生性息肉逐渐减少,现以胃底腺息肉居多。何金龙等[7]研究发现2007~2016年某三甲医院胃底腺息肉由25.04%上升到48.47%,但胡文聪等[8]研究认为炎症性息肉和增生性息肉仍目前胃息肉的主要病理类型。本研究显示近年来胃底腺息肉构成比有明显升高。相关学者认为质子泵抑制剂PPI可能是导致该变化的相关因素,原因是长期应用PPI可使胃酸分泌减少,胃泌素代偿性增高,导致胃底腺增生肥大[9],而Tran-Duy 等[10]研究表明服用PPI不足1年不会增加胃息肉的发生,而长期服用PPI可使胃底腺息肉的患病危险增加4倍。
目前越来越多的研究认为Hp感染与胃息肉发病的存在一定相关性[11],故将HP感染纳入多因素分析,通过二元logistic逐步回归分析得出胃息肉发病与性别、吸烟、饮酒、胃黏膜萎缩、糖尿病、年龄存在相关性,而与HP感染、高血压及高脂血症无明显相关性。但根据世卫组织国际癌症研究机构的研究提供的流行病学证据,Hp感染可导致胃癌[12],因此需重视Hp感染,应早检测早治疗。陆金燕等[13]研究发现高脂血症特别是低密度脂蛋白与血管内皮下蛋白聚糖存在相关作用,可导致胃黏膜微小血管硬化和损伤,而高血压与高脂血症可共同作用增加胃微小血管的损伤风险。此外目前研究表明高脂血症、高血压与糖尿病之间密切相关[14],因此对于高血压、高血脂患者应该及时予以医学干预。本研究发现女性发生胃息肉的风险是男性的2.24倍,其原因可能是女性精神心理疾病较男性多见,而不良的心理健康可以抑制副交感神经, 抑制乙酰胆碱的表达, 激活交感神经并促进肾上腺髓质的释放, 从而促进胃息肉的形成[15-16]。赵曲川[17]研究也发现胃息肉患者与焦虑状态存在相关性。本研究发现饮酒、吸烟是胃息肉的危险因素,可能是因为酒精和烟草中的尼古丁可对胃黏膜造成直接损伤,酒精具有亲脂性和溶脂性能,可导致胃黏膜出血和糜烂,尼古丁可引起胃黏膜下小血管痉挛收缩,引起胃黏膜缺血、缺氧,经常饮酒、吸烟容易导致胃黏膜反复损伤、修复出现胃部的慢性炎症,进一步导致胃息肉的发生。Dinis-Oliveira 等[18]研究认为大量饮酒可引起胃黏膜损害, 导致胃黏膜中肥大细胞介导的慢性炎症, 在炎症的基础上逐渐形成胃息肉。Sonnenberg等[19]在小鼠胃息肉形成的研究表明,吸烟可促进慢性炎症的形成及随后胃腺瘤的形成。本研究发现胃黏膜萎缩是胃息肉发生的危险因素。有研究认为胃息肉几乎不发生在正常胃黏膜表面, 常见于慢性萎缩性胃炎的胃黏膜表面[20];也有研究认为胃黏膜萎缩与腺瘤性息肉发生相关[21],而腺瘤性息肉是目前公认的癌前病变,癌变率为6%~47%[22]。因此患有萎缩性胃炎的患者应警惕息肉的发生,需定期行胃镜检查。本研究发现糖尿病是胃息肉发生的危险因素,糖尿病可以造成机体各系统重要脏器血供及代谢功能障碍,降低机体防御及修复功能,可间接导致胃息肉的发生。刘宁[23]研究认为控制糖尿病对血管病变尤为重要,因此糖尿病患者需控制好血糖,并定期行胃镜检查。相关研究[12]认为年龄和不健康的生活方式行为是胃息肉的独立危险因素。本研究发现年龄是胃息肉发生的危险因素,年龄每增长5岁胃息肉发病风险增加0.775倍。这可能因为年长者胃黏膜受各种刺激时间较长,胃黏膜反复修复,在一定程度可增加胃息肉的发病。
4 结论
胃息肉多发于40岁以上人群,多以胃底腺息肉和增生性息肉为主,常位于胃底和胃体,以单发常见,直径常<5 mm;女性、吸烟、饮酒、胃黏膜萎缩、糖尿病、高龄是胃息肉发病的相关危险因素,需引起重视。因此,建议年龄大于40岁的高危人群需常规行胃镜健康检查,此外还要加强健康宣教,劝导戒烟戒酒,监测并控制血糖,保持健康生活习惯。

