丙泊酚激活线粒体凋亡通路诱导乳头状甲状腺癌TPC-1细胞凋亡和生长阻滞*
张子曦 王永顺 向洪聪 肖志波 夏学鑫 蔡志强
(1.湖北江汉油田总医院麻醉科,湖北 潜江 433124;2.潜江市中心医院麻醉科,湖北 潜江 433100;3.武汉科技大学附属医学院麻醉科,湖北 武汉 430064)
甲状腺癌是最普遍的内分泌恶性肿瘤,其发病率在全世界范围内每年以3%的速度不断增长[1]。乳头状甲状腺癌是最常见的甲状腺癌类型,占整个甲状腺癌病例约90%[2]。当前甲状腺癌的治疗选择通常是手术切除或放射碘治疗,在大多数情况下,乳头状甲状腺癌在手术切除后预后良好,少数患者会复发或者发生远处转移[3]。因此,迫切需要开发旨在阻断乳头状甲状腺癌进展的新治疗策略。丙泊酚作为常用的静脉麻醉药,近年研究发现,丙泊酚(propofol,PPF)还可能具有抗肿瘤作用,如在肾癌、胃癌和胶质瘤等肿瘤治疗过程中还表现出较好的抑瘤作用[4-6]。目前仍尚不清楚丙泊酚对乳头状甲状腺癌的影响机制。因此,本研究拟在离体条件下探究丙泊酚通过线粒体凋亡通路对乳头状甲状腺癌TPC-1细胞凋亡和生长的影响。
1 材料和方法
1.1 试验药物和主要试剂 丙泊酚(100806-201803)购自中国食品药品检定研究院,化学式:C12H18O,分子量:178.27,纯度≥99.9%,Dulbecco's modified Eagle's medium培养基(12100-046)、胎牛血清(10082-147)、胰蛋白酶(25200-056)、青-链霉素(15140-122)购自美国Gibco公司,BRDU细胞增殖检测试剂盒(C0071S)、BCA蛋白浓度测定试剂盒(P0012S)、Annexin V-FITC细胞凋亡检测试剂盒(C1062S)、线粒体膜电位检测试剂盒JC-1(C2006)购自上海碧云天生物技术研究所,总超氧化物歧化酶测定试剂盒(A001-3-2)、丙二醛测定试剂盒(A003-1)、谷胱甘肽过氧化物酶(A005-1-2)购自南京建成生物工程研究所,Anti Ki67(ab15580)、PCNA(ab18197)、Bcl-2(ab196495)、Bax(ab53154)、Caspase-3(ab13847)、cleaved Caspase-3(ab2302)、Caspase-9(ab52298)、cleaved Caspase-9(ab2324)、c-Myc(ab39688)购自美国Abcam公司。
1.2 细胞培养 人乳头瘤状甲状腺癌细胞TPC-1来源于中国科学院典型培养物保藏委员会细胞库,细胞培养于10%胎牛血清和1%青-链霉素的高糖DMEM培养基中,并放置在37 ℃,5% CO2恒温培养箱中。培养基每2~3天更换一次,当需要收集细胞时,用0.25%胰蛋白酶消化。试验用细胞为对数生长期细胞。
1.3 细胞处理和分组 采用0、12.5、25、50 μM剂量[7]丙泊酚处理TPC-1细胞,将细胞随机分为PPF 0 μM组、PPF 12.5 μM组、PPF 25 μM组和PPF 50 μM组4组。
1.4 BrdU染色 将细胞传代接种于6孔板内,待细胞融合率达80%时,用含0.4 %FBS的培养液同步化孵育72 h。加入终浓度为0.03 μg/mL的BrdU继续孵育40 min。PBS洗涤细胞3次,用多聚甲醛固定10 min,严格按照说明书进行细胞增殖检测。镜下观察并计数BrdU阳性细胞数。
1.5 克隆形成法 在培养皿中培养细胞至大约30%汇合度,继续培养4 d,吹散为单个细胞,用6孔板培养,约500个细胞每孔,培养14天,弃掉培养基,用乙醇固定30 min,接着用0.5%结晶紫染色,用去离子水漂洗晾干,进行拍照观察。
1.6 流式细胞仪检测细胞凋亡 收集悬浮细胞至10 mL的离心管中,每样本细胞数为3×106/mL,500~1000 r/min离心5 min,弃去培养液,用孵育缓冲液洗涤1次,500~1000 r/min离心5 min,用100 μL的标记溶液重悬细胞,室温下避光孵育10~15 min,500~1000 r/min离心5 min沉淀细胞孵育缓冲液洗1次,加入荧光(SA-FLOUS)溶液4 ℃下孵育20 min,避光并不时振动,流式细胞仪分析:流式细胞仪激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。
1.7 线粒体膜电位 将各组细胞接种于6孔板后PBS清洗三次,孵育24 h,加入JC-1(5 μg/mL)室温避光反应30 min。用流式分选仪检测,记录红色和绿色荧光强度。
1.8 Western blot检测蛋白表达水平 将各组待测细胞用PBS清洗三次,再加入含蛋白酶抑制剂的细胞裂解液进行总蛋白提取,BCA试剂盒测定蛋白质含量;提取等量的蛋白质样品(20 mg),100 ℃变性5 min。然后进行SDS-PAGE凝胶电泳分离并转移至PVDF膜,5%的BSA室温封闭1~2 h后加入相应的一抗,4 ℃过夜孵育,次日,清洗后再加入辣根过氧化物酶标记的二抗,室温孵育1 h,清洗。最后加入发光液后,于凝胶成像仪进行曝光拍照,并用ImageJ软件统计灰度值计算相对表达量。GAPDH作为上样量参照,至少重复三个独立的实验。
1.9 SOD、MDA、GSH含量测定 按照试剂盒说明书,采用酶标仪测定总超氧化物歧化酶(SOD)含量,采用可见分光光度计测定丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH)含量。SOD在450 nm处测OD值,MDA在532 nm处测OD值,GSH在412 nm处测OD值。

2 结果
2.1 丙泊酚抑制TPC-1细胞增殖 BrdU染色检测各组细胞增殖情况结果显示,与PPF 0μM组相比较,PPF 25 μM和PPF 50 μM组BrdU阳性细胞数显著降低(P<0.05),见图1。

图1 丙泊酚对TPC-1细胞增殖的影响
2.2 丙泊酚抑制TPC-1细胞生长 克隆形成实验检测各组细胞生长情况结果显示,与PPF 0 μM组相比较,PPF 25 μM和PPF 50 μM组克隆形成率显著降低(P<0.05),见图2。

图2 丙泊酚对TPC-1细胞生长的影响
2.3 丙泊酚下调TPC-1细胞Ki67、PCNA蛋白表达水平 Western blot检测各组细胞Ki67、PCNA蛋白表达水平结果显示,与PPF 0μM组相比较,PPF 25 μM和PPF 50 μM组Ki67、PCNA蛋白水平显著降低(P<0.05),见图3。

图3 丙泊酚对TPC-1细胞Ki67、PCNA蛋白表达水平的影响
2.4 丙泊酚促进TPC-1细胞凋亡 流式细胞仪检测各组细胞凋亡情况结果显示,与PPF 0μM组相比较,PPF 25、50μM组细胞凋亡率显著升高(P<0.05),见图4。

图4 丙泊酚对TPC-1细胞凋亡的影响
2.5 丙泊酚降低TPC-1细胞线粒体膜电位 JC-10检测各组细胞线粒体膜电位结果显示,PPF 25和PPF 50 μM组细胞线粒体膜电位较PPF 0 μM组明显降低,见图5。
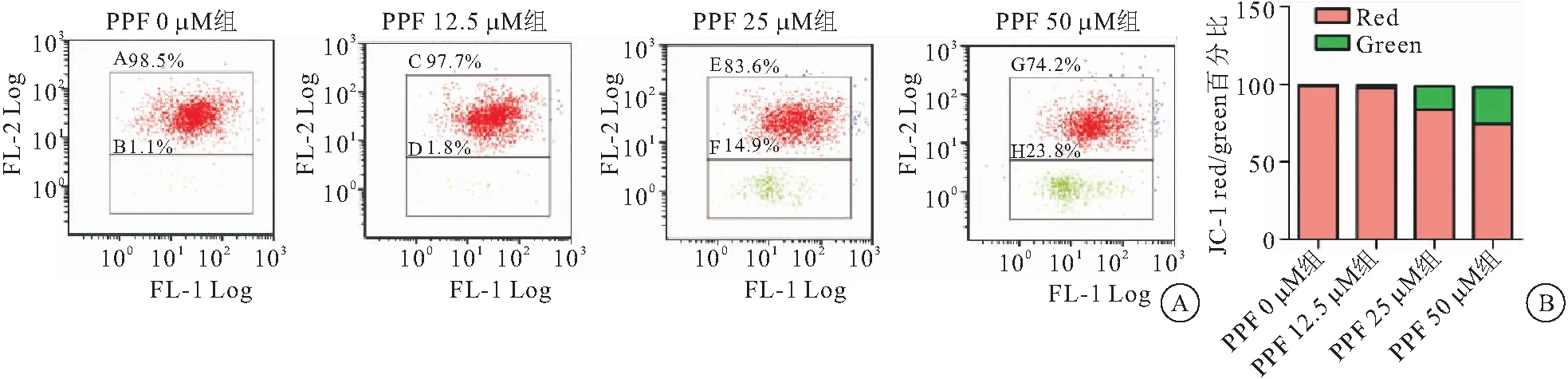
图5 丙泊酚对TPC-1细胞线粒体膜电位的影响
2.6 丙泊酚升高TPC-1细胞Bax/Bcl-2、cleaved caspase-3/Caspase-3、cleaved caspase-9/Caspase-9比值,下调c-Myc蛋白表达水平 Western blot检测各组细胞Bcl-2、Bax、Caspase-3、Caspase-9、c-Myc蛋白表达水平结果显示,与PPF 0 μM组相比较,PPF 25 μM和PPF 50 μM组Bax/Bcl-2、cleaved caspase-3/Caspase-3、cleaved caspase-9/Caspase-9比值显著升高(P<0.05),c-Myc蛋白水平显著降低(P<0.05),见图6。
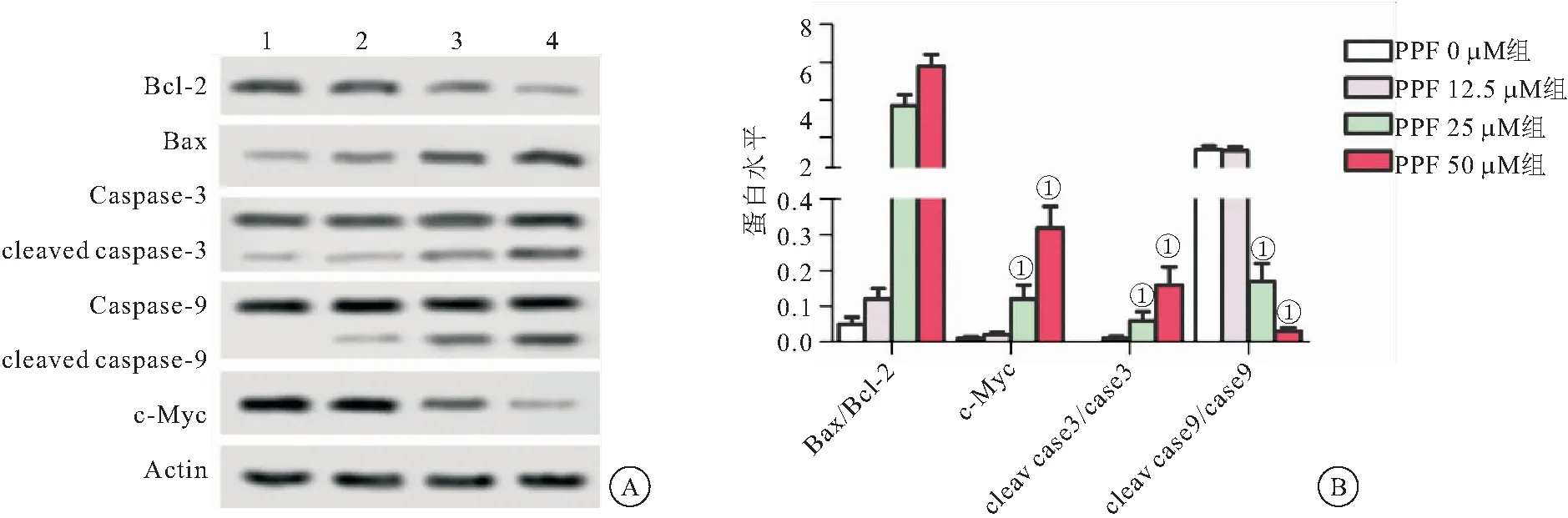
图6 丙泊酚对TPC-1细胞Bcl-2、Bax、Caspase-3、Caspase-9、c-Myc蛋白表达水平的影响
2.7 丙泊酚升高TPC-1细胞MDA、GSH含量,降低SOD含量 试剂盒检测各组细胞SOD、MDA、GSH含量结果显示。与PPF 0 μM组相比较,PPF 12.5 μM组SOD含量显著降低(P<0.05),MDA、GSH含量显著升高(P<0.05)。PPF 50 μM组SOD含量显著高于PPF 12.5 μM组(P<0.05),PPF 12.5 μM组MDA、GSH含量显著高于PPF 50μM组(P<0.05),见表1。

表1 丙泊酚对TPC-1细胞SOD、MDA、GSH含量的影响
3 讨论
丙泊酚是临床上常用的静脉麻醉药, 在各种手术的麻醉诱导中广泛使用, 其特有的结构能抑制炎症细胞聚集、增殖、活化及减少释放炎症因子, 从而达到抗炎作用。丙泊酚可通过直接或间接作用抑制肿瘤细胞的增殖、侵袭、迁移和生存能力, 并促进细胞凋亡, 从而达到有效的抗肿瘤作用[8]。手术治疗是乳头状甲状腺癌的首选方法,临床上多选用丙泊酚对乳头状甲状腺癌进行麻醉[9]。
当细胞增殖失控时会引起肿瘤的发生,因此调控肿瘤细胞的增殖是治疗肿瘤的必要手段[10]。Ki67是一种与细胞增殖相关的核蛋白,参与多种恶性肿瘤细胞的增殖与侵袭,其蛋白表达在甲状腺癌中明显增高[11]。增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA) 是一种与细胞增殖状态有关的核蛋白,其随着临床分期增加和淋巴节转移, 表达水平逐渐增高,表明癌细胞增生活跃,与甲状腺癌的临床病理学特点和生物学行为有关,提示预后不良[12]。赵华宇等[13]研究发现丙泊酚通过降低Ki67表达抑制胶质瘤U251细胞增殖。王鹏等[14]研究发现丙泊酚通过下调PCNA表达抑制大鼠肺动脉平滑肌细胞的增殖。本文研究发现,丙泊酚具有下调TPC-1细胞Ki67、PCNA蛋白表达水平,提示丙泊酚通过抑制Ki67、PCNA表达抑制TPC-1细胞增殖。
凋亡是细胞程序性死亡,治疗癌症的化学预防策略之一就是诱导凋亡细胞死亡[15];其分为外源性凋亡途径、内源性凋亡途径(线粒体凋亡途径)和内质网应激途径[16]。Caspase家族是细胞凋亡过程中的关键元件, 可以通过与众多蛋白因子的相互作用调控细胞凋亡,其中Caspase-9、Caspase-3在凋亡级联中过度活化能够促进细胞凋亡[17]。抗细胞凋亡成员Bcl2,可防止细胞凋亡,而促凋亡成员Bax位于线粒体外膜或细胞质,并在应激下寡聚化,促进线粒体释放因子,从而引发细胞凋亡[18]。c-Myc是一种常见的原癌基因,可促进细胞增殖或诱导细胞凋亡,在甲状腺乳头状癌中高表达[19]。本文研究发现,丙泊酚具有降低升高TPC-1细胞Bax/Bcl-2、cleaved caspase-3/ Caspase-3、cleaved caspase-9/Caspase-9比值,下调c-Myc蛋白表达水平的作用,提示丙泊酚通过线粒体凋亡途径诱导TPC-1细胞凋亡。
线粒体是一种存在于大多数细胞中有两层膜包被的细胞器,是细胞中制造能量的结构。线粒体通透性孔的转换对细胞的凋亡有着至关重要的作用, 一旦线粒体通透性孔打开, 小分子和离子就会流进线粒体, 导致线粒体膜电位的改变[20]。线粒体膜内外的电势差降低,引起细胞凋亡的级联反应,将导致细胞凋亡。本文研究发现,丙泊酚具有降低TPC-1细胞线粒体膜电位的作用,提示丙泊酚通过降低线粒体膜电位调控TPC-1细胞凋亡。
氧化应激是一种复杂的动态过程,其特点是保持活性氧生成与抗氧化剂的活性及有效性之间的平衡。线粒体作为真核生物进行能量代谢的主要场所,在自由基产生、细胞凋亡、衰老等生理病理活动中起到重要作用,是氧化应激作用的重要靶细胞器。SOD和GSH是人体内重要的酶抗氧化系统的主要成员,MDA则是机体内重要的脂质过氧化代谢产物。郝琨等[21]研究发现丙泊酚通过升高SOD含量,降低MDA含量缓解氧化应激有利于结直肠癌根治术患者恢复。本文研究发现,丙泊酚具有升高TPC-1细胞MDA、GSH含量,降低SOD含量的作用,提示丙泊酚通过改善氧化应激调节TPC-1细胞增殖和凋亡。本研究只在细胞水平检测丙泊酚的作用, 后期将做体内实验, 以更深入研究丙泊酚在乳头状甲状腺癌中的作用。
4 结论
丙泊酚具有抑制乳头状甲状腺癌TPC-1增殖,促进细胞凋亡,降低线粒体膜电位,改善氧化应激的作用,这可能是通过激活线粒体凋亡通路所实现。

