3D 腹腔镜下胃癌根治术治疗胃癌临床疗效及安全性评价
孟德斌
(山西省肿瘤医院 普外科,山西 太原 030013)
0 引言
胃癌为临床上十分常见的疾病,属于恶性肿瘤类型,具有超高的发病率及死亡率,对患者的生命安全造成了严重的威胁。而如何彻底根治性切除及提高患者术后生存质量为临床上广泛讨论的话题。目前,我国胃癌的发病率居恶性肿瘤第二位,死亡率居第三位,严重影响了患者的生活质量及身体健康[1]。临床上对于该疾病的治疗传统上采取开腹手术治疗,但是该术式创伤大、手术时间长、出血量多及术后并发症发生率较高。随着我国医学技术不断发展,微创手术在临床上应用率越来越高,3D腹腔镜下胃癌根治术治疗具有较多优势,受到广泛患者的青睐,同时也是胃肠外科医生不断探索的焦点[2]。因此,本次研究对3D腹腔镜下胃癌根治术治疗胃癌临床疗效及安全性进行分析,见下文。
1 资料和方法
1.1 一般资料。收取的胃癌患者作为本文研究对象,①患者均确诊为胃腺癌[3];②获得研究的知情同意,签署相关知情同意书。③无手术禁忌证。排除标准:①全身状况较差,入院时Karnorfsky 评分<50分;②患者合并严重肠梗阻、消化系统器质性病变,影响后续毒副作用观察的病症;③患者预计生存期<3个月,不足完成整个化疗。脱落与剔除标准:①未按规定完成相应的化疗;②同时接受其他治疗;③中途自愿剔除研究。观察组:年龄在40~60岁,平均(50.25±2.52)岁;男22例、女28例;对照组:年龄41~60岁,平均(50.85±2.52)岁;男21例、女29例;基本资料两组之间无显著差异,P>0.05。
1.2 方法。对照组实施:2D腹腔镜下手术治疗方式。2D腹腔镜技术治疗,具体内容:选用2D腹腔镜技系统以及可转换30度镜完成本次手术,手术操作方式和手术所用器械与观察组一致[4]。观察组实施:3D腹腔镜下胃癌根治术治疗方式。选择3D腹腔镜系统以及4方向镜完成本次手术,术中所用腔镜器械主要包括切割器、超声刀、吻合器、电刀、Trocar等。给予患者气管插管全身麻醉,手术类型为肿瘤根治术,分腿仰卧头高位;先行腹腔镜探查排除肝脏及腹膜等远处转移。分别结扎切断胃网膜左,胃网膜右及胃右、胃左血管并清扫相关淋巴结,切除全胃、远端胃或近端胃,之后行腹腔镜下消化道重建或辅助切口直视下消化道重建。留置腹腔引流管引出体外。上述手术均由临床手术经验丰富医生进行[5]。
1.3 观察指标。两组手术时间、术中出血量、术后排气时间、住院时间、总有效率、并发症发生率、免疫功能指标比较。
1.4 统计学处理。本次研究统计学软件SPSS 24.0进行处理,计量资料采用t检验,计数资料采用卡方检验,P<0.05具有统计学意义。
2 结果
2.1 对比各项指标。观察组胃癌患者手术时间(197.02±1.32)min、术中出血量(53.02±1.35)mL、术后排气时间(2.01±0.35)d、住院时间(12.03±0.25)d均优于对照组(P<0.05)。见表1所示。
表1 分析各项指标()
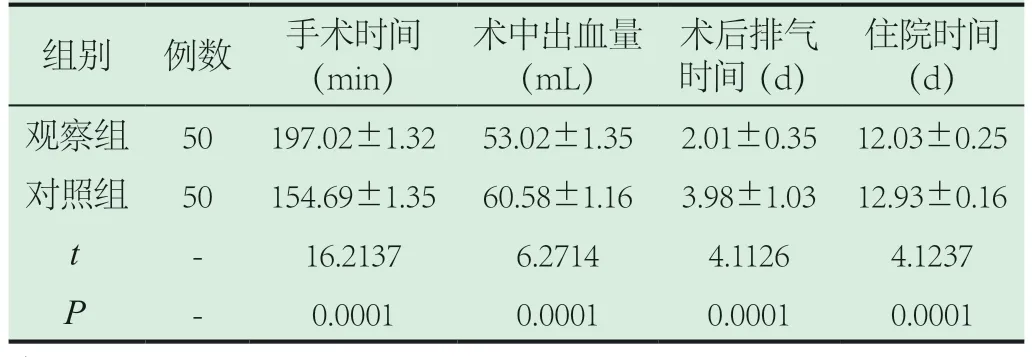
表1 分析各项指标()
2.2 对比总有效率。观察组胃癌患者治疗总有效率明显高于对照组(P<0.05)。见表2所示。

表2 分析总有效率指标(n,%)
2.3 对比总有效率。观察组胃癌患者并发症发生率明显低于对照组(P<0.05)。见表3所示。
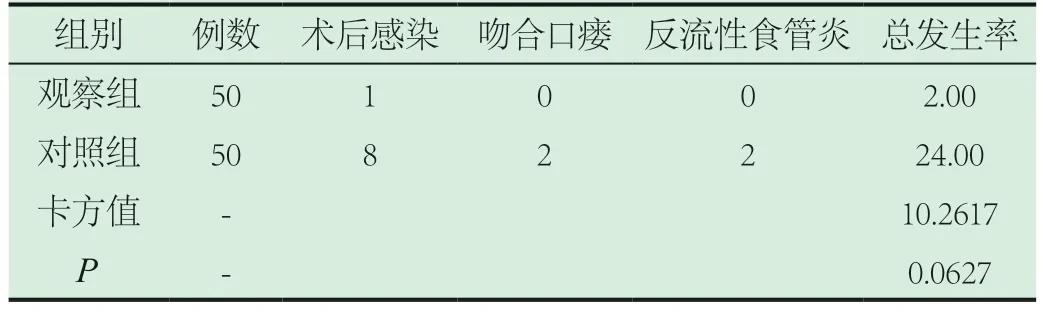
表3 分析并发症发生率指标(n,%)
2.4 对比两组免疫功能。观察组经治疗后各项免疫功能指标中,C D 4+(39.52±2.01)%、C D8+(24.02±1.74)%、CD4+/CD8+(1.58±0.21)、NK(25.52±1.52)%和对照组CD4+(36.25±1.45)%、CD8+(26.58±1.02)%、CD4+/CD8+(1.41±0.22)、NK(15.45±1.77)%各项指标进行比较,差异十分显著(P<0.05)。见表4。
表4 免疫功能指标的比较()
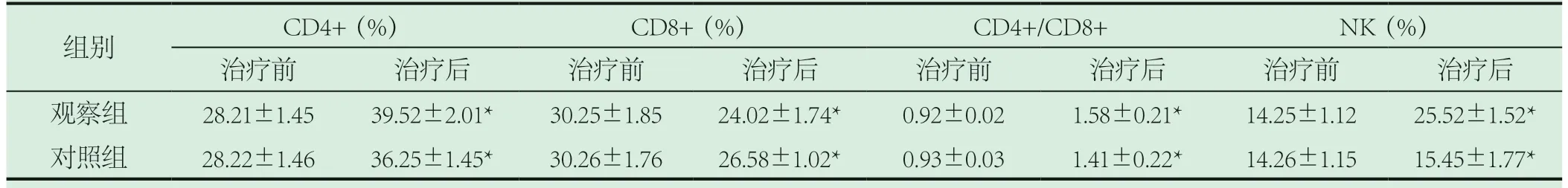
表4 免疫功能指标的比较()
注:和治疗前相比,★P<0.05。
2.5 两组实验室炎性相关指标的对比。观察组经治疗后TNF-α(119.02±1.65)Pg/mL、IL-1β(175.34±1.22)ng/L、IFN-γ(13.52±1.02)mg/L、VEGF(305.25±20.71)ng/L均低于对照组TNF-α(167.52±1.98)Pg/mL、IL-1β(253.45±1.93)ng/L、IFN-γ(7.02±1.45)mg/L、VEGF(390.25±20.45)ng/L(P<0.05)。如表5。
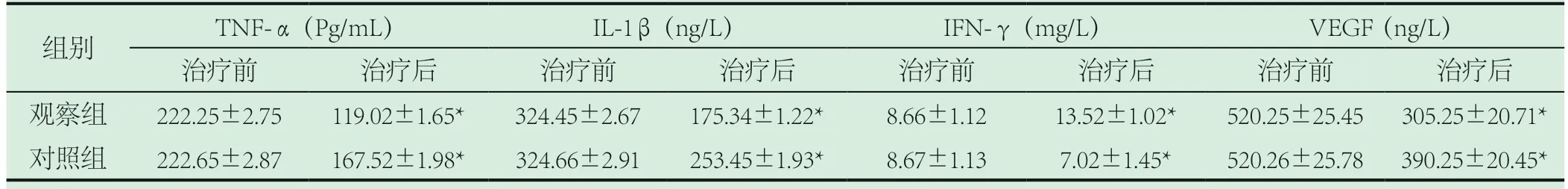
表5 比较两组实验室炎性相关指标
3 讨论
据相关研究显示,胃癌作为临床上常见的恶性肿瘤,具有较高的发病率及死亡率,若治疗不当则可加速其死亡。因此,如何选择一项合适的治疗方式尤为重要[6]。目前临床上对于该疾病的治疗多采用传统的开腹手术治疗,但该种治疗方式具有较多不足之处,且不易被患者接受,因此逐渐被腹腔镜手术所取代[7]。而随着我国医疗技术的不断发展,3D腹腔镜下胃癌根治术治疗在临床上使用率越来越高,且具有较好的疗效,安全性较高,能够促进患者尽快恢复身体健康[8],提高患者生存率。对于早期胃癌,早期诊断与治疗时改善患者预后情况的关键。在不对早期胃癌预后情况的影响下,采用微创手术治疗早期胃癌明显提高了患者的生活质量[9]。对于部分早期胃癌患者来说,内镜局灶切除术及ESD均为治疗的有效方案,且安全性较高。随着内镜技术的不断发展,且该手术的适应症通过临床试验进行明确后发现,内镜技术在早期胃癌的治疗中具有重要价值[10]。而对于不适合采用内镜切除术治疗的患者来说,腹腔镜技术则为适宜的治疗方式,具有较多优势,如出血量少、住院时间短及创伤小等[11-12]。临床上对于使用微创技术的应用不断扩展,应对其治疗肿瘤根治性切除的安全性进行进一步评估,从而提高临床治愈率,促进患者早日康复。而将3D腹腔镜技术应用其中[13-14],能够将患者神经和血管位置关系清晰的显示出来,还原了患者器官和组织的正常结构,能够准确的进行空间定位,能够促进手术呈精细化。胃癌根治术在3D腹腔镜技术下,其血管及其周围组织结构能够清晰的显示出来,能够对微小血管的位置以及走行作出准确判断,能够有效减少术中误伤情况,若手术不当出现出血现象,在3D腹腔镜技术下能够快速止血,减少术中出血量[15]。
经研究表明,观察组胃癌患者手术时间(197.02±1.32)min、术中出血量(53.02±1.35)m L、术后排气时间(2.0 1±0.3 5)d、住院时间(12.03±0.25)d均优于对照组(P<0.05);观察组胃癌患者治疗总有效率明显高于对照组(P<0.05);观察组胃癌患者并发症发生率明显低于对照组(P<0.05);观察组经治疗后各项免疫功能指标中,CD4+(39.52±2.01)%、CD8+(24.02±1.74)%、CD4+/CD8+(1.58±0.21)、NK(25.52±1.52)%和对照组各项指标进行比较,差异十分显著(P<0.05);观察组经治疗后TNF-α(119.02±1.65)Pg/mL、IL-1β(175.34±1.22)ng/L、IFN-γ(13.52±1.02)mg/L、VEGF(305.25±20.71)ng/L均低于对照组(P<0.05)。
综上所述,3D腹腔镜下胃癌根治术治疗胃癌临床疗效十分的显著,并且安全性较高,能够改善患者免疫功能,减少机体炎症因子水平,值得在临床中推广运用。

