间歇低气道压力通气联合低中心静脉压技术在腹腔镜肝切除术中的应用:前瞻性随机对照研究
陈 骏 刘 朋 张国华 王建新 吴建军 蔡卫华 邢春花
(南通大学附属南通第三医院肝胆外科,南通 226006)
低中心静脉压(low central venous pressure,LCVP)技术有助于开放肝切除手术(open liver resection,OLR)时控制术中出血的观点已经被肝外科医生和麻醉科医生接受。腹腔镜肝切除术(laparoscopic liver resection,LLR)治疗肝脏良恶性肿瘤在我国逐步推广,如何在固定气腹压力下更有效、安全地利用麻醉相关技术降低中心静脉压(central venous pressure,CVP),从而既减少术中出血,又保持呼吸及循环系统稳定成为研究热点。本研究采用前瞻性随机对照研究间歇低气道压力(low airway pressure,LAWP)通气策略联合LCVP 技术对LLR 术中出血量、手术时间、第一肝门阻断时间等的影响,评估该策略临床有的效性及安全性,现报道如下。
1 临床资料与方法
1.1 一般资料
本研究经我院伦理委员会审批(批文号:EL2013003)。病例选择标准:①术前肝功能Child Pugh 分级A 级,无严重门静脉高压,吲哚氰绿15 min 滞流率(indocyanine green rate at 15 minutes,ICG-R15) <30%;②中国肝癌分期(China Liver Cancer Staging,CNLC) Ⅰa 期,肿瘤病灶位于Ⅱ、Ⅲ、Ⅳb、Ⅴ或Ⅵ段(Couinaud 法),且术后病理证实为原发性肝细胞肝癌;③无LLR 禁忌证,既往无肝脏手术史。排除标准:①ICG-R15 ≥30%;②严重心、肺等疾病,不能耐受全麻手术;③静脉回流通路阻塞(三尖瓣返流,肝静脉癌栓)。2014 年1 月~2019年12 月50 例经我院肝肿瘤多学科讨论且符合LLR手术指征纳入本研究。由SPSS23.0 软件包生成随机序列,将随机序列依次编号,分为LAWP 组和正常气道压(normal airway pressure,NAWP)组,每组25 例,将分组装入密闭不透光信封,术前由麻醉医师打开信封,按照分组方法进行麻醉。50 例年龄35~65 岁,平均49.3 岁。2 组性别、年龄、体重、切肝前(T1)气道压(airway pressure,AWP)、基础肝脏疾病、肿瘤直径、肝硬化、ICG-R15 差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 2 组一般资料比较(,n=25)
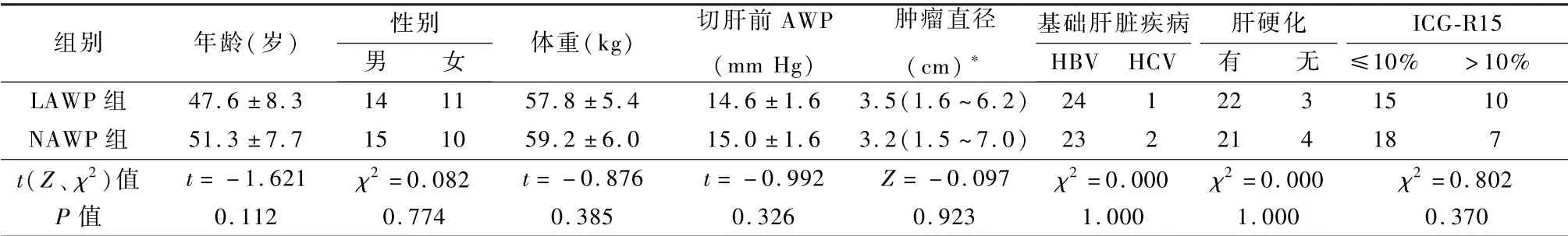
表1 2 组一般资料比较(,n=25)
*数据偏态分布,用中位数(最小值~最大值)表示
1.2 方法
1.2.1 麻醉方法及通气策略
2 组均选用静吸复合麻醉。德尔格(Drager Fabius plus)麻醉机,术前均常规留置双腔中心静脉压导管(ARROW CS -27702 -E)及左侧桡动脉穿刺置管,GEB650 监护仪术中持续监测CVP、有创动脉压、SpO2、呼气末二氧化碳(PETCO2)等。
麻醉诱导:咪达唑仑0.03~0.06 mg/kg,丙泊酚2~2.5 mg/kg,顺阿曲库铵0.2 mg/kg,芬太尼2~3 μg/kg;麻醉维持:根据血压、心率情况,七氟烷吸入,氧流量1~2 L/min,术中MAC 0.8 左右,右美托咪定0.3~0.5 μg·kg-1·h-1持续泵注,间断追加芬太尼4~6 μg/kg,顺阿曲库铵1~2 mg·kg-1·min-1。术毕入麻醉恢复室常规苏醒。
LAWP 组:①麻醉诱导气管插管成功后先以容量控制通气(volume-controlled ventilation,VCV)作为通气方式,待建立气腹(气腹压力控制于10 mm Hg),血流动力学稳定5 min 后,预估AWP 值切换为压力控制通气(pressure-controlled ventilation,PCV),吸入氧浓度(FiO2)60%;呼吸频率12 次/min,吸入与呼出时间比(I∶E)1 ∶2;吸气峰压12~18 cm H2O;PETCO235~45 mm Hg;常规关闭呼气末正压(positive end-expiration pressure,PEEP)。②第一肝门阻断(常规每次15 min,间断5 min)时纯氧吸入并将AWP 主动降低5 cm H2O,如遇肝静脉或下腔静脉破口出血较凶猛控制修补困难,甚至可暂停机械通气使胸腔压力将至0 mm Hg,进一步下降CVP 以利发现、控制及修补出血部位。③利用每次第一肝门阻断松开间歇5 min,根据PETCO2及血气分析,恢复原AWP 甚至更高值以利于纠正高碳酸血症。④若再次进行肝实质离断可再次采用该通气策略,反复该过程,直至肝实质离断完成并止血。
NAWP 组:常规采用LCVP 技术联合PCV,但不采用LAWP 通气策略。
1.2.2 CVP 控制技术
液体管理是获得LCVP 的关键措施。2 组液体管理均分3 个阶段实施。①术前:加速康复外科原则,术前晚自由进饮,术前2 h 饮水(5 ml/kg);②液体限制阶段(肝实质离断完成):严格限制输液量,液体以林格式液为主(1~2 ml·kg-1·h-1);③液体复苏阶段(肝实质离断后完成止血):相对快速补充液体量,晶体∶胶体约1∶1,直至CVP 正常。
2 组术中均采用反Trendelenburg 位(15°头高脚低位),术中关闭呼吸机PEEP 模式,间断使用呋塞米(5~40 mg)维持CVP 于0~5 cm H2O,保证目标尿量>0.5 ml·kg-1·h-1,尽量不使用硝酸甘油,可联合去甲肾上腺素维持SBP >90 mm Hg和平均动脉压(mean arterial pressure,MAP) >60 mm Hg。
1.2.3 手术方法 麻醉诱导成功并气管插管完成后建立人工气腹,气腹压力维持于10 mm Hg 左右。肿瘤位于左叶肝段(Ⅱ、Ⅲ、Ⅳ段)采用仰卧剪刀位,双手内收,观察孔trocar 置于脐上,主操作孔trocar位于右腹直肌外缘;肝Ⅴ、Ⅷ段肿瘤及肝Ⅵ、Ⅶ段肿瘤分别取右侧抬高30°及60°体位,观察孔置于脐水平右侧,腹腔镜肝切除术采用4 孔法或5 孔法[1]。术中超声探明确立断肝平面,离断肝实质时行间歇性第一肝门阻断入肝血流,超声刀结合双极电凝离断肝实质,术后常规放置腹腔引流管。
1.3 观察指标
①术中持续监测CVP、AWP、MAP、PETCO2,记录时间分别为T1(离断肝实质前5 min),T2(阻断第一肝门离断肝实质后5 min),T3(阻断第一肝门离断肝实质后10 min),T4 (阻断第一肝门离断肝实质后15 min);②术中出血量、手术时间和第一肝门阻断时间。
1.4 统计学处理
应用SPSS23.0 进行统计学处理。符合正态分布的计量资料用表示,2 组比较采用独立样本t检验,术前后不同时点比较采用重复测量的方差分析,有统计学差异两两比较采用Bonferroni 法;非正态分布的计量资料用中位数(最小值~最大值)表示,2 组比较采用Mann-WhitneyU检验;计数资料比较采用χ2检验。P<0.05 差异有统计学意义。
2 结果
2.1 手术相关指标比较
LAWP 组术中出血量、手术时间、第一肝门阻断时间均明显少于/短于NAWP 组(P<0.05),2 组术后住院时间无统计学差异,见表2。
表2 2 组患者术中、术后情况比较(,n=25)

表2 2 组患者术中、术后情况比较(,n=25)
*数据偏态分布,用中位数(最小值~最大值)表示
2.2 CVP、MAP 比较
CVP 组间、时间、组间和时间交互作用差异均有统计学意义(均P=0.000),CVP 术前(T1)与T2、T3、T4 比较差异均有显著性(均P=0.000)。MAP 组间差异无统计学意义(P=0.097),T1 与T3、T4 比较差异均有显著性(P=0.000,P=0.002),但与T2 比较差异无显著性(P=0.058);组间和时间交互作用有差异(P=0.003),见表3。
表3 2 组术中各时间点CVP、MAP 的比较(,n=25)
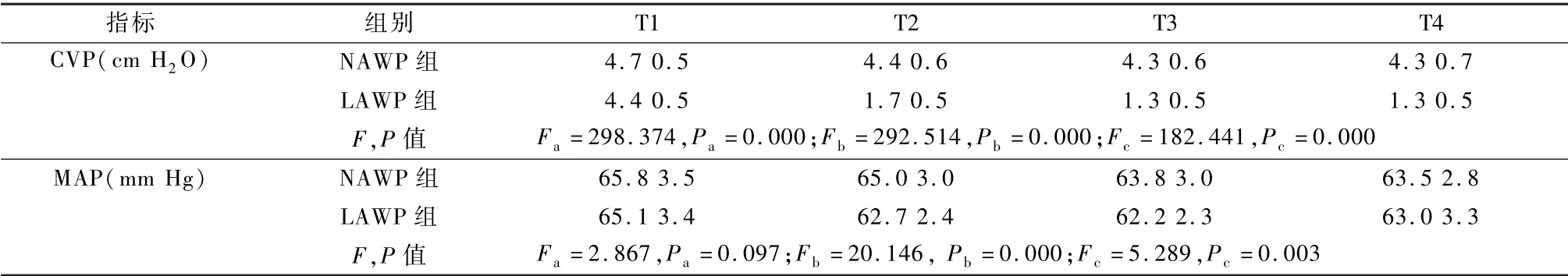
表3 2 组术中各时间点CVP、MAP 的比较(,n=25)
a 表示组间,b 表示时间,c 表示组间与时间的交互
2.3 术中及术后并发症情况
2 组LLR 均顺利完成,无严重大出血及死亡病例,未观察到有临床意义CO2栓塞并发症,仅NAWP 组胆漏1 例,术后14 d 经通畅引流后顺利拔管并出院。
3 讨论
出血是肝切除术永恒的话题。无论是开放肝切除还是LLR,入肝血流阻断后出血最大的风险来自肝静脉回流出血,肝静脉、下腔静脉出血或CO2栓塞取决于气腹压力(pneumoperitoneum pressure,PPP)和CVP 压力梯度。2014 年10 月LLR 日本盛冈共识[2]提出LCVP 是LLR 出血控制的关键之一,在LLR 术中PPP 和低CVP 可以协同减少术中出血量[3],但是LLR 术中PPP 基本不变,如何应用LAWP 策略联合LCVP 技术从而减少术中出血,目前国内外报道较少。
LCVP 技术是利用麻醉技术、液体管理、体位(反Trendelenburg 位,15°头高脚低位)、血管活性药物(去甲肾上腺素、多巴酚丁胺)、利尿剂(呋塞米)、低容量血液稀释、肝下下腔技术阻断等将CVP 控制在0~5 cm H2O 水平,同时不影响重要器官灌注的技术。液体管理是获取LCVP 的关键措施,尽量不要使用硝酸甘油,因为硝酸甘油扩张周围静脉会导致严重低血压。泊肃叶层流公式是低CVP 技术的物理学基础:出血量与血管壁的压差和血管半径的4 次方成正比。中心静脉压下降,导致肝静脉、肝窦压力下降,肝内静脉半径缩小,即使术中肝静脉主干或分支有小筛孔或小破裂孔出血,但血流一进一出不外涌,因此,在离断肝实质时出血减少,如果再配合肝血流阻断技术效果更佳。当然,LLR 术中出血量也与外科技术有关,LCVP 可使肝离断面干燥,有利于医生在离断肝实质时更加容易辨清肝内脉管结构,精细操作从而减少术中出血量。
Kobayashi 等[4]报道AWP 与CVP 以及PPP 与CVP 呈正相关。临床实践中,PPP 值可设定为10~14 mm Hg 固定值,LLR 术中AWP、CVP 因随呼吸周期而发生周期性变化并不固定,吸气峰压(AWP 最高)时CVP 最高,呼气末压时(AWP 最低)CVP 最低。我们在术中发现:麻醉中高AWP 可以导致CVP 升高,从而使肝静脉回流至下腔静脉速度减慢,肝静脉压力升高,出血后较难控制;术中吸气相出血增加,较呼气相更难控制肝静脉或下腔静脉出血;LLR 术中即使增加PPP,在气道高压下肝静脉回流出血也较难控制(尤其在吸气相时CVP 较高),但在LAWP 下较易控制。本研究结果显示LAWP 组术中出血量、手术时间及第一肝门阻断时间均显著低于NAWP 组(P<0.05),但术后住院时间未缩短。
目前,麻醉使用以下2 种控制通气模式:PCV 的特点是以预设压力通气,平台期较长,吸气峰压较低,可以降低气道峰压,减少气道高压发生;VCV 最常见的问题恰恰是AWP 升高和呼吸系统顺应性下降;PCV 可较VCV 更易控制AWP,获得较低的AWP、CVP。基于此,本研究根据间歇性第一肝门阻断入肝血流技术设计LAWP 通气策略,研究结果显示CVP 组间、不同时间点及组间和时间交互作用差异有显著性(P<0.05),说明在LLR 术中使用间歇LAWP 通气策略可有效降低AWP 并使中心静脉压进一步下降,减少术中出血量、手术时间及间歇性第一肝门阻断时间。
间歇性LAWP 策略合理性在于:①应用PCV 模式通气(以初始VCV 预估AWP 值),而PCV 通气平台期较长,可有效控制AWP 避免CVP 波动。②无论是OLR 还是LLR,出血最大风险在离断肝实质时,在间歇性第一肝门阻断入肝血流15 min 内主动降低AWP 5 cm H2O 进一步CVP 减少出血。③如遇较凶猛地肝静脉或下腔静脉破口出血,可临时暂停机械通气使胸腔压力将至0 mm Hg,进一步下降CVP 以利于外科医生发现、控制及修补出血部位。④降低AWP 时使用纯氧通气,可增加功能余气的含氧量,改善通气灌注不足及纠正低氧血症,根据体重kg3/4法则[5]计算每分钟氧耗量[Brody 公式:基础代谢氧耗量(Vo2)=10 × 体重(kg)3/4(ml/min)]以保证若暂停机械通气6~8 min 氧供,可利于外科医生控制出血。⑤利用每次第一肝门阻断松开间歇5 min,根据PETCO2及血气分析,恢复原AWP 甚至更高值以利于纠正高碳酸血症。⑥若再次进行肝实质离断可重复该通气策略。
外科医生至少应该意识到这一点:如果PPP 迅速升高,CVP 过低,两者压力梯度差过大,CO2栓塞风险可能会因为呼气末气腹气体流入量的增加而增加[6]。虽然本研究未观察到有临床意义的CO2栓塞发生,可能与术中我们保持PPP 基本不变及低通气压力预防CO2栓塞有关,但术中仍需持续监测PETCO2,若肺血管部分被CO2气栓阻塞,通气死腔扩大导致术中PETCO2突然下降,同时伴SpO2、HR及血压下降,此时首先考虑发生CO2栓塞。紧急应对措施如下:①为防止CO2进一步进入可停止气腹,降低PPP;出血可暂时淹没或腔镜纱布或止血纱布压迫肝静脉破口。②改变体位,采用头低足高左侧卧位,使CO2气泡聚在右心房顶点,防止进入肺动脉,而且CO2的弥散性极高较易吸收。③充分补液,升高AWP 以增加胸腔压力、CVP 及胸腔段IVC压力,避免气体吸入。④纯氧吸入,使用强心药或血管活性药,保证血流动力学稳定。⑤充分显露后5-0 Prolene 线修补或Hem-o-lok 夹闭出血点。⑥若出血迅猛无法控制,及时中转手术或术后高压氧治疗,甚至心肺复苏。
2 组间MAP 差异无统计学意义(P<0.05),但不同时间点及组间与时间交互作用有差异,说明间歇LAWP 通气联合LCVP 技术可影响患者术中血流动力学,使用去甲肾上腺素维持SBP >90 mm Hg 或MAP >60 mm Hg[7],生理学提示MAP >50 mm Hg能维持重要脏器灌注,并不会增加急性肾损伤发生的风险[8],说明该通气策略联合LCVP 技术对重要脏器灌注无影响,是安全有效的。
综上所述,LLR 时在应用常规LCVP 技术的同时联合应用间歇LAWP 通气策略可进一步有效下降离断肝实质时CVP,起协同效应进一步减少术中出血,缩短手术时间及第一肝门阻断时间,未见有临床意义的CO2栓塞发生,是安全可行的。

