水生动物原肌球蛋白致敏原研究进展
陈红兵, 胡 昕, 谢彦海, 华希玮
(1.食品科学与技术国家重点实验室,南昌大学,江西 南昌330047;2.南昌大学 中德联合研究院,江西 南昌330047;3.南昌大学 食品学院,江西 南昌330047;4.南昌大学 实验动物科学中心,江西 南昌330006)
食物过敏已被世界卫生组织(WHO)列为21世纪重要的健康问题之一[1]。食物过敏影响呼吸系统、胃肠道消化系统和神经系统等,其症状主要表现为水肿、荨麻疹、腹泻、过敏性哮喘等,严重时可危及生命[2]。
八大类过敏食物中包含甲壳类动物和鱼类[3]。2018年中国水产品总产量为6 457.7万吨,每年人均水产品消费量为11.7 kg[4]。随着水产品在我国的消费量持续增加,其引起的食物过敏病例也逐渐增多,尤其是在沿海地区。与鸡蛋、牛奶过敏不同,水产品过敏通常是伴随终生的,将对人类健康产生巨大威胁[5]。因此,水产品引起的食物过敏值得高度重视。
致敏原是指可以诱导机体产生IgE,引起I型超敏反应的抗原[6]。原肌球蛋白(tropomyosin,TM)是一种重要的食物致敏原,广泛存在于甲壳类、贝类等水产品中。本文中将常见水生动物原肌球蛋白的性质、表位和免疫交叉反应、致敏性及其消减的研究进展进行总结。
1 原肌球蛋白
原肌球蛋白是一种耐热的酸性糖蛋白,相对分子质量为3.6×104~4.0×104[7]。TM主要存在于肌肉中,与肌动蛋白结合形成复合物调节肌肉收缩。在非肌肉中,TM主要功能是维持细胞骨架的完整性[8]。每个TM分子有7个肌动蛋白结合位点,可结合7个肌动蛋白[9]。TM二级结构是由2个α螺旋多肽链相互缠绕形成的超螺旋结构,α螺旋占比大于80%,剩余为β螺旋、无规则卷曲等,没有复杂的三、四级空间结构[10]。TM结构保守,其中大部分保守的氨基酸序列位于N末端和C末端[11]。
原肌球蛋白是多种无脊椎动物中的一种泛致敏原,是软体动物和甲壳类动物的主要过敏原,同时也是一些其他无脊椎动物(屋尘螨等)的次要过敏原[12]。世界卫生组织与国际免疫联合会(IUIS)下属的过敏原国际命名委员会对已确认的TM致敏原进行了登记收录(见表1)。
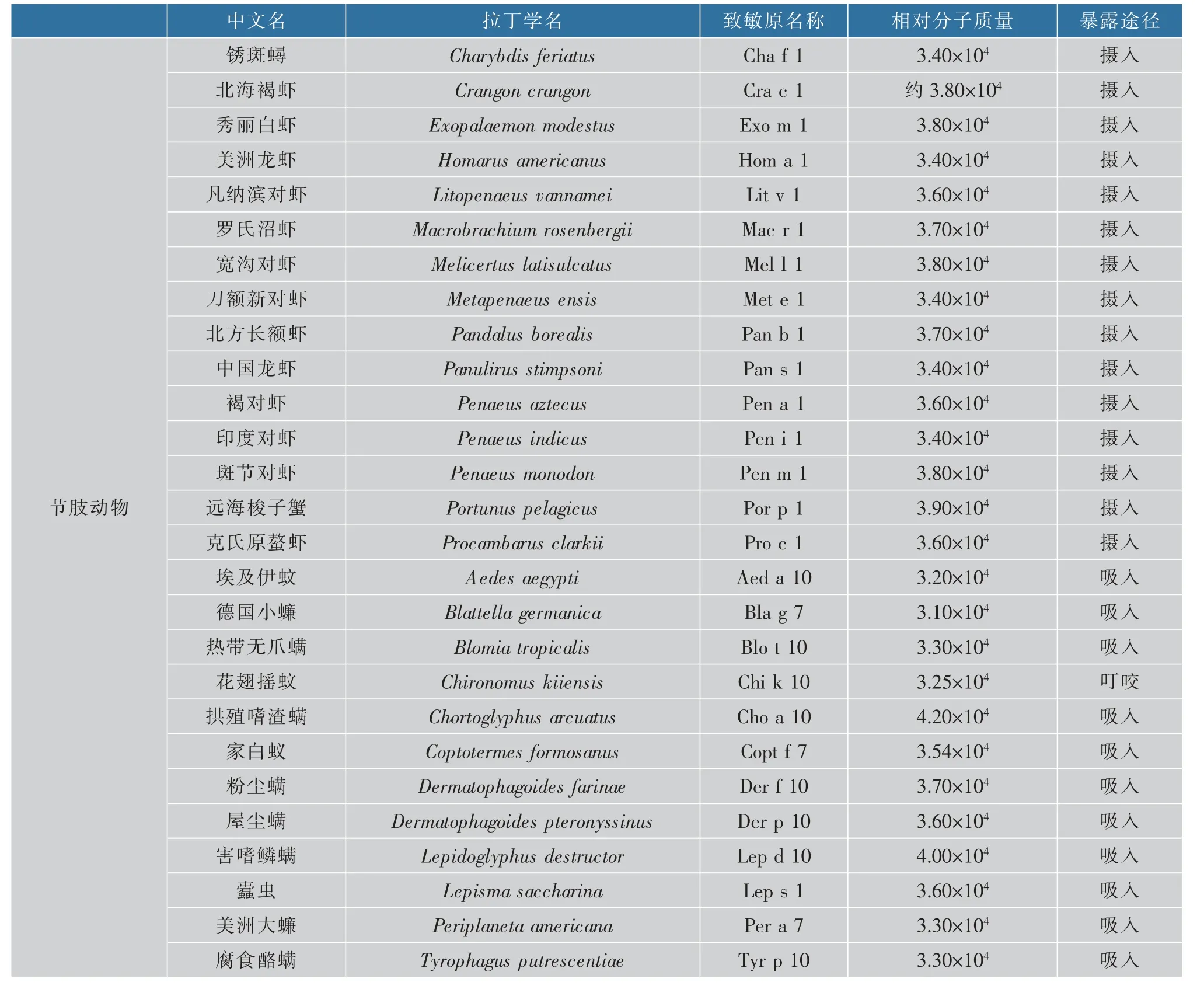
表1 官方认可的致敏原原肌球蛋白[13]Table 1 Officially recognized tropomyosin allergens[13]

续表1
1.1 鱼类原肌球蛋白
脊椎动物TM与无脊椎动物TM同源性约为55%,与无脊椎动物TM相比,脊椎动物TM结构更加灵活多变[14]。一般认为脊椎动物TM没有致敏性,然而近年来发现少数鱼类TM具有致敏性[15]。鱼类中的主要致敏原是小清蛋白,Liu等[16]的研究表明原肌球蛋白(Ore m 4)是莫桑比克罗非鱼(Oreochromis mossambicus)的致敏原[4],同时也是TM作为脊椎动物致敏原的较早报道。该TM与人原肌球蛋白亚型5同源性为87.7%,引起的过敏反应与自身免疫十分相似。另外,研究者在带鱼(Trichiurus lepturus)[17]、鲤鱼[18]中发现有相对分子质量与TM相似且具有致敏性的蛋白质。张晶宇[19]发现牙鲆鱼(Paralichthys olivaceus)原肌球蛋白alpha-1、大黄鱼(Larimichthys crocea)原肌球蛋白alpha-1和alpha-4与已知致敏原莫桑比克罗非鱼Ore m 4的相似性分别为97.9%、82.0%、89.0%,推测这3种蛋白质可能具有潜在的致敏性。如今相关研究领域已对鱼类TM的致敏性有越来越多的研究。
1.2 甲壳类动物原肌球蛋白
虾和蟹是人类食用的主要甲壳类动物,其中虾的TM约占虾肌肉的5%~7%[20]。TM是甲壳类动物中主要致敏原,该致敏原最早在1981年被报道[21]。60%~80%甲壳类动物过敏患者对原肌球蛋白IgE反应为阳性[22]。在甲壳类动物肌肉中发现了TM 2种亚型:快型和慢型。虽然这2种亚型之间结构相似,但是某些特定氨基酸序列具有差异[23]。目前,多种甲壳类动物的TM已被纯化和鉴定[24-29]。TM可存在于螃蟹、虾的加工环境中,与职业性过敏有关[30]。
1.3 软体动物原肌球蛋白
相比于甲壳类动物,软体动物的TM研究较少。目前,WHO公认的软体动物的致敏原有6种(Cra g 1、Hal l 1、Hel as 1、Sac g 1、Tod p 1、Hal m 1),其中前5种为TM。Miyazawa等[31]于1996年已报道TM是鱿鱼(Todarodes pacificus)的主要致敏原。黄榕芳[32]克隆了栉孔扇贝(Azumapecten farreri)TM的cDNA序列,得到等电点为4.46的原肌球蛋白。吕良涛[33]对菲律宾蛤仔(Ruditapes philippinarum)TM进行分离纯化以及分子克隆,结果表明菲律宾蛤仔TM相对分子质量约为3.7×104,等电点5.1。与甲壳类动物TM类似,软体动物TM也存在职业性过敏风险。如有一名厨师加工和烹饪鱿鱼后出现过敏症状并被确诊为过敏[34]。
2 原肌球蛋白表位和免疫交叉反应研究
2.1 原肌球蛋白抗原表位
表位(epitope)又称为抗原决定簇,是指抗原分子中可诱导免疫反应的数个氨基酸组成的序列和空间结构[7]。按照空间结构,表位可分为线性表位与构象表位。线性表位与食物过敏关系密切[35],对于TM表位的研究以线性表位为主。致敏原表位区域比非表位区域更加稳定[36]。TM被胃肠消化后,其表位结构会在消化过程中发生改变。消化过程中,酶可能破坏或改变TM部分表位,也可暴露更多隐藏在内部的线性表位[37]。TM表位的研究对免疫交叉反应、致敏性评价与消减、临床诊断等均有重要作用。
2.1.1 原肌球蛋白表位研究方法 研究致敏原表位的实验方法包括重叠肽库技术、噬菌体展示技术、质谱、蛋白质芯片、表面等离子共振技术等[38],此外还可使用生物信息学方法进行表位预测。常见的表位预测软件包括DNAStar Protean System、AntheProt software、BepiPred 2.0 Server、SOPMA等,再结合抑制性斑点印迹、酶联免疫吸附实验(ELISA)、嗜碱性粒细胞脱颗粒实验等进行鉴定[39-40]。另外,高通量测序与基因编辑技术也逐渐在表位研究中得到运用[41]。
2.1.2 甲壳类动物原肌球蛋白表位定位与鉴别已有不少学者对甲壳类动物TM表位进行定位与鉴别。如Ayuso[42]使用重叠肽库鉴定出褐对虾的5个线性表位。Zheng[43]利用DNAStar Protean系统、癌症疫苗中心(CVC)的生物信息学预测抗原肽(BPAP)系统和BepiPred 1.0 Server预测斑节对虾Pen m 1表位,得到10个预测表位并鉴定出其中8个为主要表位,酪氨酸、谷氨酸、精氨酸、苯丙氨酸、丝氨酸在表位中比例较高。韩建勋[44]研究发现,凡纳滨对虾TM中Peptide 1、Peptide 3、Peptide 6和Peptide 9是关键性表位。南美白对虾Lit v 1已预测出10个线性表位,其中8个通过间接竞争ELISA得到验证。Peptide 2(28—41)则未见报道,或为南美白对虾TM的特异性表位[45]。杨煌[46]预测出拟穴青蟹(Scyllaparamamosain)TM的8个T细胞表位,其表位分布范围广,患者几乎都可识别。王学丽[47]用南美白对虾TM的抗消化表位合成肽灌胃Balb/c小鼠,其中3个抗原表位肽(111—125、137—141、50—66)引起小鼠特异性IgE抗体和组胺水平上升,证明TM经过消化后部分表位仍具有免疫活性,这3个表位或是虾过敏的关键性表位。华希玮等[48]预测到日本沼虾10个B细胞线性表位与5个T细胞表位,与已确定的TM表位有重叠部分。Zhang等[40]采用DNAStar Protean System、AntheProt software、BepiPred 2.0 Server 3个软件预测秀丽白虾TM表位,并使用抑制性斑点印迹和重叠肽库鉴定出5个线 性 表 位:Epitope 1 (43—59)、Epitope 2(85—105)、Epitope 3(131—164)、Epitope 4(187—201)、Epitope 5(243—280),同时对胃肠道消化物进行表位预测,33个消化后的肽段中有26个呈IgE阳性。
2.1.3 软体动物原肌球蛋白表位定位与鉴别 与虾TM相比,对软体动物TM的表位研究相对较少。牡蛎Cra g 1表位已明确包含AA92—105(IQLLEEDMERSEER)[49]。Ishikawa[50]鉴 定 了 章 鱼Oct v 1表位为AA77—112、AA148—160、AA269—281,表位AA77—112与牡蛎Cra g 1表位AA92—105有相同的序列。黄蓉芳[32]研究了18种软体动物TM的序列一致性,发现氨基酸序列保守区域为:AA120—125、AA164—178、AA214—228、AA251—261,其中AA251—261与Pen a 1表位有重合部分,或可导致交叉反应。吕良涛[51]在排除人、猪TM和菲律宾蛤仔TM相同的表位后,预测确定了菲律宾蛤仔TM的4个线性表位:Peptide 2,Peptide 6,Peptide 9和Peptide 10。
2.2 原肌球蛋白免疫交叉反应
交叉反应是一种致敏原诱导机体产生的sIgE与另一种相似致敏原结合诱发产生的过敏反应[52]。交叉反应的物质基础是抗原表位[53]。不同致敏原有相同或相似的表位易产生交叉反应。国际食品法典委员会(CAC)对交叉反应评估标准进行了修订:蛋白质中的氨基酸数目超过80,当氨基酸同源性大于35%或者含有相同的8个连续氨基酸,该蛋白质可能存在交叉反应性[54]。致敏原氨基酸序列同源性高,可能导致其三维结构具有同源性[55]。同源性高并不能证明一定产生免疫交叉反应,需要结合血清学实验研究,但是血清学交叉反应与临床反应不一定完全相关[56]。
2.2.1 水产品TM之间免疫交叉反应 TM结构保守,多种TM具有共同的IgE表位,因此TM交叉反应广泛存在。无脊椎动物TM之间的交叉反应已得到证实[57],并且无脊椎动物致敏原中TM交叉反应最强。
过去,脊椎动物的TM基本被认为无致敏性。但是,近年来研究表明某些鱼类和贝类中的TM也可能存在潜在的交叉反应[58]。李荔等[59]克隆纯化的斑马鱼TM对鱼虾蟹过敏患者血清具有良好的免疫活性。2018年报道了一位虾过敏患者在摄取一定量的鱼后出现过敏反应,特异性IgE(ImmunoCAP ISAC)实验中检测了112种致敏原组分,鱼小清蛋白无阳性反应,对TM(Pen m 1、Der p 10、Ani s 3、Bla g 7)呈阳性。该患者血清与相对分子质量3.6×104条带对应物质呈IgE阳性反应,免疫印迹结果表明该条带为TM,证明鳕鱼TM可与虾TM发生交叉反应[60]。
甲壳类动物之间TM同源性可达98%以上。Zheng等[43]比较了14种甲壳类动物TM氨基酸序列,发现凡纳滨对虾、斑节对虾、褐美对虾TM表位序列基本一致,且14种TM潜在表位也具有高度相似性,或可以进一步解释交叉反应的发生。Abramovitch[26]通过免疫印迹与ELISA发现远海梭子蟹与斑节对虾的TM有交叉反应性。周瑾茹[45]研究表明21种虾、蟹的TM同源性均大于80%,具有潜在交叉反应性。
与甲壳类动物TM相比,软体动物之间的TM同源性相对较低。Leung对TM进行了系统发育分析,TM主要分为两大类:节肢动物TM与软体动物TM。这两类平均同源性分别为91.7%和77.2%。与甲壳类动物TM相比,软体动物TM的同源性低很多(56%~68%),表明软体动物TM更加多样化,致敏能力或有不同。TM不是唯一引起甲壳类动物与软体动物免疫交叉反应的致敏原[61]。已知甲壳类动物TM的97个IgE表位中,软体动物TM中含有26个,其中双壳纲动物TM共有表位更少,特异性更强[52]。因此,甲壳类动物与软体动物TM之间的交叉反应还不是很明确。
2.2.2 水产品TM与其他TM的免疫交叉反应TM也是一种吸入性致敏原,在蟑螂、尘螨等昆虫中存在。除了在水产品间存在外,蟑螂、尘螨与甲壳类动物、软体动物之间也存在一定的TM交叉反应。蟑螂、尘螨与甲壳类动物同属于节肢动物,更易发生交叉反应[62]。蟑螂和螨虫TM与虾TM同源性可达80%以上,其IgE表位相似度高于软体动物TM,所以虾过敏患者对蟑螂和螨虫的交叉反应风险更高[12]。Der p 10并不是屋尘螨主要致敏原,但螨虾过敏综合征(Mite Shrimp Allergy Syndrome,MSAS)已被证实[63]。TM交叉反应还具有地域性及气候性差异,中国农村虾致敏性高于城市,而蟑螂和灰尘较多有诱发虾过敏的可能[64]。也有研究表明尘螨与虾TM阳性反应率低,交叉反应可能由其他致敏原引起[65]。
可食用昆虫与甲壳类动物的TM之间也存在交叉反应,甲壳类动物过敏患者食用粉虫具有过敏风险。在一项双盲食物激发实验中,15名虾过敏患者中有13人对粉虫产生过敏反应,主要致敏原是原肌球蛋白和(或)精氨酸激酶[66]。Jeong等[67]发现重组家蚕TM与其他可致敏TM同源性为78.5%~81.0%,ImmunoCAP结果显示对家蚕TM呈阳性的8份血清中有6份对虾、螃蟹TM也呈阳性,证明家蚕TM与甲壳类动物TM具有潜在交叉反应。
鸡、猪、兔、人的TM与刀额新对虾TM的同源性在53%~57%[61]。吕良涛[51]的研究表明菲律宾蛤仔和猪的TM同源性为50.35%,氨基酸序列差异较大,预测基本无交叉反应。
3 原肌球蛋白致敏性及其消减的研究
3.1 原肌球蛋白致敏性评价
致敏原的致敏性评价主要有生物信息学方法、血清学方法、模拟胃肠液消化实验、细胞学方法和动物模型实验[68]。其中细胞学方法常见的有KU812和肥大细胞等细胞模型;动物模型实验中常用的动物 有C57BL/6、C3H/HeJ、DBA2、Balb/c等[69]小 鼠 品系以及SD、Wistar和BN[70]大鼠品系。
3.1.1 原肌球蛋白致敏性的体外评价 TM是一种致敏性强的致敏原,血清学实验证明了多种TM的致敏性。口虾咕TM的血清IgE反应呈阳性,但其肉中TM含量很低,推测基本不会引发食物过敏[71]。李智伟[72]检测了35位虾过敏患者血清IgE,其中25位患者(71.4%)对TM有反应。南极磷虾作为新型食物来源,免疫印迹结果证明TM是南极磷虾中主要致敏原,且与美国龙虾TM相似。鱼类TM中鳕鱼和长鳍金枪鱼TM可被IgE识别,具有致敏性[58]。
日本沼虾TM可导致KU812细胞产生明显的脱颗粒作用,Balb/c小鼠模型中TM组血液中IgE、IgG1水平明显升高,证明日本沼虾TM具有很强的致敏性[73]。张江涛[74]利用重组的牡蛎Cra g 1致敏原建立BN致敏大鼠模型,与对照组相比,致敏组白细胞和淋巴细胞等含量上升,血液中IgE、IgG水平和组胺释放量上升,肠道肥大细胞产生脱颗粒现象,该动物模型可运用于Cra g 1的致敏性研究。Xu等[75]使用Balb/c小鼠模型与RBL细胞模型比较了对虾、蛤蜊和鱼类TM致敏性,发现鱼TM致敏性较弱,虾TM和蛤蜊TM可使小鼠体内IgE、IgG1、组胺等显著升高,RBL细胞脱颗粒现象明显,具有强致敏性,同时发现TM煮沸前后致敏性变化不显著。
3.1.2 原肌球蛋白胃肠消化稳定性 食物中的致敏原经胃肠道消化后,其结构与表位会产生变化,致敏性也随之改变[76]。模拟胃肠液消化实验对食物致敏原的致敏性评价更准确。TM性质稳定,经过胃肠消化后依然具有致敏性[77]。
锯缘青蟹(Scylla serrata)TM在消化60 min后,相对分子质量为3.4×104的产物仍具有免疫活性[78]。南美白对虾与斑节对虾TM用模拟胃液处理后仅出现小部分降解,模拟肠液处理4 h后原TM条带仍存在,免疫印迹结果表明致敏性虽有下降但未消失,且南美白对虾TM比斑节对虾TM更耐消化[79]。黄天娇[80]选择4种烹饪方式对虾进行处理后,再进行体外消化,发现经水煮、油炸、红烧,虾肉产物免疫活性分别下降86.90%、88.94%和97.39%。牡蛎Cra g 1酸处理后因构象改变而使IgE结合能力下降,对酸处理后的产物进行胃蛋白酶和胰蛋白酶的水解,胃蛋白酶降低致敏性,胰蛋白酶反而使其致敏性上升,可能是因为降解的TM片段暴露或产生了更多的表位[81]。
3.2 原肌球蛋白致敏性消减研究
开发低敏食物是改善食物过敏的一个重要方法,因此如何利用食品加工技术降低致敏性是一个重要问题。食品加工过程中,加工使TM结构产生变化,表位被破坏或者改变,进而影响其致敏性[82]。致敏性消减方法可分为物理法、化学法、生物法等。使用单一方法对TM的致敏性消减效果有限,多种技术联合使用是致敏性消减的研究趋势。
3.2.1 物理方法 物理方法是利用热处理、高压、超声、辐照等方法直接破坏TM的结构,进而影响其致敏性。TM是一种耐高温的蛋白质,因此单纯通过加热对于TM致敏性的影响很小。用高静压技术(HPP)处理凡纳滨对虾TM可破坏其一级结构[44]。Ozawa[83]将虾肉高压加热(121℃、20 min),ELISA结果表明TM的IgE结合能力下降,连续同样条件处理3次后,TM低于检测阈值,证明高压加热是降低虾TM致敏性的有效办法。
辐照技术可以使蛋白质发生交联、降解,分子构象发生变化[84]。如刘光明等[85]研究表明小剂量辐射对中华绒螯蟹(Eriocheir sinensis)和三疣梭子蟹(Portunus trituberculatus)TM影响不大,加大剂量(10 kGy)后可部分破坏TM的表位并降低其致敏性。官爱艳等[86]发现电子束辐照可以降低中华管鞭虾(Solenocera crassicornis)TM的含量和致敏性,辐照能够降解TM和改变TM空间构象,消减致敏性效果与辐照剂量成正比。
3.2.2 化学方法 糖基化是蛋白质中游离氨基与还原糖之间的反应,在致敏性消减中应用较广[87]。虾TM富含有游离氨基的赖氨酸,因此糖基化能够破坏其表位,降低致敏性[88]。
Zhang[89]发现低聚半乳糖、甘露寡糖和麦芽五糖可以降低虾TM(Exo m 1)致敏性,但是低聚果糖与TM发生美拉德反应后,致敏性反而升高,可能是因为原表位被破坏后产生了新致敏原。杨煌[46]将拟穴青蟹TM与L-阿拉伯糖反应,免疫印迹和斑点印迹结果表明美拉德产物的IgE、IgG结合能力下降,并且通过树突状细胞(DC)模型发现美拉德产物抑制CD86表达水平,影响DC对T细胞提呈。Masako等[90]将扇贝TM与葡萄糖反应(60℃、3 h)后IgE结合活性降低。蔺海鑫等[91]发现菲律宾蛤仔TM在美拉德反应发生后α-螺旋含量下降71.7%,IgE结合能力下降76.2%。α-螺旋的稳定性与NH—和—CO之间的氢键有关,证明美拉德反应会破坏TM的结构稳定性。
3.2.3 酶法 酶法是利用蛋白酶断裂肽键破坏一级结构降低蛋白质相对分子质量,或者破坏抗原表位和改变空间结构来降低致敏性[92]。董晓颖等[93]使用5种蛋白酶对海白虾TM进行酶解,间接ELISA结果表明风味蛋白酶和中性蛋白酶降低致敏性的效果最好。孙佳益[94]使用5种酶(胰蛋白酶、菠萝蛋白酶、碱性蛋白酶、无花果蛋白酶、α-胰凝乳蛋白酶)作用于南美白对虾TM,其中无花果蛋白酶可以显著消减致敏性。高永艳等[95]使用菠萝蛋白酶单一酶解与酶解复合超声方法处理南美白对虾虾糜,ELISA结果表明致敏性分别下降30.70%和33.33%。张弛[96]使用碱性蛋白酶水解后的褐对虾Pen a 1构建小鼠致敏模型,水解TM组与TM组相比,sIgE水平下降40.44%,组胺水平下降5%。贾莹等[97]使用酶解和超高压结合方法处理南美白对虾TM,ELISA结果表明致敏性下降95.27%。酶的种类很多,温度与酶解时间等对酶解效果也有影响,选择酶时应注意是否有合适的酶切位点。
3.2.4 其他方法 基因改良是将定点表位的基因敲除或进行基因突变,根本上改变蛋白质的组成和性质从而降低甚至消除致敏性。Wai等[98]对虾TM(Met e 1)进行定点突变,致敏的小鼠血液IgE结合能力和肥大细胞脱颗粒现象显著下降。Liu等[98]将锯缘青蟹TM 3个关键氨基酸(R 90、E 164、Y 267)用丙氨酸进行替代,突变后的TM与原TM相比与患者血清IgE结合活性明显降低。梅雪娇[100]通过基因定点突变降低拟穴青蟹TM的致敏性,对TM关键氨基酸进行基因定点突变,突变TM与原TM相比,IgE结合能力下降18.1%。但是该技术存在一定的风险,可能产生新的表位[101]。
反义肽是DNA反义链编码而成的肽段,可与正义肽特异性配对,通过生物信息学方法筛选与TM特异性结合的适配体小肽。适配体小肽能与目标蛋白质强亲和力结合,12个TM的适配体小肽对拟穴青蟹TM和IgG的结合均有抑制作用[100]。
4 展望
随着水产品产量和消费量的迅速增加,甲壳类水产品引起的食物过敏现象越来越普遍。原肌球蛋白是甲壳类水生动物中一种重要的致敏原,研究人员对TM的性质、表位、交叉反应、致敏性及其消减等方向不断探索,已取得了很多重要进展。TM的结构与基本性质已被基本了解,各种生物信息学软件分析促进了对TM表位的研究。同时TM表位的研究对探索致敏性与交叉反应等至关重要。但对TM的研究还有很多难题,如在表位方面对其构象表位的了解还知之甚少,TM交叉反应的机制尚不明确等。生产低致敏甚至脱敏水产品加工食品具有广阔前景,但目前基本停留在理论研究阶段,还需要进一步深入探索。

