低温等离子体协同CeO2/13X催化降解甲苯
叶凯,刘香华,姜月,于颖,赵亚飞,庄烨,郑进保,陈秉辉
(1 福建龙净环保股份有限公司,福建龙岩364000; 2 厦门大学化学化工学院,福建厦门361005)
引 言
VOCs 具有易挥发、来源广、成分复杂等特点,对大气环境造成破坏,威胁人们的身体健康。甲苯作为VOCs 中典型的污染代表物质具有低毒性并且进入体内后对细胞造成破坏,引起代谢紊乱[1]。另一方面,源于低浓度甲苯的有机气溶胶会导致光化学烟雾,并将诱发呼吸道疾病。目前有机物废气的常规处理主要使用吸附、吸收、生物过滤、低温等离子体技术等[2]。鉴于易于操作及较高能源效率等优点,低温等离子体协同催化剂是一种有效且极具潜力降解VOCs的处理技术[3-6]。
在等离子体协同催化(NTP-CAT)体系中,单独的载体(BaTiO3、氧化铝、分子筛、TiO2)由于具有一定的比表面积,常作为载体去除VOCs[7-9]。载体填充在等离子体区域中进行降解VOCs,得到VOCs 的去除率比单独NTP 反应的去除率有不同程度的提高。但是,单独的载体往往无法利用或生成反应所需的氧物种,以致VOCs的去除率较低[10]。而解决该问题则可以在载体上负载相应的金属活性组分[11]。比如,Cu、Co、Ce 组分负载于13X,将有利于二氧化碳选择性增高,并归因于所引入的组分使活性位点增多,产生的活性氧变多[12-13]。当然,具有合适吸附性能的载体也可以提高NTP 降解VOCs 的去除率[14-15]。此外,注意到催化剂的活性组分主要包括贵金属和过渡金属氧化物两大类。尽管负载型的贵金属基催化剂在低温度下即可表现出良好的活性,使VOCs 完全氧化,如Pd/Al2O3[16]和Pt/Al2O3[17];但贵金属催化剂受到其成本和敏感性的限制。因此,作为铂和钯的低成本替代品,非贵金属氧化物催化剂更有商业应用吸引力。
研究指出,非贵金属/稀土元素Ce 具有特殊的4f 电子结构[18],其相应的CeO2催化剂往往具有良好的储氧能力[19-20]以致能提高催化剂的催化活性。这是因为Ce3+和Ce4+之间存在氧化还原循环过程,使该组分易于吸附和活化气氛中的氧分子,形成活性氧物种(如O2-,O22-),从而更好地氧化VOCs。Liu 等[21]探究了Ce4+还原成Ce3+所形成的氧缺陷与CO的反应机制,即表面氧缺陷可以有效地将气态氧转化成活性氧物种。原位产生的活性氧物种可以直接将CO氧化。氧缺陷越多,催化氧化活性也越高。尽管CeO2基 催 化 剂 如CeO2/HZSM-5 也 用 于NTP 中 的VOCs 消除,但是,对其中的反应机制均未深入研究[22-24]。
因此,本文采用低温等离子体协同催化剂对目标污染物甲苯进行降解,在选择合适载体负载Ce组分的基础上,进一步考察在NTP-CAT 体系中CeO2含量变化对甲苯降解的影响;利用XRD、BET、XPS等表征手段对CeO2基催化剂的活性差异进行了探究,并分析讨论NTP-CAT 降解甲苯的反应机制,以期对NTP 的作用机理有更进一步的认识,为后续设计高效的催化剂奠定基础。
1 实验材料和方法
1.1 材料
甲苯、13X 分子筛、硝酸铈、50%硝酸锰溶液均为分析纯,购自国药集团化学试剂有限公司;碱性氧化铝、二氧化钛为化学纯,购自国药集团化学试剂有限公司;无水乙醇为分析纯,购自西陇科学股份有限公司;O2、Air、He 和Ar 纯度均为99.999%,购自福州新航工业气体有限公司;N2纯度为99.999%,购自林德气体有限公司;H2-N2纯度为5%H2,购自福州新航工业气体有限公司。
1.2 反应装置
实验装置如图1 所示。它由鼓吹系统、NTP 反应系统、产物分析系统等部分组成。其中,NTP反应系统由双介质阻挡反应器(双介质阻挡放电指在高压电极与接地电极间的气隙中插入两层绝缘介质,用以阻挡贯穿气隙的放电通道[25-26]。本研究装置中其中一层介质为高压电极表面包裹的陶瓷轴,另一层阻挡介质为石英反应管)、高压变频电源、电压探头、泰克数字存储示波器等组成,由南京苏曼等离子科技公司提供。其中,双介质阻挡放电反应器的介质材料采用石英,介质层厚度1 mm,中心电极半径6.5 mm,其相应的放电间隙3.5 mm,放电频率10 kHz。放电特性如图2。
1.3 分析测试仪器
Tristar3000/3020 静态氮吸附仪;日本Rigaku Ultima ⅣX 射线衍射仪;PHI 5000C ESCA System X射线电子能谱仪;德国布鲁克AXS 有限公司S8 TIGER XRF;厦门百得科沃公司搭建的MFTP-3060程序升温脉冲吸附分析仪;GC-950气相色谱。
1.4 催化剂的制备
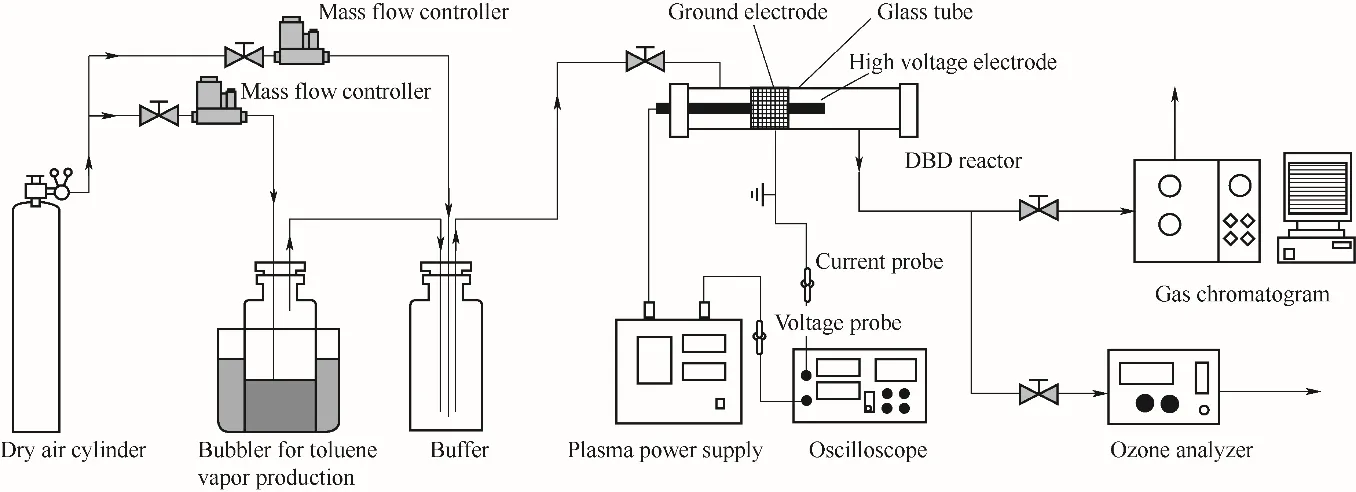
图1 实验装置及流程Fig.1 Experiment device and flow chart
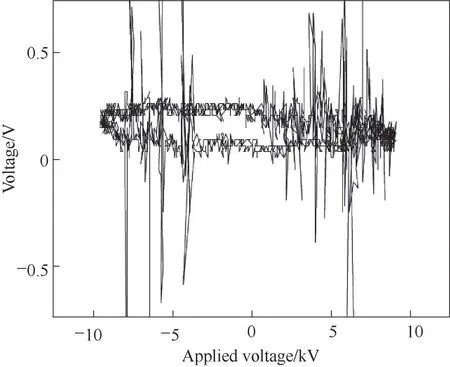
图2 等离子体放电时的Lissajous图形Fig.2 Discharge properties(Lissajous plot)
采用浸渍法将Ce 组分负载在不同的载体上。称取一定量的Ce(NO3)3·6H2O溶解在去离子水中,分别加入一定量的分子筛13X、TiO2和γ-Al2O3。常温条件下浸渍12 h,120℃干燥12 h,550℃焙烧4 h,将焙烧完的催化剂压片过筛,0.6~0.85 mm备用。其中CeO2的负载量(质量分数)为40%,制备合成的催化剂表示为:40%Ce/13X、40%Ce/TiO2、40%Ce/Al2O3。
采用浸渍法将不同含量的CeO2负载在分子筛13X 上。称取一定量的Ce(NO3)3·6H2O 溶解在去离子水中,加入一定量的分子筛13X,常温条件下浸渍12 h,120℃干燥12 h,550℃焙烧4 h,将焙烧完的催化剂压片过筛,0.6~0.85 mm 备用。其中,CeO2的负载量(以质量分数)为10%、20%、30%、40%。所制催化剂相应标记为:10%Ce/13X、20%Ce/13X、30%Ce/13X、40%Ce/13X。
1.5 催化剂的活性评价
以双介质阻挡(DBD)反应器及电极等构成的NTP 反应器为评价装置来测试催化剂的活性,取0.6 g 催化剂置于反应器中(等离子体发生的位置),一路空气(15 ml/min)鼓吹甲苯溶液,另一路空气(185 ml/min)稀释甲苯的浓度,将甲苯的浓度控制在约2400 mg/m3。反应产物进入气相色谱的两个火焰离子检测器FID 进行分析,一个用于检测分析甲苯浓度,另一个FID与甲烷转化炉相连接,用于检测和分析CO和CO2。甲苯的去除率及产物CO2的选择性的计算公式如下:
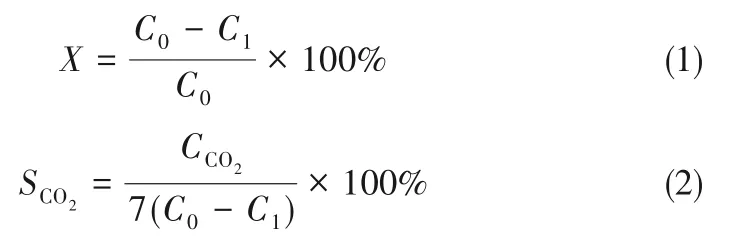

2 实验结果与讨论
2.1 等离子体催化剂的优化与选择
2.1.1 不同载体上CeO2基催化剂降解甲苯 负载在不同载体上的40%CeO2基催化剂协同NTP 对甲苯去除率和CO2选择性的变化如图3 所示。从图3可以看出,在NTP 输入电压20 V,输入电流0.9 A 的条件下(输出电压和电流为约20 kV 和约0.9 mA),40%CeO2基催化剂对甲苯去除率和CO2选择性相较于单独NTP 均有所提高。而不同催化剂去除甲苯的活性和CO2选择性排序为:40%Ce/13X > 40%Ce/TiO2> 40%Ce/Al2O3。特 别 地,40%Ce/13X 在NTPCAT 体系中对甲苯的去除率和CO2选择性可分别高达62.3%和58.8%;而此时13X 仅能去除44.4%的甲苯,CO2选择性仅为16.6%。可见,Ce 组分的引入对甲苯降解具有重要影响。

图3 等离子体协同铈基催化剂处理甲苯Fig.3 Supported CeO2-based catalysts with NTP to decompose toluene
2.1.2 不同CeO2负载量催化剂降解甲苯评价 基于最优载体13X,本研究进一步考察CeO2负载量对甲苯降解性能的影响。从图4 中可以看出,甲苯去除率和CO2选择性随着CeO2负载量的增加呈现先增加后降低的趋势。当CeO2的负载量小于30%时,等离子体协同催化剂对甲苯的去除率随着负载量的增加而升高,但当CeO2的负载量继续增加时,甲苯的去除率反而降低。
当CeO2的负载量为10%、20%、30%及40%,催化剂协同等离子体处理甲苯反应时间为150 min 时的甲苯去除率分别为66.4%、68.5%、84.6% 和62.3%,相应的CO2选择性为48.2%、43.8%、55.9%和49.4%。总之,13X 上负载较多的CeO2应有利于放电,以致甲苯去除率升高。研究表明,13X、HY 或ZSM-5 等分子筛上负载金属氧化物确实有利于更大区域的放电[27]。注意到本文使用的是双介质阻挡放电以及处理较高甲苯浓度(约2400 mg/m3),有研究采用电晕放电处理低浓度甲苯(约600 mg/m3),在11~20 W 功率下可以转化45%~62%甲苯,CO2选择性则介于45%~53%[28]。
此外,过多的Ce 会堵塞分子筛13X 的部分孔道及覆盖相应的酸性位点,将影响甲苯的吸附,以致甲苯去除率和CO2选择性下降。以13X 和40%Ce/13X为对象,在200 ml/min流量和约2400 mg/m3甲苯入口浓度下进行吸附测试,结果也表明40%Ce/13X对甲苯的吸附性能确实大大减弱(图5)。
2.2 催化剂的表征
2.2.1 催化剂的织构特征与晶相特征x%Ce/13X催化剂协同NTP 降解甲苯反应前后的N2-等温吸脱附曲线及孔径分布图如图6 所示。表1 给出了协同等离子体反应前后x%Ce/13X 催化剂的比表面积、孔容和孔径数据。从表1 可知,随着CeO2的负载量的增加,Ce 组分将占据部分13X 载体的孔道,以致CeO2基催化剂的比表面积逐渐降低。结合活性数据可知,甲苯的去除率与催化剂的比表面积之间并不是呈线性关系。虽然10%Ce/13X 的催化剂比表面积最高,但其去除效果并不是最好的。这说明较大的比表面积虽然有利于气体的物理吸附[29],但不是影响催化活性的唯一因素。此外,对于协同NTP 催化甲苯反应后的x%Ce/13X 催化剂,其相应的比表面积均有一定幅度的降低。其中,10%Ce/13X 和40%Ce/13X 的较大介孔(6~16 nm)变少,而4 nm 附近的介孔变多。注意到30%Ce/13X催化剂的比表面积下降最为明显,接近39%。可以看出,30%Ce/13X 催化剂反应后较大介孔(6~16 nm)部分坍塌,以致其介孔孔径由5.0 nm 变化为6.5 nm。结合30%Ce/13X 对甲苯的去除率最高可推测,此时孔径变大应与催化剂表面反应较为激烈有关。

图4 等离子体协同不同负载量的铈基催化剂处理甲苯Fig.4 The effect of CeO2 loading on toluene degradation in NTP-CAT system
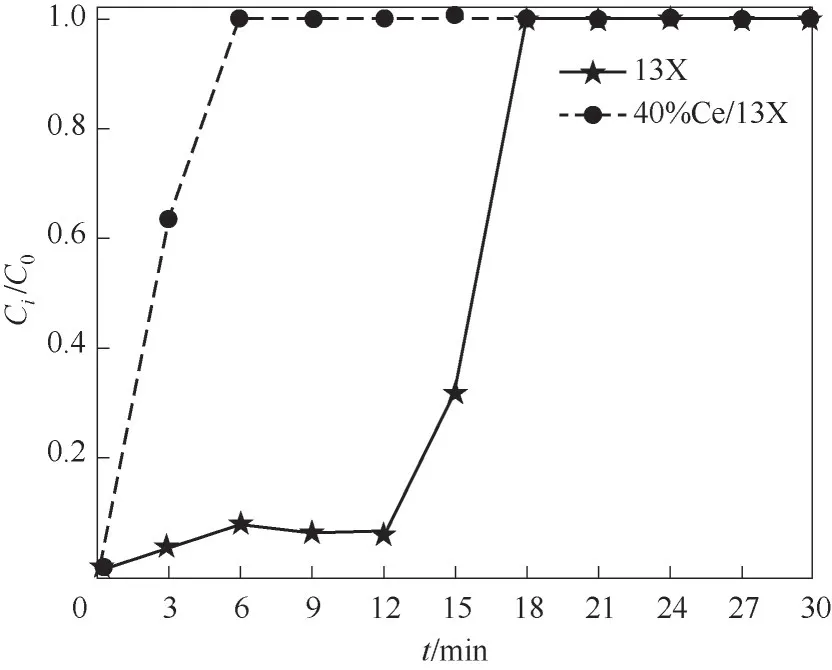
图5 13X和40%Ce/13X吸附甲苯的性能Fig.5 The performance of adsorbing toluene for 13X and 40%Ce/13X
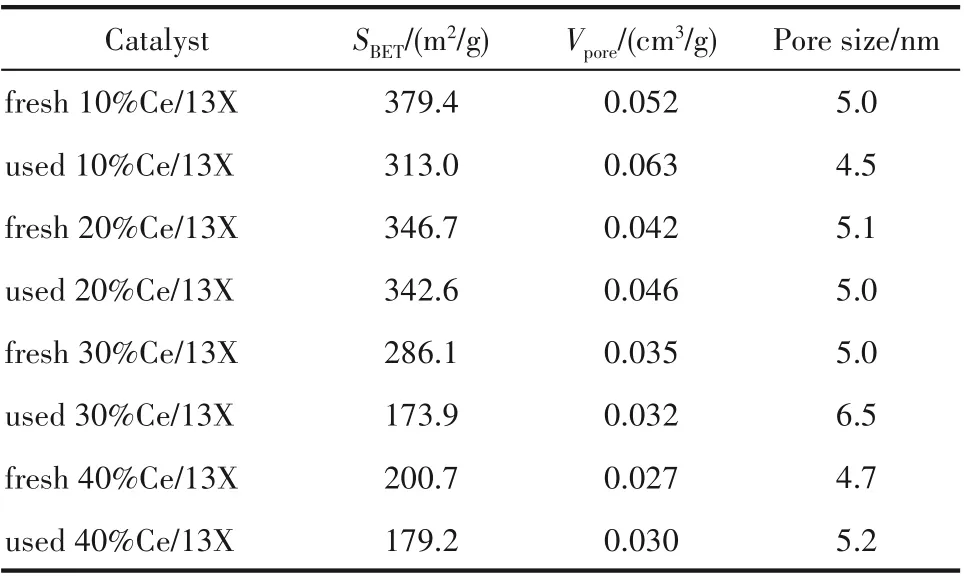
表1 CeO2基催化剂的比表面积、孔容和孔径Table 1 Textural properties of CeO2-based catalysts
在获取织构特征信息后,本文进一步研究了协同NTP 催化降解甲苯反应前后x%Ce/13X 催化剂的晶相变化,其结果如图7 所示。在图7(a)中,当CeO2的负载量高于20%时,在28.6°、47.5°和56.3°处可看到相应催化剂的CeO2的特征衍射峰。当CeO2负载量低于20%时,x%Ce/13X 催化剂中CeO2特征峰并不明显。这说明当CeO2负载量较低时,Ce 组分在13X 上可以高度分散。当然,30%Ce/13X 催化剂的CeO2分散也相对较好。但40%Ce/13X 催化剂协同NTP降解甲苯后,CeO2的特征峰强度增强,衍射峰的宽度变窄[图7(b)]。这说明上述两种催化剂协同NTP 催化甲苯氧化反应后CeO2颗粒增大。这可能是由于甲苯氧化反应产生的高温热点使CeO2颗粒聚集长大。可见,x%Ce/13X 催化剂中Ce 组分在载体的分散特点及其与载体的相互作用存在差别。
2.2.2 催化剂表面物种 为了研究x%Ce/13X 催化剂表面物种的分布及其价态,本节对不同CeO2负载量催化剂进行了XPS 表征。Ce 3d 谱图和O 1s 谱图分别见图8和图9。
对于Ce 3d 谱图,u,u″,u‴,v,v″和v‴被认为是Ce4+物种的特征峰,而Ce3+物种的特征峰则清晰可见于u'和v'[30-31]。图9 中O 1s 谱图有三个特征峰,这些峰从低结合能到高结合能依次分别归属于三种氧物种的存在形态:晶格氧(Olatt,530.4 eV 附近),表面活性氧(Osur,531.5 eV 左右)和表面物理吸附氧(532.6 eV 附近)。其中,表面物理吸附氧一般指催化剂表面上吸附的羟基和被吸附的水中的氧。而表面活性氧则归属为弱键合能的氧物种和低配位的表面氧离子(如O2-,O22-和O-),被认为是催化氧化反应中活性最高的氧物种[31-33]。表面活性氧的数量往往决定着催化反应的速率与活性。
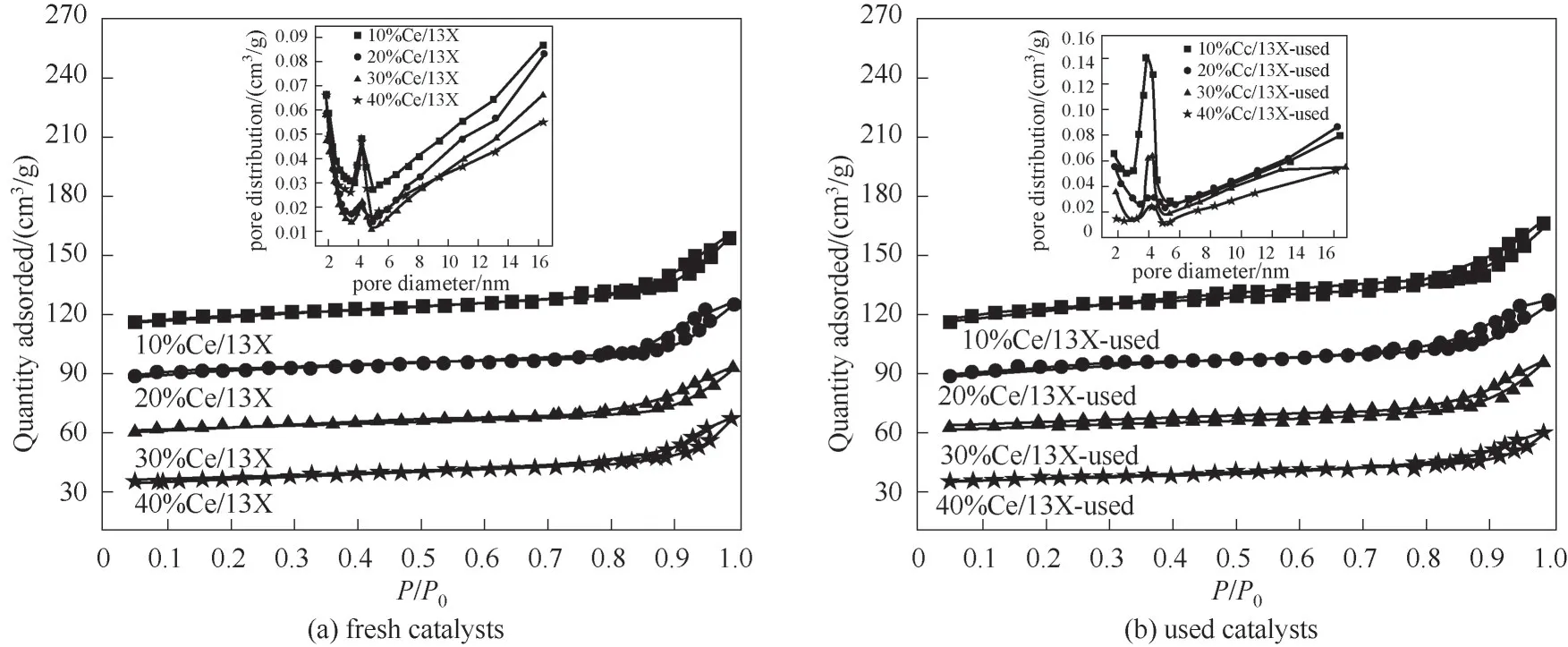
图6 不同催化剂反应前后的N2-等温吸脱附曲线和孔径分布Fig.6 Nitrogen adsorption-desorption isotherms and corresponding pore size distribution curves (inset)of different CeO2-based catalysts

图7 不同催化剂XRD谱图Fig.7 XRD patterns of different CeO2-based catalysts

图8 不同催化剂的Ce 3d XPS谱图Fig.8 Ce 3d XPS spectra of different CeO2-based catalysts
将各物种对应的特征峰拟合分析,x%Ce/13X催化剂表面CeO2含量及活性氧物种含量列于表2。表2中数据显示,x%Ce/13X 催化剂表面上的Ce/(Si+Al)比例随着CeO2负载量的增加而提高。这与其比表面积相应变小一致。而该系列催化剂表面的Ce3+/(Si+Al)比例随着CeO2负载量的增加呈“火山型”曲线变化,以30%Ce/13X 催化剂上Ce3+/(Si+Al)比例最高。x%Ce/13X 催化剂表面Ce 物种不同,会影响催化剂表面活性氧物种的变化。因为Ce4+还原成Ce3+的同时会产生氧空位,即氧空位的含量一般与Ce3+的含量呈正比。
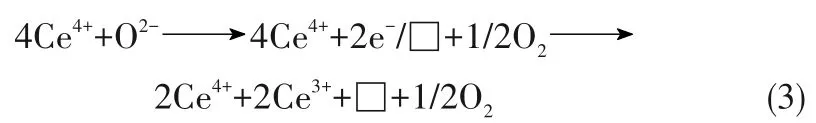
式中,□代表氧空位,当O2-从催化剂晶格中脱除时,即Ce4+被还原成Ce3+的同时,将产生一个氧空位[21,34]。
因此,高Ce3+/(Si+Al)比例有助于表面氧空位和不饱和键的生成,进一步增强30%Ce/13X 催化剂表面对氧气分子的吸附和活化,从而生成更多的表面活性氧物种[即Osur/(Si+Al)比例最高],更有利于降解吸附的甲苯。这与其催化活性最高相一致。比较NTP 协同催化反应前后催化剂表面的Ce 物种和氧物种,Ce3+/(Si+Al)比例基本增加,并随着CeO2负载量的增加,30%Ce/13X 和40%Ce/13X 相对应的Osur/(Si+Al)比例提高更明显,分别从1.55 和1.30 提高至2.52和1.77。这可能是NTP 产生的高能电子将Ce4+还原成Ce3+,导致催化剂表面含有更多的Ce3+,使其活化氧的能力提高。等离子体处理也可以使Pt/CeO2催化剂的表面Ce3+和Pt0物种增多[35]。类似地,Pd/HZSM-5 催化剂经过辉光放电等离子体处理后,催化剂表面的PdO 物种被还原成金属Pd[36]。尽管40%Ce/13X 的Osur浓度较高,但过多的Ce 组分堵塞部分13X 孔道及其相应的酸性位点,使其比表面积变小,不利于甲苯的吸附。

图9 不同催化剂反应前后的O 1s 谱图Fig.9 O 1s XPS spectra of different CeO2-based catalysts
2.2.3 催化剂的还原性能 不同负载量的CeO2基催化剂的H2-TPR(图10)可以较好区分Ce组分与载体的相互作用以及氧物种的差别。根据文献[37],在低于600℃的温度下CeO2的还原峰归因于表面和次表面氧原子的存在,这是CeO2储氧能力高的主要原因。而x%Ce/13X 催化剂的还原温度大幅度降低。这表明Ce 与13X 间的相互作用使氧物种的流动性变强。而氧物种的流动性更强,更利于氧化还原反应发生。图10 也表明随着催化剂上CeO2负载量的增加,CeO2还原峰也移至更低的温度。图10(a) 中650℃左右的还原峰可能与氧化铈的还原以及消除晶格O2-阴离子有关[38]。而经过NTP-CAT 降解甲苯后的催化剂,还原峰明显分开,应是由于NTP 的作用使催化剂中不同Ce 物种在逐渐演变。从上述XPS结果也可看出,在NTP下反应后,催化剂表面的Ce4+被还原成Ce3+,使其表面Ce3+/(Si+Al) 比例升高,吸附和活化氧的能力提高。因此,在NTP 下反应后,30%或40%CeO2/13X的Osur浓度增加。
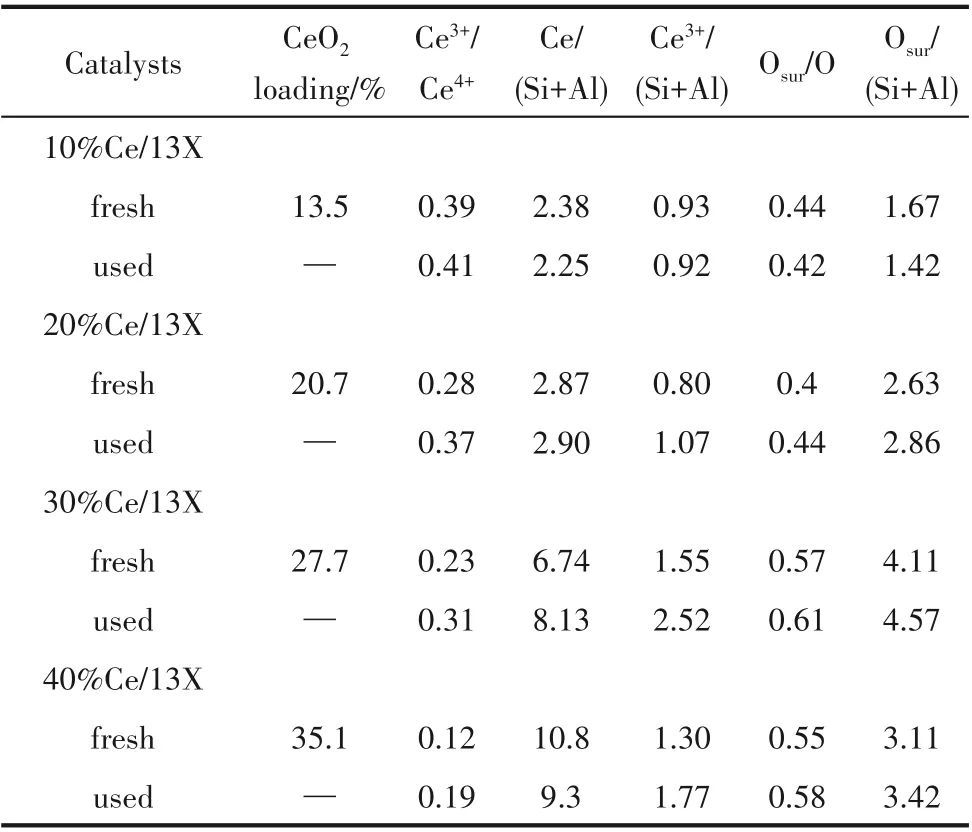
表2 不同催化剂元素的表面组成Table 2 The surface composition of different CeO2-based catalysts
2.2.4 反应机制分析 在传统的催化领域,CeO2基催化剂的催化活性主要体现在强大的提供活性氧能力。为了证明催化剂在甲苯氧化过程中Ce3+与Ce4+的关系,本研究进行空白样实验,即维持NTP 功率、反应物料总流速一定,在不通甲苯的条件下,使用催化剂在NTP内部反应2 h,随后用O2-TPD表征,结果如图11 所示。从图11 中可以看出,相比于未经处理的30%Ce/13X,该催化剂经过NTP 处理,其对氧物种的吸附能力提高。这与上述XPS 分析结果一致。即,NTP 处理可将CeO2基催化剂表面的Ce4+还原为Ce3+,而后者在催化剂表面形成了更多的氧空位。而氧空位又可提高Ce3+与Ce4+的转换,且Ce3+和Ce4+之间的转换是一个氧化还原循环,在此过程中产生更多的活性氧物种。
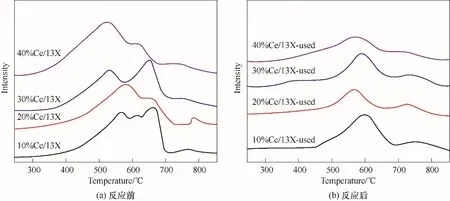
图10 不同催化剂的H2-TPR谱图Fig.10 The H2-TPR profiles of different CeO2-based catalysts
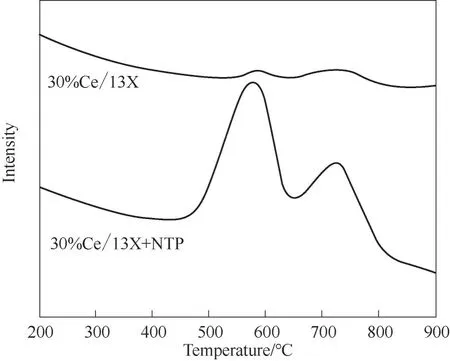
图11 不同反应条件下30%Ce/13X催化剂的O2-TPDFig.11 The O2-TPD of 30%Ce/13X catalyst under different reaction conditions
一般地,13X 作为一种弱酸性的分子筛,可用于甲苯的吸附。本研究发现Ce负载量过高时,甲苯的去除效果相对较差。此时,13X 吸附甲苯的位点应较少。而Ce 负载量过低时,甲苯的去除效果也较差,则与表面的Ce3+太少有关。典型的例子是,13X不负载Ce 组分时,其对甲苯的去除率仅达到44.4%。而且,尽管13X 可以用于吸附甲苯,但是在NTP-CAT 体系中,甲苯降解产物中的CO2选择性仍较低(16.6%)。可见,Ce 组分(特别是Ce3+)对反应产物CO2选择性具有重要影响,当然这与其具有活化氧的性质有关。
从图3 也可以看出,甲苯的去除率在单独NTP下确实较低。可见,此时NTP 的输出电压尚未达到甲苯的击穿电压(约25 V)。当然,NTP 对13X 吸附甲苯的化学键活化可以起到一定的作用。
因此,甲苯降解在NTP-CAT体系中应存在分工协同机制。近期综述也较详细总结分析等离子体催化中的协同机制[39-40]。首先,催化剂对等离子体的影响可以表现在催化剂表面更大区域的放电等[27]。而等离子体则可以影响催化剂表面物种的分散及价态,如Pt/CeO2中表面Ce3+的浓度[35]。
对于本研究,首先具有弱酸性的13X 载体有利于对甲苯分子的吸附;其次,低温等离子体产生的高能电子既可活化吸附的甲苯,又可将催化剂CeO2/13X 表面的Ce4+还原成Ce3+,促使Ce3+与氧气反应进一步产生活性氧物种。当然,低温等离子体放电也会受催化剂影响。即,金属氧化物负载于13X 上将可能存在更大区域的等离子体放电及部分放电增强,甚至可进一步提高电子的能量[27,39]。最后,Ce3+产生的活性氧物种与吸附在催化剂表面的活化甲苯分子发生反应,将甲苯分解成一氧化碳、二氧化碳和水。
3 结 论
本文以NTP-CAT系统分解甲苯为研究对象,在NTP 输入电压为20 V,输入电流为0.9 A 条件下,筛选13X、TiO2及Al2O3载体,发现CeO2基催化剂适合采用13X 载体。在此基础上,本文进一步考察在NTP-CAT 中CeO2负载量对甲苯降解的影响。结果发现,NTP-CAT 体系中30%Ce/13X 表现出最优性能。此时甲苯的去除率和CO2产物选择性分别达约85%和约55%。
随后,表征结果也表明,30%Ce/13X 的Ce 组分在其表面分散相对较好,而且经等离子体协同催化降解甲苯后,其表面的Ce4+可转化为Ce3+物种,表面Ce3+/(Si+Al)由1.55 提高至2.52。此时,30%Ce/13X相对其他催化剂拥有最多的表面Ce3+物种。而表面Ce3+物种与甲苯降解过程存在密切关系。
经分析认为,甲苯降解过程首先是NTP 中的电子将Ce4+还原成Ce3+,而所产生的Ce3+与氧气进一步产生活性氧;然后Ce3+产生的活性氧与吸附在13X上的活化甲苯发生反应,将甲苯分解成一氧化碳、二氧化碳和水。可见,甲苯降解在NTP-CAT体系中应存在分工协同机制。

