lncRNA UCA1通过激活miR-143/HK2通路促进皮肤鳞状细胞癌A431细胞增殖、侵袭和EMT
张永红,李存涛,张玉红,姚丽
郑州大学附属郑州中心医院皮肤科,河南 郑州 450000
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是一种源自表皮角质形成细胞的皮肤肿瘤[1],大部分患者在诊断时已发展为侵袭性CSCC[2]。这些高转移性疾病的长期预后非常差,疾病特异性生存率为44.56%。因此,寻找新的诊断生物标志物,从而提高CSCC的治疗效果迫在眉睫。长链非编码RNA(long non-coding RNAs,lncRNAs)是一类长度超过200个核苷酸的非编码调控RNA[3]。研究表明lncRNA在染色体失活、基因组印记和发育等生物学过程中发挥调控作用[4-5]。最近,越来越多的报道显示许多失调的lncRNA参与了人类癌症的上皮间质转化(epithelial-mesenchymal transition,EMT)和转移[6-7]。例如,lncRNA PVT1高表达在食管癌中通过诱导EMT促进侵袭[8],而lncRNA PANDAR表达升高对结直肠癌预后不良,并通过EMT途径促进转移[9]。UCA1首次被确定为膀胱癌的致癌lncRNA。UCA1在乳腺癌、胰腺癌、胃癌和结直肠癌等多种癌症中高表达[10-11],提示UCA1的高表达可能是预测这些癌症转移和预后的分子标记。一些研究也表明UCA1的上调与乳腺癌和膀胱癌的EMT相关,但UCA1在CSCC中的表达及其潜在机制仍不清楚。本研究旨在探讨lncRNA UCA1对皮肤鳞状细胞癌A431细胞的表达及其对癌细胞增殖、侵袭及其EMT的影响,现将结果报告如下。
1 材料与方法
1.1 主要材料与试剂
40例CSCC和28例癌旁正常组织标本均来自本院,收集的标本经患者同意和本单位伦理委员会批准,保存在液氮中用于后续实验。人皮肤鳞癌细胞(A431细胞)和人正常皮肤细胞(HaCaT细胞)购自武汉普诺赛生命科技有限公司;双荧光素酶报告基因检测试剂盒来自美国Abcam公司;改良Eagle培养基(Dulbecco's Modified Eagle Medium,DMEM)为美国Gibco公司产品、长链非编码RNA UCA1下调质粒(UCA1 siRNA);长链非编码RNA UCA1过表达质粒(pcDNA-UCA1)、miR-143抑制剂(miR-143 inhibitor)、miR-143模拟物(miR-143 mimics)、己糖激酶Ⅱ下调质粒(HexokinaseⅡsiRNA,HK2 siRNA)等由Genepharma公司合成;钙粘附蛋白E(E-cadherin)、钙粘附蛋白N(N-cadherin)、GAPDH多克隆抗体购自上海碧云天生物科技有限公司;Turbofect为美国Invitrogen公司产品。
1.2 方法
1.2.1 细胞培养用含有10%胎牛血清的DMEM培养基培养A431细胞和HaCaT细胞,各组细胞放置于37℃、5% CO2细胞培养箱中,细胞培养基每2 d更换1次,长满后及时消化细胞。
1.2.2 细胞转染用10%FBS的DMEM稀释长满的细胞,接种于12孔板,观察细胞生长至约70%时,用无血清的DMEM培养基覆盖细胞单层,利用Turbofect转染试剂,按照说明书进行质粒转染,按实验要求,所有细胞在37℃、5% CO2的培养箱中孵育一定时间后,收集各组细胞进行后续实验。
1.2.3 细胞活力测定将各组细胞按4×103/孔的密度接种至96孔板中,各组质粒转染至细胞48 h后,吸去每孔培养基,用PBS洗涤3次,每孔加入20μL MTT,在37℃培养箱孵育4 h后,吸去上清液,每孔细胞中加入150μL DMSO,在37℃摇床中充分摇动10 min,在酶标仪下读取490 nm处的吸收峰。
1.2.4 双荧光素酶报告基因活性检测首先构建lncRNA UCA1 wt载体和HK2 wt载体,利用点突变试剂盒突变质粒,构建lncRNA UCA1 mut和HK2 mut载体。A431细胞稀释并接种于12孔板,观察细胞密度为70%~75%时,将lncRNA UCA1 wt、lncRNA UCA1 mut分别与miR-143 mimics、mimics NC质粒,HK2 wt、HK2 mut分别与miR-199a-5p mimics、mimics NC质粒共转染至A431细胞,48 h后采用双荧光素酶报告基因检测试剂盒测定荧光素酶活性。
1.2.5 细胞侵袭实验用Turbofect将质粒转染至A431细胞48 h后,重悬细胞并制成细胞悬液,预先加入100μL基底胶(Matrigel)于Transwell上室中,再将1×105个稀释后的细胞加入其中,下室中加入600μL完全DMEM培养基,24 h后取小室,加入4%多聚甲醛固定细胞,吸去固定液后加入PBS洗涤3次,加入0.1%结晶紫染色20 min,随机选取计数5个视野中的细胞数观察并计数。
1.2.6 实时定量PCR收集各组细胞,加入Trizol提取细胞总RNA,使用逆转录试剂盒(ReverTra Ace qPCR RT Master Mix)将细胞总RNA逆转录为cDNA。以cDNA为模板,进行RT-qPCR,用StepOnePlus实时PCR系统(Thermo Fisher)检测PCR产物,每组设置3个复孔,GAPDH为内参。实验所用的引物见表1。

表1 引物序列Table 1 Sequences of primers
1.2.7 Western blot用RIPA裂解液提取细胞总蛋白,使用BCA蛋白检测试剂盒(Beyotime)在酶标仪中测定蛋白浓度。加入上样缓冲液变性10 min后,取50μg蛋白样品进行SDS-PAGE,再转移到PVDF膜上;用封闭液(5%脱脂奶粉)将膜封闭2 h,TBST洗涤3次,分别加入特异性一抗,4℃孵育过夜,TBST洗涤3次后加入二抗,室温摇床孵育2 h,膜清洗干净后进行蛋白曝光,应用Image J软件对膜上蛋白质条带的灰度值进行检测分析,实验重复3次。
1.3 统计学处理
采用SPSS 17.0软件处理数据,实验数据用平均数±标准差表示,至少取3次独立实验结果。lncRNA UCA1 siRNA与siRNA NC,HK2 siRNA与siRNA NC,miR-143 inhibitor与inhibitor NC等两组间比较采用配对t检验;mimics NC+UCA1 wt组和UCA1 wt+miR-143 mimics组、mimics NC+UCA1 mut组和UCA1 mut+miR-143 mimics组、mimics NC+HK2 wt组和HK2 wt+miR-143 mimics组、mimics NC+HK2 mut组和HK2 mut+miR-143 mimics组等两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 下调lncRNA UCA1抑制A431细胞的增殖、侵袭及EMT
RT-qPCR结果显示,lncRNA UCA1在皮肤鳞状细胞癌中表达量为2.89±0.46,在癌旁正常组织中表达量为1.23±0.72,两者比较差异具有统计学意义(t=20.65,P=0.002);A431细胞中的lncRNA UCA1表达量为1.86±0.52,HaCaT细胞中为0.94±0.38,两者比较差异具有统计学意义(t=22.06,P=0.002)。lncRNA UCA1 siRNA、siRNA NC组细胞内UCA1表达量分别为0.45±0.73和1.12±0.38,表明lncRNA UCA1 siRNA质粒转染成功。UCA1 siRNA组A431细胞增殖能力明显低于siRNA NC组(t=25.78,P=0.001);与siRNA NC组相比,UCA1 siRNA组Ncadherin蛋白表达量明显降低(t=18.74,P=0.004),E-cadherin蛋白表达量明显上升(t=23.58,P=0.001);与siRNA NC组相比,UCA1 siRNA组细胞侵袭数目明显减少(t=19.75,P=0.003)。见图1A~1C。

图1 下调lncRNA UCA1抑制A431细胞的增殖、侵袭及EMT 1A:MTT法检测下调lncRNA UCA1对A431细胞增殖的影响;1B:Western blot实验检测下调lncRNA UCA1对A431细胞EMT的影响;1C:Transwell检测下调lncRNA UCA1对A431细胞侵袭的影响Figure 1 Down-regulation of lncRNA UCA1 inhibits proliferation,invasion and EMT of A431 cells.1A:The effect of down-regulation of lncRNA UCA1 on proliferation of A431 cells was detected by MTT assay;1B:Western blot was used to detect the effect of down-regulating lncRNA UCA1 on EMT of A431 cells;1C:The effect of down-regulating lncRNA UCA1 on the invasion of A431 cells was detected by transwell.
2.2 lncRNA UCA1与miR-143之间的关系
图2为miRanda预测的UCA1和miR-143之间的结合位点。与mimics NC+UCA1 wt组相比,UCA1 wt+miR-143 mimics组细胞的荧光素酶活性明显降低(t=28.41,P=0.001);与mimics NC+UCA1 mut组相比,UCA1 mut+miR-143 mimics组细胞的荧光素酶活性无明显变化(t=0.97,P=0.434)。RT-qPCR结果显示:UCA1 siRNA组细胞内miR-143表达量明显高于siRNA NC组(1.82±0.45比0.97±0.36,t=12.26,P=0.006);pcDNA-UCA1组细胞内miR-143表达量明显低于pcDNA-3.1(+)组(0.37±0.26比0.98±0.34,t=11.52,P=0.007),表明lncRNA UCA1与miR-143之间具有负调控关系。
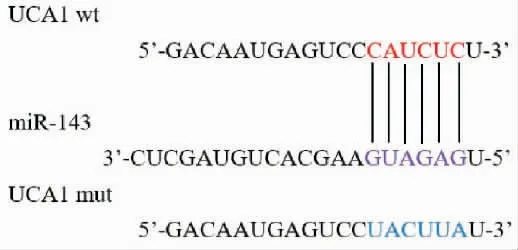
图2 预测lncRNA UCA1与miR-143之间的结合位点Figure 2 Prediction of binding sites between lncRNA UCA1 and miR-143.
2.3 下调miR-143促进A431细胞的增殖、侵袭及EMT
RT-qPCR结果显示,皮肤鳞状细胞癌中miR-143表达量为0.45±0.34,癌旁正常组织中为1.05±0.92,两者比较差异具有统计学意义(t=13.60,P=0.006);A431细胞中的miR-143表达量为0.56±0.76,HaCaT细胞中为1.24±0.37,两者比较差异具有统计学意义(t=11.68,P=0.007)。miR-143 inhibitor、inhibitor NC组细胞内miR-143表达量分别为0.37±0.79和1.04±0.34,两者比较差异具有统计学意义(t=17.46,P=0.003)。miR-143 inhibitor组A431细胞增殖能力明显高于inhibitor NC组(t=19.80,P=0.002);与inhibitor NC组相比,miR-143 inhibitor组E-cadherin蛋白表达量明显降低(t=20.06,P=0.002),N-cadherin蛋白表达量明显上升(t=18.82,P=0.002);与inhibitor NC组相比,miR-143 inhibitor组细胞侵袭数目明显增加(t=15.53,P=0.004),见图3A~3C。
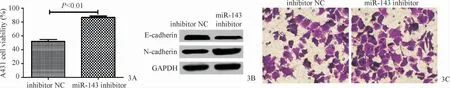
图3 下调miR-143促进A431细胞的增殖、侵袭及EMT 3A:MTT法检测下调miR-143对A431细胞增殖的影响;3B:Western blot实验检测下调miR-143对A431细胞EMT的影响;3C:Transwell检测下调miR-143对A431细胞侵袭的影响Figure 3 Down-regulation of miR-143 promotes proliferation,invasion and EMT of A431 cells.3A:The effect of downregulation of miR-143 on proliferation of A431 cells was detected by MTT assay;3B:The effect of down-regulating miR-143 on EMT of A431 cells was detected by Western blot assay;3C:Effect of down-regulation of miR-143 on A431 cell invasion was detected by transwell.
2.4 上调lncRNA UCA1通过miR-143促进A431细胞的增殖、侵袭及EMT
RT-qPCR结果显示,pcDNA-3.1(+)、pcDNA-UCA1组的UCA1表达量分别为1.19±0.86和2.46±1.27,二者比较差异有统计学意义(t=18.38,P=0.002)。pcDNA-UCA1+mimics NC组A431细胞增殖能力和侵袭数目明显高于pcDNA-3.1(+)+mimics NC组(t值分别 为20.98、23.27,P值均<0.01),pcDNA-3.1(+)+miR-143 mimics组细胞增殖能力和侵袭数目明显低于pcDNA-3.1(+)+mimics NC组(t值 分 别 为7.06、20.79,P值均<0.01),pcDNA-UCA1+miR-143 mimics组细胞增殖能力和侵袭数目明显高于pcDNA-3.1(+)+miR-143 mimics组(t值分别为16.72、6.03,P值均<0.01),见图4A、4B。与pcDNA-3.1(+)+mimics NC组相比,pcDNAUCA1+mimics NC组N-cadherin蛋白表达量明显上升(t=13.35,P=0.006),E-cadherin蛋白表达量明显下降(t=24.20,P=0.002),pcDNA-3.1(+)+miR-143 mimics组E-cadherin蛋白表达量明显上升(t=14.12,P=0.005),N-cadherin蛋白表达量明显下降(t=13.79,P=0.005);与pcDNA-3.1(+)+miR-143 mimics组相比,pcDNAUCA1+miR-143 mimics组N-cadherin蛋白表达量明显上升(t=30.14,P=0.001),E-cadherin蛋白表达量明显下降(t=23.48,P=0.002),见图4C。
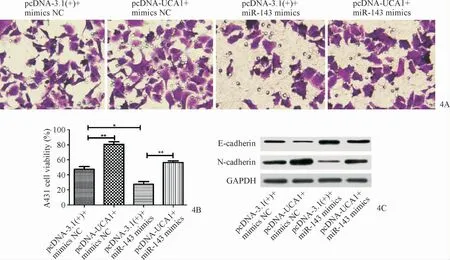
图4 上调lncRNA UCA1通过miR-143促进A431细胞的增殖、侵袭及EMT 4A:Transwell检测上调lncRNA UCA1通过miR-143对A431细胞侵袭的影响;4B:MTT法检测上调lncRNA UCA1通过miR-143对A431细胞增殖的影响;4C:Western blot实验检测上调lncRNA UCA1通过miR-143对A431细胞EMT的影响Figure 4 Upregulation of lncRNA UCA1 promotes proliferation,invasion and EMT of A431 cells through miR-143.4A:Transwell was used to assess the effect of upregulation of lncRNA UCA1 on A431 cell invasion through miR-143;4B:The effect of upregulation of lncRNA UCA1 through miR-143 on proliferation of A431 cells was detected by MTT assay;4C:Western blot was used to detect the effect of upregulated lncRNA UCA1 on EMT of A431 cells through miR-143.
2.5 miR-143与HK2之间的关系
利用TargetScan预测miR-143与HK2的结合位点结果见图5。与mimics NC+HK2 wt组相比,HK2 wt+miR-143 mimics组细胞的荧光素酶活性明显降低(t=18.38,P=0.003);与mimics NC+HK2 mut组(1.14±0.04)相比,HK2 mut+miR-143 mimics组(1.18±0.26)细胞的荧光素酶活性无明显变化(t=3.60,P=0.069)。RT-qPCR结果显示,miR-143 inhibitor组细胞内HK2表达量明显高于inhibitor NC组(2.13±0.45比1.06±0.28,t=22.15,P=0.002),miR-143 mimics组细胞内HK2表达量明显低于mimics NC组(0.29±0.37比1.13±0.45,t=19.79,P=0.003),表明miR-143与HK2之间具有负调控关系。
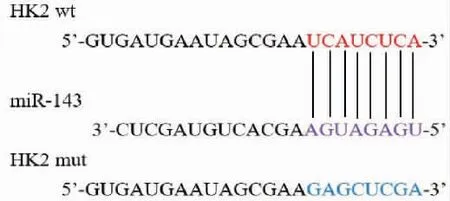
图5 预测miR-143与HK2之间的结合位点Figure 5 Prediction of binding sites between miR-143 and HK2.
2.6 下调HK2对A431细胞的增殖、侵袭及EMT的影响
RT-qPCR结果显示,A431细胞中的HK2表达量(2.36±0.47)高于HaCaT细胞(1.14±0.34),两者比较差异有统计学意义(t=26.31,P=0.001)。siRNA NC、HK2 siRNA组A431细胞中HK2表达量分别为1.06±0.38和0.32±0.27,两者比较差异有统计学意义(t=20.55,P=0.002)。
HK2 siRNA组A431细胞增殖能力明显低于siRNA NC组(t=8.90,P=0.012)。与siRNA NC组相比,HK2 siRNA组N-cadherin蛋白表达量明显降低(t=14.94,P=0.005),E-cadherin蛋白表达量明显上升(t=16.12,P=0.004);HK2 siRNA组细胞侵袭数目明显减少(t=13.79,P=0.005)。见图6A~6C。
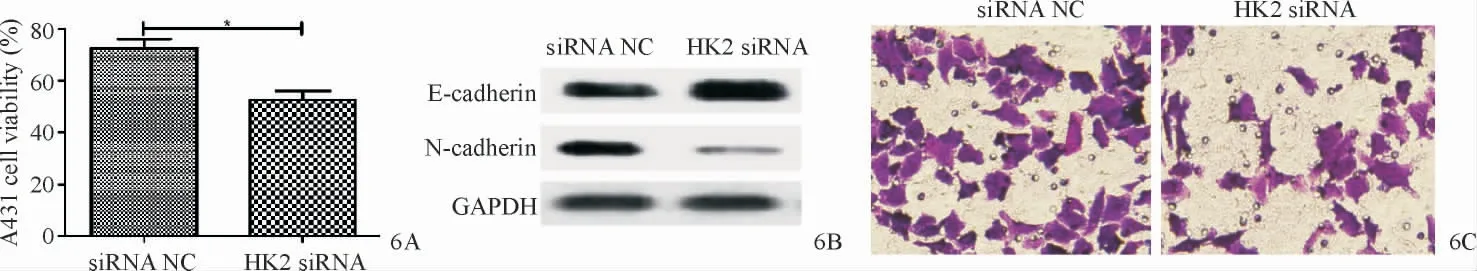
图6 下调HK2抑制A431细胞的增殖、侵袭及EMT 6A:MTT法检测下调HK2对A431细胞增殖的影响;6B:Western blot实验检测下调HK2对A431细胞EMT的影响;6C:Transwell检测下调HK2对A431细胞侵袭的影响Figure 6 Down-regulation of HK2 inhibits proliferation,EMT,and invasion of A431 cells.6A:The effect of down-regulation of HK2 on proliferation of A431 cells was detected by MTT assay;6B:Western blot was used to detect the effect of down-regulating HK2 on EMT of A431 cells;6C:The effect of down-regulating HK2 on the invasion of A431 cells was detected by Transwell.
2.7 lncRNA UCA1通过miR-143上调HK2表达
UCA1 siRNA+inhibitor NC组HK2表达量明显低于siRNA NC+inhibitor NC组(0.65±0.04比1.25±0.52,t=21.61,P=0.002);siRNA NC+miR-143 inhibitor组HK2表达量明显高于siRNA NC+inhibitor NC组(2.75±0.52比1.25±0.52,t=21.61,P=0.002);UCA1 siRNA+miR-143 inhibitor组HK2表达量明显低于siRNA NC+miR-143 inhibitor组(1.36±0.21比2.75±0.52,t=25.81,P=0.002)。
3 讨论
越来越多的报道显示,lncRNAs表达异常与包括CSCC在内的多种人类癌症的病理发展密切相关。如研究表明lncRNA XLOC_001659在食管癌组织中表达上调,敲除lncRNA XLOC_001659可抑制食管鳞癌细胞的增殖和侵袭[12]。lncRNA DLX6-AS1通过靶向miR-16-5p/NUCKS1调控CSCC细胞A431增殖、迁移和侵袭[13]。UCA1在癌症中是一个敏感、特异性的致癌lncRNA,在各种癌症中表达上调,UCA1的高表达参与了许多癌症的细胞侵袭和迁移,本研究结果与有关UCA1在胰腺癌细胞、骨肉瘤细胞、非小细胞肺癌等癌症中表达的研究结果一样[14-15],UCA1在CSCC组织和细胞中表达升高。UCA1的异常表达提示UCA1与CSCC的发展密切相关。EMT是一个很好的特征过程,它促进了人类癌症的侵袭和转移扩散。本研究结果显示,UCA1敲低能够抑制A431细胞的增殖和侵袭,导致E-cadherin升高,N-cadherin降低,而UCA1过表达导致相反结果。提示UCA1可能通过促进EMT来调节CSCC的晚期侵袭。
lncRNAs与miRNA相互作用,发挥miRNA海绵或抑制剂的作用,并调节对miRNA靶点的抑制。越来越多的报道表明,UCA1是一种致癌的lncRNA,它与肿瘤抑制miRNA如miR-507、miR-145、miR-16和miR-216b相互作用并抑制miRNA表达。基于miRanda和荧光素酶报告基因检测,可确定肿瘤抑制miR-143基因在UCA1中的结合位点的3'UTR。此外,研究结果显示,UCA1过表达在A431细胞中明显抑制miR-143的表达,下调UCA1明显上调了miR-143的表达。miR-143已被发现在多种癌症中抑制EMT和细胞侵袭,从而起抑癌作用包括脊髓胶质母细胞瘤、胃癌、膀胱癌和乳腺癌[16-17]。本研究结果表明,miR-143在CSCC组织和细胞中表达下调,下调miR-143明显促进A431细胞的增殖、侵袭和EMT,UCA1可能作为与miR-143竞争的内源性RNA,抑制miR-143表达,从而促进CSCC A431细胞的增殖、侵袭和EMT。提示miR-143作为肿瘤抑制基因和EMT的负调控因子发挥作用。因此,UCA1可能通过吸附上皮间质转化酶相关miRNA而发挥癌基因的作用。有研究表明HK2在各种癌症如胃癌、结直肠癌中发挥关键作用[18-19],而本研究结果表明HK2在A431细胞中表达下调,siRNA干扰HK2表达后明显抑制了A431细胞的增殖、侵袭和EMT。
综上所述,本研究证明了lncRNA UCA1通过激活miR-143/HK21通路促进CSCC的增殖、侵袭和EMT,这可能在CSCC A431细胞的病理中发挥重要的调节作用。

