生物传感器早期诊断假体周围关节感染△
柴啟浩,李 伟,,满振涛,,徐海伦,徐显兴
(1.山东大学附属省立医院骨关节科;2.山东第一医科大学附属省立医院骨关节科;山东济南250021)
人工关节置换术是治疗晚期髋关节和膝关节骨性关节炎的最成功和最常用的手术。它能明显改善患者的关节功能,且只有不到10%的患者在术后出现远期并发症[1]。由于人口老龄化和运动损伤的年轻患者数量日益增多,全球人工关节置换术的手术量也常年上升,其术后的并发症问题受到广泛重视。而术后并发症中最严重的是假体周围感染(periprosthetic joint infection,PJI),据文献数据统计,在初次全膝或全髋关节置换术后发生PJI的概率为1%~4%[2,3]。虽然PJI的发生率较低,但常引起患者预后不良,重者需要进行复杂的关节翻修术,既会降低患者的生活质量,又会给患者和社会造成巨大的经济负担[4]。PJI翻修术的死亡率显著高于无菌性翻修术和初次关节置换术,而且患者再次住院的风险也高[5]。所以,如何早期迅速准确诊断PJI一直是骨关节科的热点难题。目前,PJI的诊断方法有血清学诊断、关节液生物标记物检测及细菌培养等,其中血清学诊断主要检测血清中血沉、C反应蛋白等炎症因子,但其特异性不高。有不少文献报道如α-防御素、白细胞介素、乳铁蛋白等关节液生物标记物对PJI有较高的诊断价值[6~8]。但是,对于PJI的早期诊断来说,其敏感性略显不足。最近,电化学生物传感器因特异性高、检测速度快、费用较少等优点在细菌检测领域受到研究者广泛重视[9]。
1 PJI的诊断标准
目前被医疗界广泛接受的PJI诊断标准是由骨与肌肉感染协会提出并经2013年国际共识会议(Inter⁃national Consensus Meeting,ICM)修订的专家指南(表1)[10]。然而,该指南仍存有不足:如各项指标的权重并未区分,类似于窦道的发现与病理切片的高倍镜观察与计数等诊断指标的判断都存在一定的主观性。同时,随着医学上对PJI理解的深入以及检测手段的发展,2013年PJI诊断标准的时效性有必要进一步提高。因此,2018年Parvizi等[11]提出了一种基于评分系统的PJI新定义。随后,ICM也基于此新定义制定了PJI的最新诊断标准(表2)。新诊断标准增加了D-二聚体、α-防御素等新检测指标,同时赋予了次要标准中各个指标一定的分值,然后采用累计总分制来诊断PJI。然而,新诊断标准中的两项主要标准并没有改变。由此可见,PJI的病原菌检测是极为重要的。
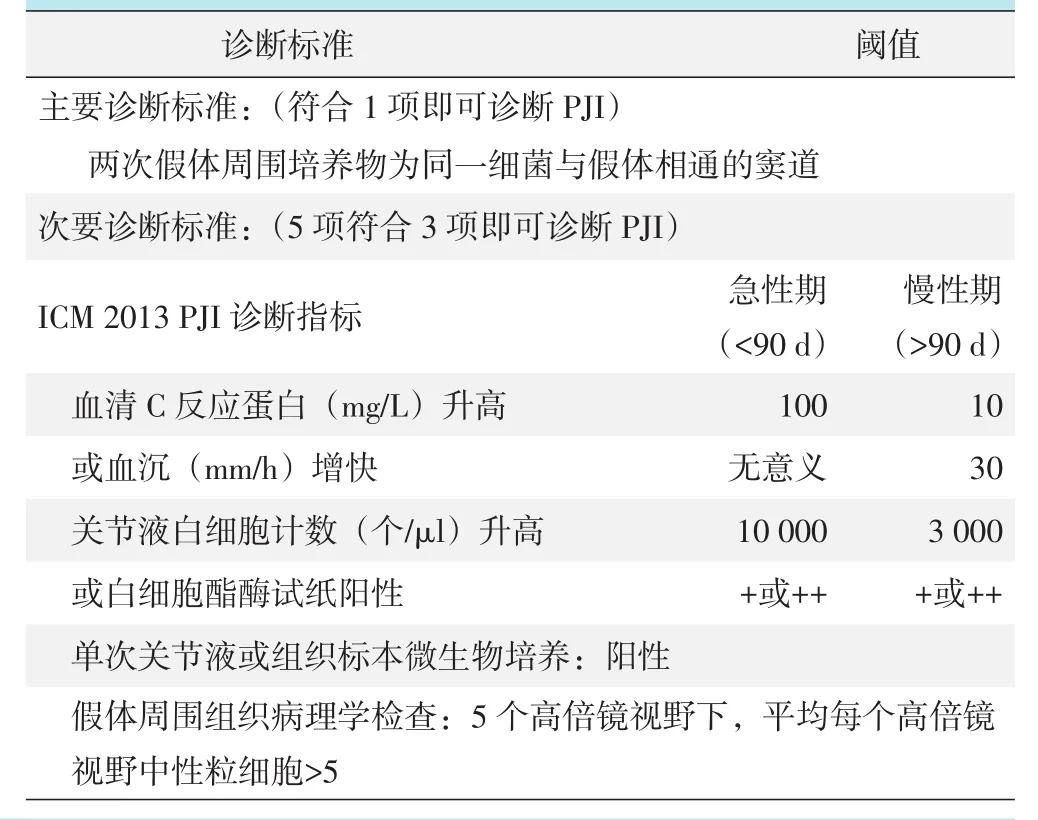
表1 ICM 2013 PJI诊断标准及诊断阈值

表2 ICM 2018 PJI新诊断标准及诊断阈值
2 PJI目前常用的诊断方法
检测血清中C反应蛋白和血沉等血清学指标是PJI的经典诊断方法。关节置换术后三个月C反应蛋白和血沉升高,尤其是C反应蛋白的升高,常常提示有感染的可能。但血沉和C反应蛋白是非特异性炎性指标[12],当机体存在其他部位感染或患有风湿免疫系统疾病时,则会干扰PJI的诊断。Pérezprieto等[13]研究指出,类似于血沉和C反应蛋白之类的非特异性血清学指标,尤其在诊断低毒性和慢性PJI方面,其诊断价值可能不大,而且误诊率较高。α-防御素是近年来研究较热的一项关节液生物标记物,同时也是2018年ICM新标准中新增的次要标准之一。有研究表明α-防御素的敏感性和特异性均高于血沉和C反应蛋白[14],而且不受炎性疾病的干扰[15],但其单独用于PJI的快速诊断时,可能会出现假阳性和假阴性[16],并且费用较高,每次检测需760美元[17]。影像学检查如X线片、CT、MRI等也是PJI诊断中不可或缺的方法,但常常需要结合临床表现和其他检查综合判断才能发挥作用。由于PJI的复杂性,单一的诊断方法往往无法快速准确地做出诊断。然而,不论是2013年还是2018年的ICM诊断标准,受累关节两次假体周围培养物为同一细菌都是PJI的主要诊断标准。因此,研究高特异性、高敏感性的细菌检测方法成为重中之重。
3 PJI的病原菌分布
了解PJI的病原菌分布,可以为其细菌检测提供好的方向。相关文献报道,PJI的病原菌分布从高到低依次是凝固酶阴性葡萄球菌、金黄色葡萄球菌、混合菌群、链球菌、革兰阴性菌、肠球菌和厌氧菌[18,19]。但不同国家和地区之间,致病菌的分布或许存在差异,如一项欧洲和美国骨科中心的研究显示,在美国,PJI的首位致病菌是金黄色葡萄球菌,其在膝关节PJI中占29.60%,在髋关节PJI中占32.6%,而欧洲PJI的首位致病菌则是凝固酶阴性葡萄球菌,其在膝关节PJI中占37.0%,在髋关节PJI中占40.7%[20]。国内彭慧明等[21]对 2014~2016 年北京市 9家医院的318例PJI患者的病原菌做了统计,结果显示革兰阳性菌209例(65.7%),革兰阴性菌29例(9.1%),真菌10例(3.1%),非结核分枝杆菌3例(0.9%),培养阴性72例(22.6%),这与陈志[22]的研究大致相同。由此可见,国内外的PJI患者的致病菌大都以革兰阳性菌为主,尤其是金黄色葡萄球菌。
4 电化学生物传感器的应用现况
4.1 电化学生物传感器的概述
电化学生物传感器具有检测快速、特异性高等特点,从而成为一种较为理想的快速检测体系[23]。而阻抗型电化学传感器因其具有无标记检测、检测速度快、可以微型化等特点备受关注[24]。阻抗型生物传感器可在其电极表面固定如抗菌肽、抗体、核酸等特异性受体,因为细菌具有绝缘性,待细菌识别受体并与之结合后,电极表面的电阻将会增加从而导致电流减小,所以可以利用这种阻值的变化来检测细菌。为了形象地反映电极表面阻值的变化情况,常使用电化学阻抗谱技术[25]。利用此技术来检测细菌常通过以下2种方式进行:(1)检测细菌在电化学池中产生的代谢产物所引起溶液电导率的变化;(2)检测目标细菌与电极表面受体相互作用所引起的阻抗变化。
4.2 阻抗型电化学生物传感器的细菌检测应用
Laczka等[26]制作了一种基于叉指电极阵列(in⁃terdigitated electrode array,IDEA)的阻抗型电化学传感器,他们通过在叉指电极上固定大肠杆菌的特异性抗体来检测大肠杆菌。结果显示,这款传感器在40分钟就检测出了大肠杆菌,检出限为103cells/ml,而对照组使用酶联免疫吸附测定法所测得的最低浓度为105cells/ml。但是,此实验的结果是在磷酸盐缓冲液中得到的,未在真实样品中进行。2011年,Bratov等[27]发明了一种3D-IDEA阻抗型传感器,其通过在叉指电极的每个电极之间用二氧化硅绝缘隔开,使该传感器的灵敏度大大提升。随后,Hoyosnogrés等[28]用这种传感器来检测口腔种植体周围炎症中最重要的致病菌血链球菌,他们在电极表面固定hLf1-11抗菌肽,这种抗菌肽对血链球菌有显著的抑菌作用,然后分别在KCL溶液和人工唾液中检测该传感器对血链球菌的检出限。结果显示,检出限分别为3.5×10 CFU/ml(KCL溶液)和8.6×102CFU/ml(人工唾液)且仅用了1 h,此传感器有望用于口腔种植体感染的早期诊断。Broseloliu等[29]也用3D-IDEA阻抗型传感器检测了大肠杆菌O157:H7,他们在电极表面固定高度特异识别大肠杆菌O157:H7外膜蛋白的DNA适配体,最后仅用30 min就检测出了磷酸盐缓冲液中的大肠杆菌,检出限为2.9×102CFU/ml,而且该传感器可重复使用。Jijie等[30]研发的电化学生物传感器,可检测尿路感染的致病菌大肠杆菌UT189。他们将大肠杆菌UT189的特异性抗体固定在由还原性氧化石墨烯/聚乙烯亚胺薄膜修饰的金电极表面,该传感器的检出限为10 CFU/ml(水样品),而且在血清和尿液样品中,该传感器的电化学信号与水样品中的趋势相同,显示了其作为尿路感染一项诊断手段的可能性。以上研究表明阻抗型电化学生物传感器在细菌检测方面具有良好的应用前景,然而尚未发现将该技术应用于PJI的细菌检测中,未来仍需要进一步研究。
5 小结与展望
总之,PJI作为关节置换术后最严重的并发症,目前仍缺乏一种高效的方法来对其进行早期快速的诊断。然而,除了观察到存在与假体相通的窦道之外,两次假体周围培养物为同一细菌仍是ICM对于PJI的定义中至今未变的主要标准,由此可以看出细菌检测或许可以成为PJI诊断的“金标准”。常规的细菌检测技术,如细菌培养、生化测定等,既缺乏足够的灵敏度和特异性,又十分耗时。聚合酶链式反应虽然可以进行快速分析,但也存在复杂的引物设计、费用较高等劣势。酶联免疫吸附测定法可用于大批样品的定性及半定量分析,具有检测迅速、特异性高等特点,然而,样品收集及操作过程易受污染,一般用于科研研究。综上所述,电化学生物传感器拥有费用低、检测快、特异性高、检出限低等优势,而且已在口腔种植体周围炎、尿路感染以及其他领域开展了相关致病菌的快速检测。目前还尚无针对关节PJI方面的生物传感器,未来可以研发PJI每个致病菌的特异性生物传感器,这或将成为PJI早期快速诊断的有力工具。

