携带MYH7或MYBPC3基因突变的肥厚型心肌病患者心肌组织比较蛋白质组学研究
王庆尧 祁琳 陆敏杰 张禅那 王继征 赵鹏
(1 青岛大学基础医学院,山东 青岛 266071; 2 青岛大学附属医院病理科; 3 中国医学科学院阜外医院心血管疾病国家重点实验室)
肥厚型心肌病(HCM)是一种常见的遗传性心血管疾病,在我国患病率约为80/10万[1]。HCM患者临床表现异质性较大,可表现为无明显症状、胸痛、心悸、晕厥和心源性猝死等[2]。目前认为,HCM是导致青年人或者运动员发生心源性猝死的首要原因[2]。现已经报道近30种基因与该疾病的发病相关[3],其中主要的两个致病基因为β-肌球蛋白重链 (MYH7)基因以及肌球蛋白结合蛋白 (MYBPC3) 基因,目前在HCM阳性突变患者中的检出率约为80%[4]。MYH7基因编码的蛋白在心肌细胞舒张和收缩过程中发挥着重要作用[5];MYBPC3基因编码的蛋白在维持心肌细胞结构和功能中扮演重要角色[6]。临床研究表明,MYH7基因突变的HCM患者比MYBPC3基因突变的HCM患者左心室流出道梗阻的发生率较高,发病年龄也较早[7]。另有研究表明MYH7基因突变的HCM患者临床表型更重,预后较差[8]。两种基因突变所致的HCM患者临床表型存在较大差异,但具体的分子机制尚不明确。本研究通过检测MYH7基因突变的HCM患者和MYBPC3基因突变的HCM患者心肌组织中蛋白表达谱的差异,探讨两种基因突变所致HCM患者临床表型差异的可能原因。
1 对象与方法
1.1 研究对象
选取2012年6月—2018年5月于中国医学科学院阜外医院行改良扩大Morrow术治疗的HCM患者。诊断标准为超声心动图显示左室壁或室间隔的最大厚度≥15 mm;排除标准为心肌继发性肥厚(如由主动脉狭窄、高血压等引起)、HCM拟表型或明显伴随其他疾病的患者[9]。HCM患者入院时采集外周血进行基因检测,根据携带致病突变基因的不同,分为MYH7组(仅携带MYH7基因突变的患者)33例和MYBPC3组(仅携带MYBPC3基因突变患者)30例。收集所有HCM患者手术过程中切除的心肌组织。本研究通过了中国医学科学院阜外医院伦理委员会审查,所有患者均签署知情同意书。
1.2 定量蛋白质组学分析
将所有HCM患者的心肌组织分别在液氮中研磨成粉末,加入组织裂解缓冲液裂解,然后使用超声波进行充分裂解,离心后使用BCA试剂盒对蛋白浓度进行测定。吸取上述分离到的蛋白20 μg进行聚丙烯酰胺凝胶电泳,并进行考马斯亮蓝染色。然后对提取出的蛋白质溶液进行肽段酶解,再应用Strata X C18(Phenomenex)进行脱盐处理,真空干燥。加入0.5 mmol/L TEAB溶解肽段,加入乙腈溶解的TMT标记试剂室温孵育2 h。将标记后的肽段在高pH条件下进行反向HPLC分级,选用Agilent 300Extend C18色谱柱,而后将肽段合并为18个组分,并对每一个组分分别进行真空冷冻干燥处理后,溶解于体积分数0.001的甲酸水溶液中,于超高效液相系统EASY-nLC 1000中分离肽段。分离后的肽段注入NSI离子源中电离后,使用Q ExactiveTMPlus质谱进行分析。将上面得到的二级质谱数据使用Maxquant (v1.5.2.8)在SwissProt人类数据库(20 317条序列)中进行检索。实验重复3次,取每种蛋白表达水平的平均值。
1.3 心肌组织中差异表达蛋白的筛选
将MYBPC3组与MYH7组患者心肌组织中蛋白表达水平的比值作为两组之间蛋白的差异表达量,取log2使数据符合正态分布,采用双样本双尾t检验方法推算P值。以P<0.05且差异表达量>1.2作为显著上调的阈值,以P<0.05且差异表达量<0.83作为显著下调的阈值。
1.4 心肌组织中差异表达蛋白的生物信息学分析
分别使用基因本体论(GO)数据库和KEGG数据库对差异表达蛋白进行GO富集分析和KEGG通路富集分析。再利用STRING数据库(version 11.0)对差异表达蛋白进行蛋白相互作用分析。
2 结 果
2.1 两组患者心肌组织中蛋白质的鉴定与差异表达情况
将所有患者心肌组织蛋白质裂解提取后,经电泳和考马斯亮蓝染色后显示,蛋白条带清晰、无降解,相对分子质量为10 000~200 000。所有患者的心肌组织中共鉴定到3 723种蛋白,两组患者心肌组织中显著差异表达的蛋白共有39种(图1),与MYH7组相比较,MYBPC3组患者心肌组织中15种蛋白表达上调,24种蛋白表达下调。表达上调的15种蛋白分别为驱动蛋白家族成员3B(KIF3B)、ATP合酶F(0)复合体C1亚基(ATP5G1)、内黏蛋白(EMCN)、多剪接RNA结合蛋白2(RBPMS2)、蛋白激酶Cδ亚型(PRKCD)、Ⅺ型胶原α1链(COL11A1)、EMILIN-1、LRRFIP2蛋白、软骨中间层蛋白1(CILP)、不活跃磷脂磷酸酶7(PLPP7)、辅酶Q10B(COQ10B)、EMILIN-3、蛋白酶体组装伴侣2(PSMG2)、蛋白酶体抑制剂PI31亚基(PSMF1)及琥珀酸脱氢酶复合体组装因子2(SDHAF2)。表达下调的24种蛋白分别为三联组氨酸核苷酸结合蛋白2(HINT2)、免疫球蛋白λ变体2-8(IGLV2-8)、ATP合酶亚基S(ATP5S)、Rap1 GTPase激活蛋白2(RAP1GAP2)、血管紧张素转换酶2 (ACE2)、小核核糖核蛋白多肽N(SNRPN)、二氢嘧啶样蛋白3(DPYSL3)、蛋白质透明同源物1 (DIAPH1)、AGFG1蛋白(AGFG1)、组蛋白PARylation因子1(HPF1)、核糖体蛋白L34(RPL34)、EH结构域结合蛋白1样蛋白1(EHBP1L1)、CCR4-NOT转录复合体亚基1(CNOT1)、真核生物翻译起始因子2亚基2(EIF2S2)、破骨细胞刺激因子1(OSTF1)、细胞周期控制蛋白A(TMEM30A)、免疫球蛋白重链变体5-51(IGHV5-51)、前胶原-赖氨酸,2-酮戊二酸5-双加氧酶1(PLOD1)、补体C9、免疫球蛋白δ重链、囊泡相关膜蛋白5(VAMP5)、清道夫受体家族F类成员1(SCARF1)、核糖体蛋白L29(RPL29)、内聚蛋白亚基SA-2(STAG2)。
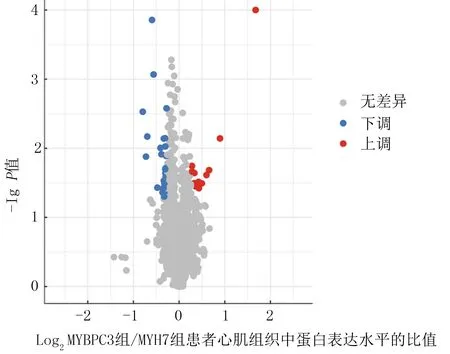
图1 与MYH7组相比MYBPC3组中蛋白表达水平分布火山图
2.2 两组患者心肌组织中差异表达蛋白的GO富集分析结果
对两组患者的所有39种差异表达蛋白质进行GO富集分析,结果显示差异表达蛋白的分子功能方面主要富集在Rho GTPase绑定、细胞外基质结构成分和SH3结构域绑定方面;细胞成分方面主要富集在质子运输ATP合酶复合物、蛋白质的细胞外基质和胶原蛋白三聚物上;生物学过程主要富集在膜脂分布的调节、B细胞介导免疫和肌细胞分化的负调控等方面。
2.3 两组患者心肌组织中差异表达蛋白的KEGG通路富集分析结果
KEGG通路富集分析结果显示,39种差异表达蛋白主要富集于蛋白质体内消化吸收通路和糖尿病并发症AGE-RAGE信号通路2条通路中。其中在蛋白质消化吸收通路当中,COL11A1表达量上调, ACE2表达量下调;在糖尿病并发症AGE-RAGE信号通路中,DIAPH1表达量下调,PRKCD表达量上调。将表达量上调以及下调的蛋白分别导入KEGG数据库进行通路富集分析,结果显示未能富集到任何通路。
2.4 两组患者心肌组织中差异表达蛋白的相互作用分析结果
STRING分析结果显示,39种差异表达蛋白中有28种蛋白与其他蛋白之间无相互作用关系,其余11种蛋白分别在4种功能网络中表现有相互作用关系(图2)。图中圆圈代表差异表达蛋白,圆圈之间的线条表示蛋白之间的路径映射,可见蛋白之间路径映射数量较少。
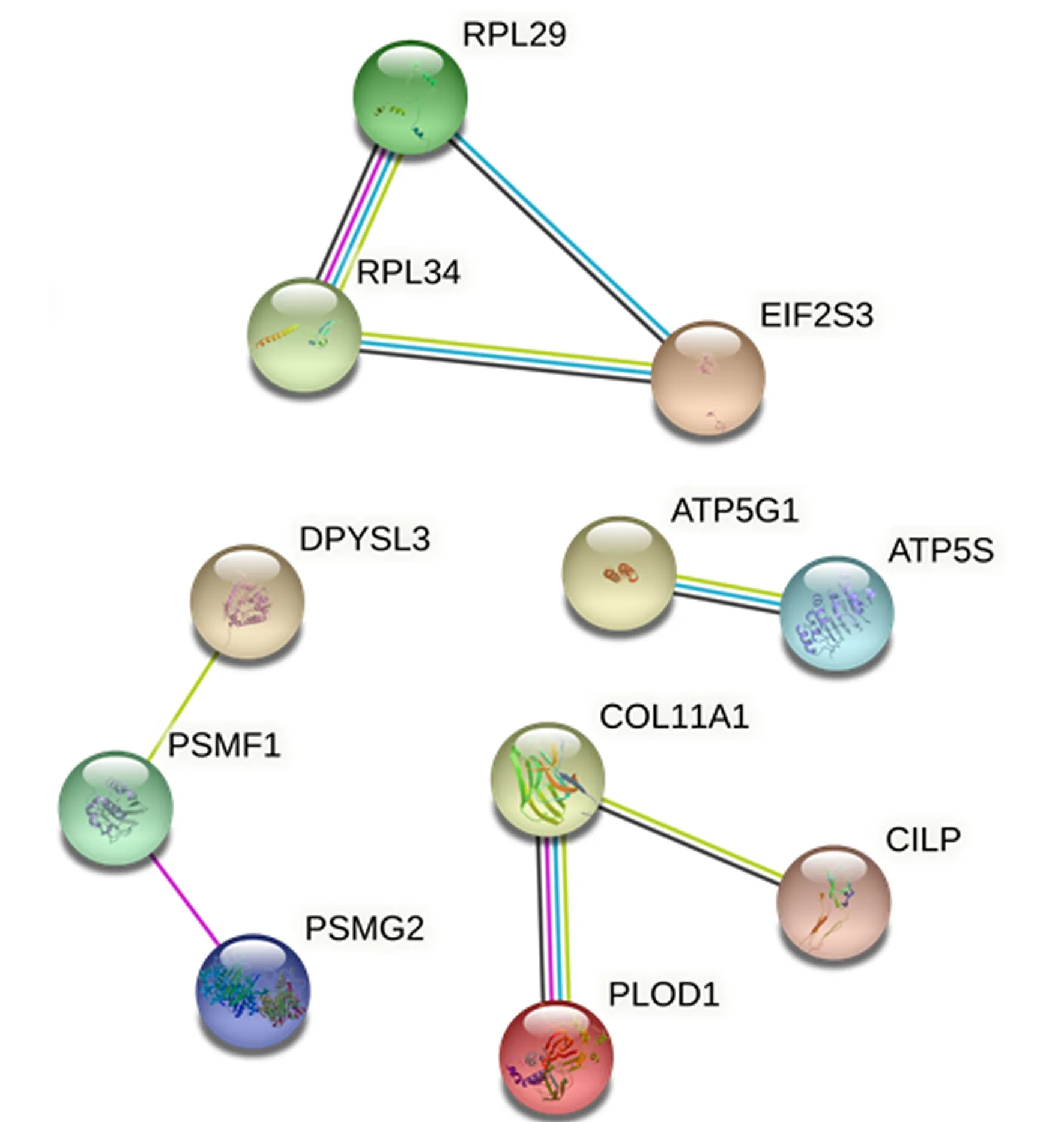
图2 两组中差异表达蛋白相互作用分析图
3 讨 论
蛋白质组学技术可以综合分析蛋白质各个方面的生物学特性,包括明确蛋白质的功能和蛋白质之间的相互作用关系,确定蛋白质在细胞中的定位以及翻译后修饰水平[10]。与基因组学“静态分析”的特点相比,蛋白质组学的研究对象为数量巨大且呈动态变化的蛋白质表达谱,可以分析复杂的蛋白质相互作用网络以及可以更加系统地挖掘疾病的复杂致病机制[11-12]。目前,蛋白质组学技术已经在多种疾病的研究中得到广泛应用[13-15]。
SCHULDT等[16]对HCM患者的心肌组织进行蛋白质组学分析,结果发现HCM患者心肌组织中总α-微管蛋白和去酪化微管蛋白水平明显高于正常健康心肌组织,提示微管的变性参与了HCM的发病机制。COATS等[9]也通过蛋白质组学技术鉴定出151种正常组与HCM组的心肌组织差异表达的蛋白,这些差异表达蛋白主要参与了肌肉收缩、钙调节和氧化应激等过程。虽然蛋白质组学研究为探究HCM致病机制提供了科学证据,但是携带不同致病基因突变的HCM患者心肌组织蛋白质表达谱是否存在差异尚缺乏科学数据。
本研究首先提取MYH7和MYBPC3基因突变HCM患者心肌组织的总蛋白,经电泳和考马斯亮蓝染色后显示,蛋白条带清晰、无降解,条带分布范围广,说明提取到的蛋白符合后续蛋白质组学分析的实验要求。对总蛋白进行蛋白质组学分析后,共鉴定出3 723种蛋白,再从中筛选出差异表达的蛋白39种,约占所有定量蛋白数量的1%,说明两种不同基因突变的HCM患者心肌组织中差异表达蛋白数量较少。39种中有15种差异蛋白表达上调,其中KIF3B上调的倍数最高,该蛋白在有丝分裂过程中负责囊泡运输和膜扩张,从而调节细胞的迁移[17];EMCN与EMILIN-1在促进肿瘤新生血管的生长和稳定中发挥重要作用[18-19];RBPMS2参与心脏发育过程,还能起到调节心肌细胞分化的功能[20];EMILIN-3蛋白参与成骨细胞的增殖与迁移[21];PRKCD是调控细胞增殖以及凋亡的蛋白激酶[22];LRRFIP2蛋白主要地参与调控炎症反应;PSMF1参与构成蛋白酶体抑制物,能够发挥抑制多肽降解的作用[23]。但是,通过对所有表达量上调和下调的蛋白分别进行KEGG通路富集分析,结果显示均未能富集到任何通路,提示这些蛋白功能各不相同,蛋白之间可能无明确相互作用关系。STAG2是表达量下调倍数最高的蛋白,其主要参与构成内聚蛋白复合物,是DNA复制后染色单体内聚所必需的复合物,同时参与有丝分裂期间纺锤体的组装;RPL29可以调控新生血管的形成。STRING分析结果显示差异表达蛋白之间路径映射数量少,提示MYH7组与MYBPC3组之间差异表达蛋白相互作用关系较弱。
在差异表达蛋白相互作用分析图中, ATP5G1和COL11A1与其他蛋白之间的路径映射数量相对较多。ATP5G1是构成ATP合酶的重要组成部分,在线粒体能量产生过程中发挥重要作用。当心肌发生缺血再灌注损伤时,ATP5G1表达量升高,导致ATP合酶功能紊乱,使得心肌细胞出现能量代谢异常,进而影响心肌细胞正常功能。本研究的结果显示ATP5G1蛋白表达量上调,提示ATP5G1表达量的变化可能与两组HCM患者临床表型差异有关。COL11A1在肿瘤细胞的增殖、迁移以及侵袭过程中扮演重要角色,且有研究表明COL11A1蛋白表达量升高往往导致预后不佳[24]。本研究结果显示,与MYH7组相比MYBPC3组中COL11A1蛋白表达量上调,提示COL11A1可能与两组HCM患者预后有关。研究发现,不同致病基因突变的HCM患者心肌组织中肌节蛋白表达水平一致,表明基因型不同的HCM患者肌节蛋白的表达谱是一致的[25]。本研究显示,两组HCM患者心肌组织差异表达蛋白数量较少,而且差异表达蛋白之间缺乏明确相互作用关系,提示两组HCM患者心肌组织蛋白表达谱差异较小。
综上所述,携带MYH7或MYBPC3基因突变的HCM患者间表达水平发生显著改变的蛋白数量较少,蛋白质表达谱差异较小;其中ATP5G1和COL11A1蛋白可能与两者不同临床表型有关。

