局部晚期非小细胞肺癌患者脾区低剂量放疗联合胸部三维适形放疗的效果研究
刘睿 尚庆军 姜韬 梁东海 姜鹏 周非 陈爱霞 厉彦子 于洪升
(青岛大学附属医院肿瘤放疗科,山东 青岛 266003)
据2018年统计数据显示,肺癌是癌症死亡的主要原因之一,在肺癌死亡的患者中非小细胞肺癌(NSCLC)约占80%[1]。由于肺癌早期无明显临床症状,大多数患者确诊时已经是晚期。局部晚期NSCLC只有部分ⅢA期患者可行手术治疗,大部分患者需进行放化疗联合治疗。而放化疗过程中的各种不良反应,特别是Ⅲ、Ⅳ级不良反应,会导致治疗暂停,严重影响治疗效果。研究发现,低剂量照射(LDR)具有诱导兴奋和适应性反应的功能,从而增强机体的免疫功能和抑制肿瘤生长[2-3]。在鼻咽癌和食管癌患者中进行脾区LDR联合常规放疗的临床试验结果显示,联合脾区LDR能够减轻患者常规放疗造成的免疫功能的抑制[4-5]。但脾区LDR在NSCLC患者的治疗中未曾涉及,本研究通过对局部晚期NSCLC患者脾区LDR联合胸部三维适形放疗与单纯胸部三维适形放疗的近远期疗效及不良反应观察,探讨脾区LDR联合胸部三维适形放疗治疗局部晚期NSCLC的效果及对患者预后的影响,为临床治疗提供数据支持。
1 资料与方法
1.1 一般资料
选取2011年7月1日—2014年7月1日于我院确诊为ⅢA、ⅢB期(据2011年NCCN分期标准)的NSCLC患者60例。纳入标准:①之前无手术或放疗史;②患者年龄18~75岁,美国东部肿瘤协作组(ECOG)体力状况评分为0或者1分;③实验室检查标准:白细胞计数≥3.5×109/L,中性粒细胞计数≥1.5×109/L,血红蛋白≥90 g/L,血小板计数≥100×109/L,肌酐清除率≥50 mL/min,谷丙转氨酶和谷草转氨酶低于正常值上限的2.5倍,总胆红素低于正常值上限的1.5倍;④心电图检查正常;⑤患者能遵从治疗和随访。排除标准:①有生育计划或处于孕期、哺乳期的患者;②合并有急性感染、严重肺部疾病或其他严重病症者;③有免疫系统相关疾病者。根据治疗方案不同,将患者分为联合治疗组(联合组)和对照组各30例。对照组男25例,女5例;平均年龄(59.00±8.52)岁;有吸烟史者21例;腺癌13例,鳞癌9例,大细胞癌5例,腺鳞癌3例;临床分期ⅢA期16例,ⅢB期14例。联合组男23例,女7例;平均年龄(59.08±11.06)岁;有吸烟史者23例;腺癌15例,鳞癌8例,大细胞癌3例,腺鳞癌4例;临床分期ⅢA期13例,ⅢB期17例。两组患者性别、年龄、吸烟史及病理类型、分期方面比较差异均无显著性(P>0.05)。本研究经青岛大学伦理委员会审核通过,试验研究严格按照赫尔辛基宣言关于人类临床试验标准的要求进行,所有患者入组前均签署知情同意书。
1.2 治疗方法
所有患者根据NCCN指南进行根治性同步放化疗。根据病理类型选择合适的化疗方案,共进行4~6个周期。放疗采用全套美国瓦里安公司放疗设备,射线选择6MV-X线,胸部三维适形放疗的靶区设计均符合NCCN指南所推荐的治疗标准,每次1.8~2.0 Gy,每周放疗5次,共计放疗30~33次,95%剂量线包全计划靶区,总剂量为60~66 Gy,6周左右完成(图1A)。脾区LDR采用特殊低熔点铅挡块调整剂量率为1.5 cGy/min,每次7.5 cGy,每周放疗2次,共进行放疗12~13次,总量为90~105 cGy(图1B),直至胸部三维适形放疗结束,6周左右完成。于每周一、周四胸部三维适形放疗前6 h行脾区LDR(图1C)。联合组患者行脾区LDR联合胸部三维适形放疗,对照组患者行胸部三维适形放疗方案。
1.3 观察指标及评估标准
采用美国BECKMAN COULTER公司流式细胞仪检测两组患者放疗前后的外周血T淋巴细胞亚群,包括CD4+T淋巴细胞百分数、CD8+T淋巴细胞百分数、CD4/CD8比值及NK细胞百分数。治疗过程中,每周检测一次血常规评估患者是否出现骨髓抑制及程度。采用日本Sysmex公司五分类血细胞计数仪测定患者外周血白细胞、中性粒细胞、血红蛋白及血小板数量。记录两组患者放疗不良反应的症状、出现的例数与程度及出现不良反应时的胸部三维适形放疗的累积放疗剂量。不良反应程度分级参考美国肿瘤放射治疗协作组(RTOG)标准,分为Ⅰ~Ⅱ和Ⅲ~Ⅳ级[6]。所有患者在放疗结束后1个月内行CT扫描,评估近期治疗效果。近期疗效根据RECIST 1.0标准评价[7],分为完全缓解(CR)、部分缓解(PR)、病灶稳定(SD)、病情进展(PD)。其中治疗有效率(RR)为CR和PR的患者占所有患者的比例。分别统计患者无进展生存期(PFS)和总生存期(OS)。所有患者每2~3个月随访1次,随访时间截至2019年12月31日或患者死亡,采用门诊问诊或者电话方式随访。
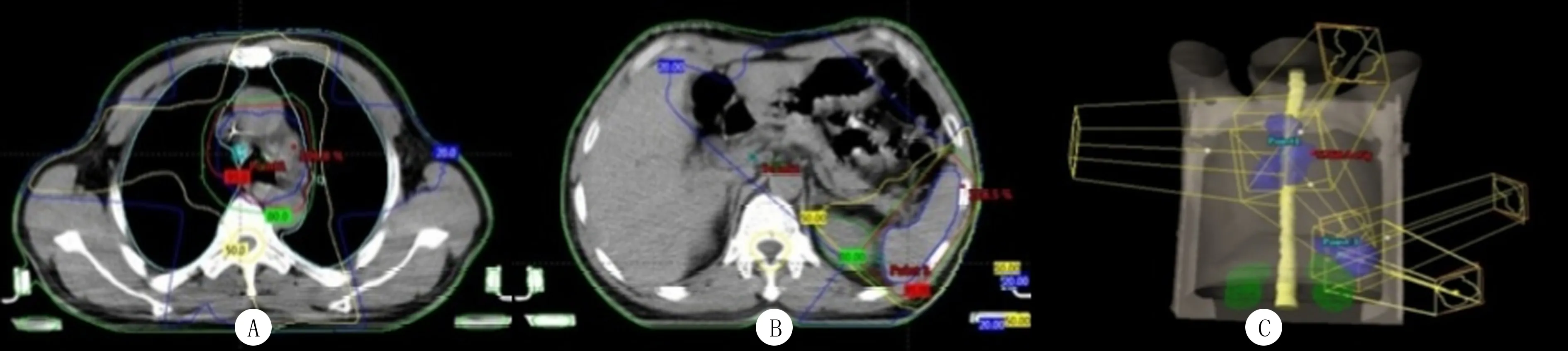
A:胸部放疗靶区二维示意图,B:脾脏放疗靶区二维示意图,C:胸部及脾脏放疗靶区三维示意图图1 两组患者胸部和脾脏放疗靶区示意图
1.4 统计学处理
使用SPSS 21.0软件进行数据的统计分析,组间计数资料比较应用χ2检验,计量资料比较采用t检验,患者生存情况采用Kaplan-Meier法分析,并进行Log-rank法检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者放疗前后淋巴细胞亚群数量比较
与放疗前相比较,仅对照组患者放疗后外周血中CD4+T淋巴细胞百分数、CD4/CD8比值和NK细胞百分数均显著降低,CD8+T淋巴细胞百分数显著升高(t=-18.438~11.002,P<0.05);两组患者上述指标放疗前后的差值比较,差异均具有显著意义(t=-4.783~5.530,P<0.05)。见表1。

表1 放疗前后两组患者淋巴细胞亚群数量的比较
2.2 两组患者急、慢性不良反应及累积剂量比较
两组患者在放疗和随访期间均无放疗相关性死亡。两组患者在放疗期间均发生不同程度的急性放射性肺炎、急性放射性食管炎、急性放射性皮炎、骨髓抑制、胃肠道反应等急性不良反应,其中Ⅰ~Ⅱ级不良反应的发生情况,对照组21例,联合组28例,Ⅲ~Ⅳ级不良反应的发生情况,对照组9例,联合组2例,两组比较差异具有显著性(Uc=2.300,P<0.05)。对照组患者放疗过程中出现放射性肺炎、放射性食管炎和Ⅲ~Ⅳ级骨髓抑制时的胸部三维适形放疗累积放疗剂量分别为(39.61±2.46)、(30.40±2.39)、(25.33±3.37)Gy,联合组分别为(43.25±2.86)、(37.53±3.15)、(33.63±2.36)Gy,两组上述3种情况下的放疗累积剂量比较差异均具有显著意义(t=2.460~3.690,P<0.05)。随访期间,两组患者均发生了放射性肺损伤、食管损伤及Ⅲ~Ⅳ级骨髓抑制等慢性不良反应,其中对照组8例,联合组2例,两组比较差异有显著性(χ2=4.320,P<0.05)。
2.3 两组患者的近期疗效评估
对照组患者达CR、PR、SD、PD分别为0、15、13、2例,联合组分别为0、23、7、0例。对照组RR为50.00%,联合组为76.67%,两组患者RR比较,差异有显著性(Uc=1.870,P<0.05)。
2.4 两组患者的生存及随访情况比较
对照组和联合组患者的中位随访时间分别为36.3、38.0个月,中位PFS分别为10.5、14.6个月,两组患者中位PFS比较差异有显著性(χ2=3.967,P<0.05)。对照组1、3以及5年的生存率分别为73.3%、40.0%、26.7%,联合组分别为76.7%、50%、36.7%,两组比较差异无显著性(P>0.05)。对照组患者中位OS为27.3个月,联合组为30个月,两组比较差异无显著性(P>0.05)。随访过程中,对照组患者出现局部复发9例,远处转移13例(4例脑转移,4例肝转移,5例骨转移),局部复发+远处转移7例,联合组出现局部复发10例,远处转移12例(4例脑转移,2例肝转移,6例骨转移),局部复发+远处转移7例。
3 讨 论
目前,根治性同期放化疗是不能手术的局部晚期NSCLC患者的一线治疗方案,但常规的胸部三维适形放疗和调强放疗产生的放疗不良反应,尤其是Ⅲ、Ⅳ级放疗不良反应常会导致放化疗暂停,影响疗效。另外,高剂量的放疗还会对机体产生免疫抑制,不仅使肿瘤缩小程度减慢,还会增加复发、转移的风险[7]。LDR是指20 cGy以内的低线性能量转移辐射,或5 cGy以内的高线性能量转移辐射,同时剂量率小于0.005 cGy/min的各种照射[8]。动物实验显示,预先行脾脏LDR可对免疫系统产生有益影响[9]。全身LDR可以保护机体免疫系统免受伤害,使脾脏细胞中的淋巴细胞和免疫因子显著高于局部LDR照射组和对照组,并能在一定程度上控制肿瘤发展[10]。提示LDR可通过激活机体的免疫系统来控制肿瘤发生、发展,而且脾脏是LDR对免疫系统影响的主要靶器官。在脾区LDR联合鼻咽癌常规放疗和食管癌常规放疗的临床试验中发现,脾区LDR可以明显减轻常规放疗对机体的免疫抑制作用[4-5]。但是在NSCLC患者的治疗中无相关试验,因此我们开展了临床试验,初步探索脾区LDR联合胸部三维适形放疗对局部晚期NSCLC的效果及其机制,为现有治疗方式提供补充。
外周血淋巴细胞亚群的变化能够反映机体的免疫状态,预估肿瘤的复发、转移、预后[11]。本研究结果显示,与放疗前比较,仅对照组患者放疗后外周血中CD4+T淋巴细胞百分数、CD4/CD8比值和NK细胞百分数显著降低,CD8+T淋巴细胞百分数均显著升高,且对照组患者以上指标放疗前后差值明显高于联合组。CD4+T淋巴细胞百分数和CD4/CD8比值与患者较好的预后以及免疫系统状态有关[12]。CD4+T淋巴细胞能辅助诱导其他免疫细胞共同发挥抗肿瘤作用,CD8+T淋巴细胞反应性增多会引起机体免疫功能下降或细胞毒作用,两者在体内处于动态平衡,维持免疫系统稳定[13]。本研究中T淋巴细胞的变化趋势提示联合脾区LDR能减轻常规放、化疗对机体造成的免疫抑制,维持免疫系统稳定。NK细胞在体内行使免疫监控功能,介导对某些肿瘤细胞的细胞毒性作用。本研究中,经放疗后NK细胞在对照组患者中下降幅度更大,且两组患者放疗前后差值有明显差异,提示联合脾区LDR能降低常规放化疗对免疫监视功能的抑制作用。外周血淋巴细胞的数值变化证实脾区LDR可有效减轻放化疗对局部晚期NSCLC患者免疫系统的抑制作用。
放疗物理剂量的生物学效应取决于相关组织的放射生物学特性、分割方案、剂量率和治疗时间。随着放疗物理剂量的增加,放疗不良反应也越来越严重。严重的放疗不良反应会使治疗暂停,降低疗效,甚至可能会危及患者生命。本研究在对两组患者急性和慢性不良反应的对比中发现,联合组患者Ⅲ、Ⅳ级急性不良反应及慢性不良反应例数明显少于对照组患者,而且联合组患者出现急性不良反应时的胸部三维适形放疗累积放疗剂量高于对照组,从而提示联合脾区LDR可以减轻放化疗引起的严重不良反应,提高危及器官的耐受量。OTSUKA等[14]研究发现,LDR可使脾脏中过氧化物酶基因及过氧化物酶活性显著增加,减少DNA损伤从而产生适应性反应。实验室研究发现小鼠经LDR后,脾细胞中造血因子转录水平升高,促进了骨髓造血功能[15]。这些研究进一步证实对脾区LDR可以在不损伤脾脏的情况下,减轻常规放疗造成的骨髓抑制。而对周围肺组织、食管及皮肤等危及器官损伤降低的机制暂不明确,有待进一步研究。
本研究在对两组患者影像学检查评估近期疗效的分析中发现,联合组患者RR显著高于对照组患者,提示联合脾区LDR可以提高局部晚期NSCLC患者根治性同期放化疗的疗效。本研究中联合组患者的中位PFS较对照组患者延长,原因可能有以下几点:脾区LDR减轻了常规放化疗对患者免疫系统的抑制作用,减轻免疫监视功能损伤,从而能够降低肿瘤复发、转移风险;脾区LDR减少了常规放化疗引起的Ⅲ、Ⅳ级不良反应和由此导致的放疗暂停,增加肿瘤局部放疗致死剂量,并使化疗按时进行。两组患者的1、3、5年生存率和中位OS无明显差异,考虑可能与脾区LDR未能长期应用有关。
综上所述,联合脾区LDR可以减轻根治性同步放化疗对局部晚期NSCLC患者的免疫抑制作用,降低放化疗不良反应,提高RR,延长中位PFS,但1、3、5年生存率和中位OS未见明显提高或延长。本研究为局部晚期NSCLC患者提供了临床治疗依据,后期应该加大样本量,通过延长脾区LDR或者联合其他治疗方案,进一步提高患者的远期疗效。

