地塞米松对急性胰腺炎胰腺组织中ERK信号通路及miRNA-216a的影响
廖永晖,何勇,叶荣强,戴启心,钟鼎文
(赣州市人民医院 肝胆胰外科,江西 赣州 341000)
0 引言
急性胰腺炎(Acute Pancreatitis,AP)的发病原因主要是患者自身存在的多种疾病,导致自身发生炎症的反应,AP具有突发性。在AP模型的胰腺中,地塞米松(DEX)对信号通路的影响可能起关键作用[1],例如Notch等信号通路具有一定程度的影响[2]。本文拟对DEX对胰腺腺泡细胞保护机制做相应论述。急性胰腺炎是一种炎症反应,发病原因较多,表现为胰腺内有胰酶激活,导致胰腺组织出现水肿、自身消化、出血,严重的还会发生坏死,对人类的生命安全造成不利影响。一旦发病,患者血清中的TNF-α,IL-6等基因被激活,这些基因与氧化应激反应有关;此外,p53,NF-κB,Bax,Bcl-2等基因表达也会发生变化,这些基因与凋亡有关。研究所用的大鼠AP模型的Notch信号通路激活后,Notch表达和Hesl蛋白表达明显上升。Notch表达升高幅度过大后对胰腺细胞凋亡产生抑制作用,在其影响下AP更加严重。经研究结果可见,地塞米松(DEX)存在对NF-κB活化产生抑制作用的可能性,并同时作用于Survivin的表达,对其抗凋亡作用产生抑制效果,从而导致胰腺细胞凋亡更为明显。但是目前并未出现以Notch信号通路为媒介出现的细胞凋亡应用地塞米松后有所缓解的有关报道。此次研究所采用的小鼠急性胰腺炎模型是用蛙皮素建立完成的,以此对胰腺腺泡细胞凋亡采用地塞米松治疗所产生的作用机制展开深入研究。
1 材料和仪器
1.1 实验动物。此次实验动物对象为30只健康成年SD大鼠,重量均为200~250 g,动物实验符合赣州市人民医院实验动物伦理委员会制定的伦理标准。
1.2 仪器。Bio-Rad SDS-PAGE型电泳分离仪(美国伯乐生命医学产品有限公司);全自动生化检测仪(日本株式会社日立制作所);LightCycler LC480Real-Time PCR system(瑞士罗氏公司)。
1.3 动物模型的制备。通过参考相关文献建立小鼠AP模型,并对其加以适当修改,具体参考对象为杨飞云等研究人员,蛙皮素与生理盐水混合予以稀释,使其浓度为10μg/mL,将其经腹腔为小鼠注射,剂量为50μg/kg,注射次数共计3次,每隔2 h注射1次,经腹腔注射地塞米松,剂量分别为0.5 mL/kg,0.4 mL/kg,0.6 mL/kg,0.8 mL/kg和1 mL/kg,对小鼠血清中的TNF-α浓度进行检测,以此完成梯度浓度的建立;准确给出注射浓度,DEX组小鼠经腹腔注射蛙皮素后随即注射地塞米松;AP组小鼠仅注射生理盐水,连续注射3次。两组小鼠完成最后一次注射后将其处死,对其血液和胰腺组织进行收集。
1.4 TNF-α和IL-6检测。采用ELISA对所有动物血清实施检测,明确其中TNF-α和IL-6的含量,抽取动物血液作离心处理获取血清,在-20℃温度下保存,采用酶联免疫吸附实验(ELISA)试剂盒检测血清中的TNF-α和IL-6含量,具体操作步骤参照试剂盒附带的使用说明书,采用由Molecular Devices公司生产的酶标仪置于450 nm对其吸光值进行测定。
1.5 Western blot。提取组织总蛋白,采用Western blot法对收集到的胰腺组织进行检测,明确其中Bax,Hesl,Notchl和Bcl-2蛋白表达所发生的变化,将研钵经高压消毒,放入胰腺组织,加适量液氮,将其研磨成末,然后倒入1.5 mL Ep管中,再倒入RIPA裂解液,在冰上静置30 min,在4℃温度条件下做离心处理,持续15 min,提出上清,采用BCA蛋白浓度测定试剂盒对其蛋白浓度进行测定。采用SDS-PAGE电泳将蛋白分离,置于NC膜,分别按照1∶500、1∶500、1∶500和1∶1000的比例对Bax抗体,Hesl抗体,Notchl抗体Bcl-2抗体在4℃温度条件下进行孵育,间隔一夜,作曝光处理,完成图像采集对灰度值进行分析。
1.6 RT-qPCR。对组织中总RNA进行提取,采用RTqPCR法对胰腺组织中的检测胰腺组织中Bax,Hesl,Notchl和Bcl-2mRNA的表达变化情况予以检测,将研钵经高压消毒,放入胰腺组织,加适量液氮,将其研磨成末,然后倒入1.5 mL Ep管中,倒入Trizol Reagent,完成总RNA提取,并对其纯度和浓度进行检测,逆转录RNA,形成cDNA,具体操作步骤参照逆转录试剂盒中附带的使用说明书。引物序列的设计与合成工作交由上海生工来完成,扩增模板为cDNA,RT-qPCR反应条件为预变性、变性、退火和延伸,分别为94℃ 、94℃、55℃和72℃,持续时间分别为30 s、5 s、30 s和30 s,反复循环40次。
1.7 方法
1.7.1 造模。30只大鼠随机分配,AP组10只,DEX+AP组10只,空白对照组10只。制作质量浓度为10μg· mL-1的蛙皮素生理盐水溶液,并将其通过以两小时为间隔三次连续注射的方式注射到大鼠腹腔,剂量为50μg·kg-1;另一组注射蛙皮素后,再注射质量浓度为5μg·mL-1的DEX,剂量1 mL·kg-1;对照组为生理盐水分三次定量注射。实验结束24 h后,对各组大鼠腹腔动脉取血样后处死大鼠,切取胰腺组织。
1.7.2 血清中AMY和LPS的水平测定:离心大鼠血液,以3000 r·min-1lixin,10 min后,将其清液取出,具体操作方式以试剂盒说明书为准,按照速率法对AMY和LPS的水平进行检测。
1.7.3 血清促炎因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和TGF-β1水平测定:离心大鼠血液,以3000r·min-1lixin,10 min后,将其清液取出,测定各组胰腺组织和血清中IL-1β、IL-6、TNF-α和TGF-β1的水平采用Elisa法。
1.7.4 胰腺组织中miRNA-216amRNA表达的测定:将待测的各大鼠胰腺组织研成粉末状,静置于1.5 mLep管中,待检出的胰腺组织样本中mirna-216a的表达,将直接通过RT-qPCR法。首先在每个样本中分别加入适量的trizol试剂,然后从其中提取出一个总RNA,依照说明将RNA逆转录成cDNA,以cDNA为主要基础的仿真模板对其数据进行扩充。
1.7.5 胰腺组织中p-ERK1/ERK2的蛋白表达:大鼠胰腺组织中p-ERK1/ERK2蛋白表达情况用WesternBlot法检测。此次实验中采用bca试剂盒对蛋白质含量进行了检测,采用bio-radsds-page电泳分离蛋白技术后将其移至nc膜,分别添加I抗4℃孵育过夜,I抗稀释后所用的浓度分别是gapdh抗体(1∶10000)、p-erk1/erk2抗体(1∶500),然后在室温环境下加入荧光II抗体孵育2 h,然后再利用odyssey双色红外激光技术仪器,采集图像分析灰度的平均值。
1.8 统计学分析。数据经过SPSS 18.0软件分析,实验数据表示方法为(±s),多样本比较为单因素方差分析,两样本比较为t,P<0.05为数据相比差异有意义。
2 结果
2.1 各组大鼠血清中AMY与LPS水平变化情况。AP组血清中AMY与LPS水平均明显高于对照组(P<0.01);DEX组血清中二者的水平均显著低于AP组(P<0.05)。见表1。
表1 各组大鼠血清中AMY与LPS水平变化背景情况(±s)
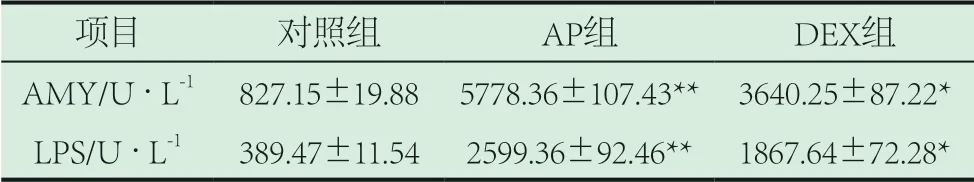
表1 各组大鼠血清中AMY与LPS水平变化背景情况(±s)
注:与对照组比较**P<0.01;与AP组比较*P<0.05。
项目 对照组 AP组 DEX组AMY/U·L-1 827.15±19.88 5778.36±107.43** 3640.25±87.22*LPS/U·L-1 389.47±11.54 2599.36±92.46** 1867.64±72.28*
2.2 各组大鼠胰腺组织及血清中TNF-α、IL-6、IL-1β和TGF-β1水平情况。AP组大鼠血清和胰腺组织中TNF-α、IL-6、IL-1β和TGF-β1明显呈现出升高趋势(P<0.01);DEX组大鼠血清和胰腺组织TNF-α、IL-6、IL-1β和TGF-β1明显呈现出降低趋势(P<0.05)。见表2、3。
表2 各组大鼠胰腺组织中TNF-α、IL-6、IL-1β和TGF-β1水平情况(±s)
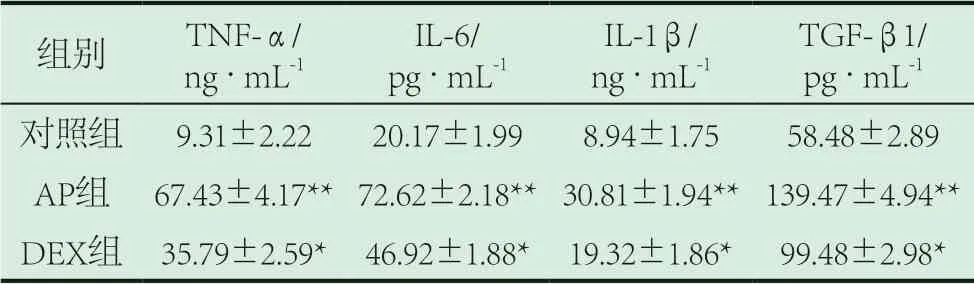
表2 各组大鼠胰腺组织中TNF-α、IL-6、IL-1β和TGF-β1水平情况(±s)
注:与对照组比较**P<0.01;与AP组比较*P<0.05。
组别 TNF-α/ng·mL-1 IL-1β/ng·mL-1 IL-6/pg·mL-1 TGF-β1/pg·mL-1对照组 9.31±2.22 20.17±1.99 8.94±1.75 58.48±2.89 AP组 67.43±4.17**72.62±2.18**30.81±1.94**139.47±4.94**DEX组 35.79±2.59* 46.92±1.88* 19.32±1.86* 99.48±2.98*
2.3 各组大鼠胰腺组织中miRNA-216a mRNA的表达结果。DEX组大鼠胰腺组织中miRNA-216amRNA的表达为(2.315±0.239),显著低于AP组(P<0.05)。AP组大鼠胰腺组织中miR-NA-216amRNA的表达为(2.787±0.422),显著高于对照组(P<0.001)。
表3 各组大鼠血清中TNF-α、IL-6、IL-1β和TGF-β1检测水平情况(±s)

表3 各组大鼠血清中TNF-α、IL-6、IL-1β和TGF-β1检测水平情况(±s)
注:与对照组比较**P<0.01;与AP组比较*P<0.05。
组别 TNF-α/TGF-β1/pg·mL-1对照组 2.42±0.56 60.25±4.33 1.80±0.92 23.74±1.76 AP组 15.32±0.71**255.87±5.59**13.73±1.53**87.75±2.79**DEX组 9.33±0.72* 111.46±4.32* 8.45±1.14* 36.88±2.31*ng·mL-1 IL-6/pg·mL-1 IL-1β/ng·mL-1
2.4 各组大鼠胰腺组织中p-ERK1/ERK2的蛋白表达。AP组大鼠胰腺组织中p-ERK1/ERK2的蛋白表达显著高于对照组,DEX组大鼠胰腺组织中p-ERK1/ERK2的蛋白表达明显低于AP组(P<0.05),见图1。
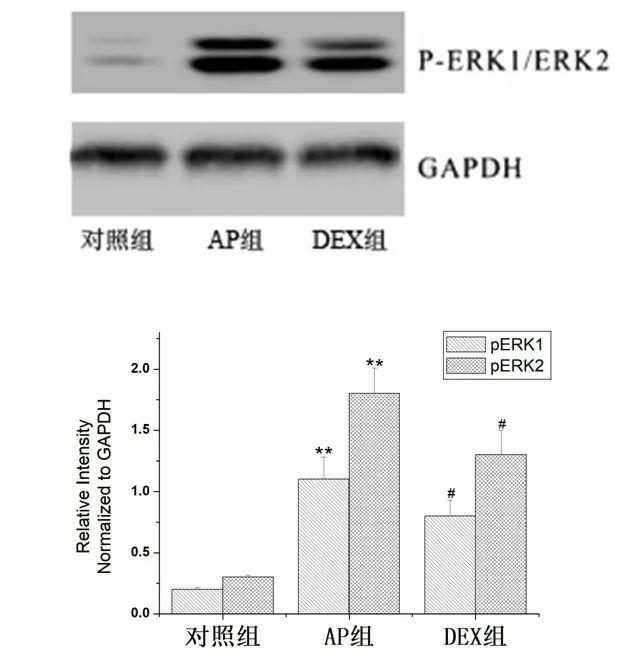
图1 p-ERK1/ERK2蛋白在胰腺组织中的表达
3 讨论
在临床中,急性胰腺炎是一种高发性疾病,其临床症状主要为疼痛,患者的腹部会出现反复疼痛且痛感剧烈,大部分患者因该病症选择就医,患者的生活质量明显下降。急性胰腺炎所产生的疼痛属于内脏性神经病理性痛,有调查研究发现,在急性胰腺炎患者中,出现腹痛症状的患者的占80%~90%,病程缓慢发展,即使病症得以改善或者被治愈也无法完全消除,因此出现严重的疼痛现象后,对患者预后及转归会产生不利影响。急性胰腺炎所引发的疼痛会给治疗带来一定的困难,所以对患者展开原发病治疗时,也不能忽视止痛治疗。但是直至今日,急性胰腺炎的相关发病机制、临床过程、病理生理还存在很多未知因素,在实施治疗时也以慢性胰腺炎及并发症为主,在治疗疼痛时通常采用传统镇痛药物,不仅治疗效果不理想,还会产生较大的副作用。所以,为了提高急性胰腺炎的治疗效果,改善患者的生活质量,就要明确其发病机制,研究出更有针对性的治疗方法。AP的发生发展是过程极为复杂,涉及到的因素比较广泛[2],其最显著因素有以下三点,第一点是活化的胰酶,第二点是细胞因子,第三点是趋化因子。在AP模型胰腺中,地塞米松(DEX)对其Notch信号通路有一定程度的影响[3],而且在组织细胞的生长、发育、增殖和分化中过程中,转化生长因子β(TGF-β)信号通路也起决定性作用,时可对免疫功能、炎症反应等起到调节作用[4]。TGF-β有3种亚型,分别为TGF-β1、转化生长因子kβ2(TGF-β2)和转化生长因子β3(TGF-β3)。本项研究结果表明,AP组大鼠与其他对照组大鼠胰腺组织中miRNA-216a的表达相较而言,AP组显著高于对照组,在使用DEX治疗之后,与AP组比较,动物胰腺组织中miRNA-216a的表达显著降低[5],说明DEX可降低AP动物胰腺组织中miRNA-216a的表达。
miRNA属于非编码的RNA,当出现炎症反应或者免疫应答时,可对靶基因表达进行调控,其作用显著。在AP模型大鼠的 miRNA-216amRNA表达出现明显上升,在急性胰腺炎的整个发病过程均有参与,在急性胰腺炎诊断时有参考价值。地塞米松属于皮质类固醇,可用于对抗炎症或改善微循环,临床中可用于急性胰腺炎的治疗。有研究指出,地塞米松可使Bax基因蛋白的表达升高致使胰腺细胞凋亡,缓解炎症。又有研究发现,在急性胰腺炎病理过程中,对miRNA -216a的表达进行抑制,对胰腺的病理学损伤有一定的缓解作用。此次研究通过对动物胰腺组织中miRNA -216amRNA的表达进行检测,发现相较于对照组,AP组动物胰腺组织中的miRNA -216amRNA水平更高,这一结果与临床研究无差异,经治疗后,DEX组的动物胰腺组织中miRNA -216amRNA比AP组下降更为明显,可见地塞米松可抑制miRNA -216amRNA表达,同时可作用于miRNA-216a的表达。DEX对NF -κB活性进行抑制,使胰腺腺泡出现凋亡,降低其坏死率。
本文对AP中DEX对ERK信号通路影响进行了研究,使用DEX治疗后,信号通路中p-ERK1/ERK2的蛋白表达程明显降低状态。同时,使用DEX治疗后,动物胰腺组织与血清中的TNF-α、IL-6及IL-1β、TGF-β1的水平均显著降低,结果提示,AP发生时,DEX可通过抑制TGF-β1的水平,进而抑制ERK1/ERK2蛋白的磷酸化,而抑制TGF-β1/ERK信号通路的激活;AP过程中,参与炎症反应的炎症细胞因子主要有IL-1β、TNF-α、IL-6与TGF-β1等[5],本研究中DEX通过抑制TGF-β1/ERK信号通路的激活,阻碍炎症因子的形成与发挥作用,从而达到减轻对胰腺腺泡细胞损伤的效果。
综上所述,DEX通过对抑制TGF-β1等炎症因子的表达,抑制ERK1/ERK2蛋白磷酸化,达到抑制TGF-β1/ERK信号通路激活的效果;从另一方面来说,DEX可以有效抑制miRNA-216a的表达,炎症因子合成和释放功能减弱,胰腺腺泡细胞被有效保护。

