上调微小mRNA-564对非小细胞肺癌A549细胞生物学行为的影响研究
王艳春 李昶
肺癌是一种恶性程度较高的肿瘤,是威胁人群生命健康最大的恶性肿瘤之一[1]。近几十年来许多的国家都报道肺癌的发病率和病死率均明显增高,男性肺癌发病率和病死率均占所有恶性肿瘤的第一位[2]。肺癌的发生与长期大量吸烟有着非常密切的关系,有研究表明,长期吸烟的肺癌患者比不吸烟者患上肺癌的概率是10~20倍,随着吸烟者的年龄越小,患肺癌的概率越高[3]。城市中大量的烟尘和大气中含致癌污染物,也是导致患上肺癌的因素之一,因此寻找一个有效治疗肺癌的临床治疗具有重要意义[3]。本文研究中,上调微小信使核糖核酸-564(miR-564)对非小细胞肺癌A549细胞生物学行为的影响研究,具有重要作用。
1 材料与方法
1.1 材料 研究细胞:非小细胞肺癌A549细胞,购于上海北诺生物科技有限公司,货号l100800。本研究获得我院伦理委员会批准。主要试剂:TLR-4(上海科敏生物科技有限公司),货号:H00007099-G01;MyD88(深圳市豪地华拓生物科技有限公司),货号:251418;IκBα(上海江莱生物科技有限公司);CyclinD1(武汉博欧特生物科技有限公司),货号:orb77046;P21(北京百奥莱博科技有限公司),货号:K23376-XGJ;MTT试剂盒(上海晶抗生物工程有限公司),货号:JKSJ-1812;流式细胞仪(常州必达科生物科技有限公司),货号:1026;Transwell小室(上海生博生物医药科技有限公司)。
1.2 方法
1.2.1 细胞分组处理:选取细胞分为空白组、下调组、上调组,空白组不做任何处理,对下调组、上调组细胞进行培养。取下调组、上调组2组细胞,将培养基置于37℃水槽中回温,培养基回温后喷以70%的乙醇并擦拭,轻摇冷冻管2 min其全部融化,移入无菌操作台内。测量出细胞的浓度,将细胞种植于六孔板内,每个六孔板大约种植细胞4×105细胞,加至新鲜的培养基中(10 ml)进行培养。放入37℃、5%CO2培养箱培养,细胞孵育到融合率在40%~80%时,取1.5 μl的质粒DNA溶于100 μl的双抗培养基中(不含血清),之后进行充分混合,混合均匀后进行离心处理至EP管底,在EP管中加入12 μl的PolyFectReagent,进行上下重复颠倒3次,进行混匀处理,静置在室温环境下,静置时间约为3~6 min,对转染复合物的形成起到促进作用,吸去置于六孔板中的培养基,将新鲜的完全培养基加入(10 ml),在含有转染复合体的EP管中加入含有血清和双抗的600 μl完全培养基,上下重复颠倒2次,在加入六孔板中进行水平摇晃,以促进转染复合物的均匀分布。培养24 h后进行常规的换液处理,再次继续24 h的培养,使用荧光显微镜下对荧光亮度进行观察,对细胞进行收集,提取细胞RNA,鉴定转染效率,将转染效率最高的质粒组、空载组稀释液接种于10 mm2培养皿中,选取经过PCR验证筛选的细胞进行消化处理后稀释,稀释后接种在24孔板中,最终建立稳定转染的miR-564下调组、miR-564上调组。
1.2.2 细胞增殖、凋亡能力、细胞周期分布检测:MTT法检测细胞增殖用含有10%胎小牛血清培养液配单个细胞悬液,细胞按7×103个/孔接种于96孔板,每孔体积200 μl,同一般培养条件,培养2~4 d,培养2~4 d 后,每孔加入MTT继续孵育4 h,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养清液。每孔加入150 μl DMSO,振荡10 min。选择570 nm波长,采用酶联免疫检测仪测定各孔光吸收值,记录结果,以时间为横坐标,吸收值为纵坐标绘制细胞生长曲线。采用流式细胞仪检测细胞凋亡、周期分布,收集细胞样本,细胞数量<10×105个。并将细胞在37℃、5%CO2的环境中培养,用冷PBS洗涤细胞1次,再用200~500 μl冷PBS重悬细胞。加入200 μl PI染液,摇晃混匀后4℃,避光常温环境中4 h,流式细胞仪检测结果的最大激发波长为488 nm。
1.2.3 细胞侵袭检测:使用检测细胞侵袭能力,用无胎牛血清的DMEM培养基洗细胞3次,配制细胞悬液,细胞浓度为5×105/ml,于Transwell小室的上室中加入不同的细胞悬液200 μl,每组选3个复孔,在37℃,5%CO2培养24 h,HE染色计数,在光学显微镜下观察穿过膜的细胞数。
1.2.4 细胞划痕实验将细胞接种到6孔板中,待细胞贴壁生长,细胞增长到90%时,使用200 μl的移液器枪头,垂直划出3条直线。之后经过PBS缓冲液进行清洗2~3次,分别加入0.5%的血清培养基,细胞培养24 h,使用光学显微镜观察各组细胞的迁移变化。
1.2.5 CyclinD1、P21、TLR-4、MyD88、IκBα蛋白表达检测:采用Western Blot检测,使用PBS清洗细胞,测定蛋白的浓度。100℃加热处理5 min促使蛋白变性,SDS蛋白缓冲液后电泳进行转膜,摇床上常温封闭1 h;采用DAB染色试剂盒显色,光密度扫描版进行分析。
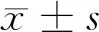
2 结果
2.1 3组细胞不同时间点增殖、凋亡能力比较 下调组在24、48、72 h,细胞增殖率均高于空白组,上调组细胞增殖率低于空白组和下调组,差异均有统计学意义(P<0.05);下调组在24、48、72 h,细胞凋亡率低于空白组,上调组细胞凋亡率高于空白组和下调组,差异均有统计学意义(P<0.05)。见图1,表1。

表1 3组细胞不同时间点增殖、凋亡能力比较


空白组下调组上调组
2.2 3组细胞侵袭、迁移能力比较 下调组侵袭细胞数、迁移细胞数均高于空白组和上调组,差异有统计学意义(P<0.05)。上调组侵袭细胞数、迁移细胞数均低于空白组和下调组,差异有统计学意义(P<0.05)。见表2,图2。

空白组下调组上调组

表2 3组细胞侵袭、迁移能力比较 个,

2.3 3组TLR4/NF-κB通路TLR-4、MyD88、IκBα表达比较 下调组TLR-4、MyD88、IκBα表达均高于空白组,差异有统计学意义(P<0.05);上调组TLR-4、MyD88、IκBα表达低于空白组,差异有统计学意义(P<0.05);上调组TLR-4、MyD88、IκBα表达低于下调组,差异有统计学意义(P<0.05)。见表3,图3。

表3 3组TLR4/NF-κB通路蛋白TLR-4、MyD88、IκBα表达比较

图3 TLR-4、MyD88、IκBα表达WB图
2.4 3组细胞周期分布情况比较 下调组细胞处于G1、S、G2期的比例低于空白组,差异有统计学意义(P<0.05);上调组细胞处于G1期的比例均高于空白组处于S、G2期比例低于空白组,差异有统计学意义(P<0.05);上调组细胞处于G1期的比例高于下调组S、G2期比例低于下调组,差异有统计学意义(P<0.05)。见表4。

表4 3组细胞周期分布情况比较
2.5 3组细胞周期相关蛋白CyclinD1、P21表达比较 下调组CyclinD1高于空白组,P21低于空白组,差异有统计学意义(P<0.05);上调组CyclinD1低于空白组,P21高于空白组,差异有统计学意义(P<0.05);上调组CyclinD1低于下调组,P21高于下调组,差异有统计学意义(P<0.05)。见表5,图4。

表5 3组细胞周期相关蛋白CyclinD1、P21表达比较

图4 CyclinD1、P21表达WB图
3 讨论
近年来我国患恶性肿瘤的人群明显升高,肺癌的主要病理组织分为非小细胞肺癌和小细胞肺癌两大类,肺癌患者病理分型中绝大部分是非小细胞肺癌,给患者及其家属带来日常生活、生命健康等影响[4,5]。肺癌患者往往早期无症状或症状不明显,肺癌患者一旦出现病症、体征已是肺癌晚期,临床对肺癌患者治疗效果并不令人满意,对非小细胞肺癌患者要早期发现,早诊断治疗[6,7]。在本文研究中,上调微小RNA-564对非小细胞肺癌A549细胞生物学行为的影响,效果有显著改善。
临床研究显示[8,9],肺癌的发生与多种miRNA表达异常相关,经调控异常表达的miRNA可抑制非小细胞肺癌A549细胞的增殖、侵袭、迁移,促进凋亡。微小mRNA-564属于miRNA家族成员之一,其在临床上被证实在肺癌中表达异常,且与肺癌疾病进展密切相关[10]。鉴于此,在本文中分析调控微小mRNA-564对肺癌细胞生物学行为的影响,结果显示,上调mRNA-564能让非小细胞肺癌A549细胞抑制癌细胞增殖,癌细胞凋亡率升高[11]。调控细胞周期的关键是G1期向S期进展,细胞中多种蛋白共同参与[12]。研究显示,CyclinD1在G1期向S期进展中发挥着关键性的作用,G1期合成水平相对较高。P21通过抑制CyclinD1蛋白表达,有助于抑制癌细胞从G1期向S期进展。在本文中,上调组CyclinD1蛋白表达降低,P21蛋白表达升高,说明上调微小mRNA-564通过调控CyclinD1、P21蛋白表达,实现对非小细胞肺癌A549细胞周期阻滞[13]。上调miR-564阻滞细胞周期分布,在G1期,能够让癌细胞凋亡。上调mRNA-564阻滞癌细胞周期分布促进癌细胞凋亡有重要意义,CyclinD1能促进细胞增殖,CyclinD1通过结合并激活G1时期特有的周期蛋白依赖性激酶CDK4,G1期周期抑制蛋白被磷酸化,磷酸化的蛋白从其所结合E2F转录因子起转录活细胞周期的基因,从而推动细胞周期有G1时期进入到S时期[14]。因此上调mRNA-564能够阻滞癌细胞的周期,对癌细胞凋亡有一定的作用[15]。上调mRNA-564对非小细胞肺癌A549细胞的侵袭、迁移有着密切关系,在本文研究中,通过Transwell小室实验对非小细胞肺癌A549细胞的侵袭、迁移能力进行测验,上调mRNA-564对非小细胞肺癌A549细胞的侵袭、迁移细胞数量减少,说明上调mRNA-564能够抑制A549细胞的侵袭、迁移的作用。A549细胞增殖、侵袭、迁移,促进凋亡与细胞通路蛋白表达变化有密切联系[16,17]。TLR-4为气道上皮细胞以及肺泡巨噬细胞中重要的免疫受体,可识别一系列病原体相关分子模体,通过TLR-4/MyD88依赖的信号链,启动相应的免疫防御反应。MyD88是Toll样受体信号通路中的一个关键接头分子,在传递上游信息和疾病发生中具有重要的作用。IκBα是发现于成熟B细胞中的转录因子,具有淋巴细胞特异性,在各个细胞中均有表达。IκBα抑制肺癌细胞凋亡和阻滞细胞周期,在血管生成、细胞迁移、免疫激活等方面具有重要作用[18-20]。
综上所述,上调微小mRNA-564经调控TLR-4、MyD88、IκBα蛋白的表达,抑制增殖、侵袭、迁移,促进凋亡,经调控CyclinD1、P21蛋白表达阻滞细胞周期分布。

