丛枝菌根育苗缓解西瓜枯萎病的机制*
李淑君,王兵爽,王 媛,张舒桓,张夕雯,张晓晖,徐国华,任丽轩
(南京农业大学资源与环境科学学院/农业部长江中下游植物营养与肥料重点实验室/江苏省有机固体废弃物资源化协同创新中心,南京210095)
西瓜是世界广泛栽培的水果,我国西瓜种植面积和产量分别占世界的52.7%和67.0%[1]。江苏省种植面积在2016年达到19.28万hm2,为经营者带来了极大的经济效益[2]。近年来,西瓜种植面积不断扩大,受耕地面积减少的限制,常出现重茬栽培,容易受连作障碍影响,加重作物的病虫害。西瓜连作病害主要是尖孢镰刀菌西瓜专化型造成的枯萎病[3],西瓜枯萎病严重时造成西瓜大量减产[4]。生物防治是可持续农业防控枯萎病的重要方法[5],利用具有拮抗作用的微生物来减少甚至遏制病原菌的数量,以降低枯萎病的发病率。丛枝菌根真菌(AMF)是生态环境中分布广泛的一种有益内生真菌,能与80%以上的陆生植物建立共生关系[6],增强植物抗旱性[7],促进磷素吸收,有效缓解由连作障碍引起的病虫害,提高宿主植物的抗病性。
西瓜连作枯萎病的发生与西瓜植株抗病性和根际病原菌数量密切相关[8]。在连作土壤中,西瓜形成丛枝菌根后,无论是嫁接苗还是自根苗,均能显著提高根系中几丁质酶、β-1,3-葡聚糖酶、苯丙氨酸解氨酶(phenylanlanine ammonia-lyase,PAL)、过氧化氢酶(catalase,CAT)以及过氧化物酶(peroxidase,POD)的活性,提高对逆境的反应能力[9]。
田间直接接种丛枝菌根菌对抑制西瓜枯萎病有一定的效果,其作用机制是改善了西瓜氮、磷、硼、锌等矿质营养,提高抗病性[10],主要是促进了西瓜对土壤中矿质态磷素的吸收[11]。由于土壤中的磷营养和微生物环境复杂,田间直接接种丛枝菌根菌对菌根定殖存在风险,本研究设想在西瓜育苗期间接种丛枝菌根菌,形成丛枝菌根苗,研究丛枝菌根苗在移栽后生理功能的发挥及其机制。丛枝菌根育苗的方法在树木和其他作物上已经成功应用[12-13]。作者所在研究组已经证实丛枝菌根育苗能提高西瓜根系防御性酶活性[14],本研究将进一步证实这些防御性酶在转录水平上是否有表达量的变化。此外,根外菌丝分泌的酸性磷酸酶在提高根际土壤酸性磷酸酶活性、促进有机磷水解、提高根际有效磷含量也起着重要作用[15]。丛枝菌根化培育的西瓜苗在移栽后是否能继续保持或提高西瓜根际土壤酸性磷酸酶活性,以提高根系水解和利用土壤中有机磷的能力,从而提高西瓜抗病能力,尚未可知。本研究将采用丛枝菌根育苗的方法,探讨西瓜根系在苗床形成丛枝菌根,移栽后是否在转录水平上提高西瓜防御性酶编码基因表达量,提高西瓜抗病能力;而且在大田中是否可以保持侵染率,并从提高根际有机磷利用能力方面提高抗病能力。
1 材料与方法
1.1 供试材料
西瓜品种为早佳-8424(Citrullus lanatus(Thunb.)Matsum and Nakaicv. Zaojia-8424)。
根内根孢囊霉(Rhizophagus intraradices,R.i)菌种由北京市农林科学院植物营养与资源研究所提供,采用土壤和河沙基质,种植玉米和三叶草扩繁,产生孢子、菌丝体、土壤和河沙的混合接种剂。
西瓜专化型尖孢镰刀菌(Fusarium oxysporumf.sp.niveum,FON)由本实验室从发病西瓜植株上筛选并保存[16]。病原菌FON为马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)活化的西瓜专化型尖孢镰刀菌,接入马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB)溶液,在 28℃220 r·min-1条件下振荡培养7 d,用血球计数板计数,尖孢镰刀菌孢子数为107CFU·mL-1。用尖孢镰刀菌选择性培养基[17]筛选菌株。
西瓜育苗基质为作物秸秆、稻壳、木屑、菇渣等有机固体废弃物的混合物,发酵后混合蛭石和珍珠岩无机物料。基质由淮安柴米河农业科技发展有限公司惠赠。
1.2 试验设计
1.2.1 土培盆栽试验 盆栽试验设置在南京农业大学资源与环境科学学院温室。共设置4个处理:(1)-AMF-FON:非丛枝菌根育苗,不接种FON(对照);(2)+AMF-FON:丛枝菌根育苗,不接种FON;(3)-AMF+FON:非丛枝菌根育苗,接种FON;(4)+AMF+FON:丛枝菌根育苗,接种FON。重复3次。土壤采自南京农业大学牌楼试验基地,经γ-射线辐照灭菌。土壤基本理化性状为:碱解氮55.8 mg·kg-1,有效磷4.2 mg·kg-1,速效钾132 mg·kg-1,pH 7.8。试验中西瓜苗在50孔的育苗盘培育,用西瓜专用育苗基质,丛枝菌根化育苗的处理在育苗盘中接种丛枝菌根菌菌种,非菌根苗接种等量的灭菌丛枝菌根菌菌种和菌种滤液。育苗20 d时,移栽至装有无菌低磷土的盆钵中,每盆移栽5株。移栽后采用灌根法接种FON孢子悬浮液,分别在移栽后第5天、第10天、第15天接种FON,每株浇灌5 mL。移栽20天后,处理3(-AMF+FON)的西瓜苗出现枯萎病症状,收获。收获时,小心将西瓜植株完整取出,抖去与根系分离的土壤,收集根际土壤待测枯萎病病原菌数量,取植株洗净,待测生物量、酶活性、基因表达量。
盆钵中土壤施肥量为:N(Ca(NO3)2·4H2O)1.68 g·kg-1,P(KH2PO4)0.68 g·kg-1,K(K2SO4)0.24 g·kg-1,Mg(MgSO4·7H2O)0.51 g·kg-1,Fe(FeSO4·7H2O)0.025 g·kg-1,Zn(ZnSO4·7H2O)0.022 g·kg-1。
1.2.2 大田试验 大田试验研究丛枝菌根育苗对西瓜根系利用有机磷及抗枯萎病的影响。试验设置在江苏省句容市(119°17′E,31°95′N),土壤基本理化性状为碱解氮72.68 mg·kg-1,有效磷14.09 mg·kg-1,速效钾55 mg·kg-1,pH 4.24。试验设置两个处理:非丛枝菌根育苗(-AMF)和丛枝菌根育苗(+AMF)。每个处理4个重复。将接种物以每钵5 000接种势单位分别置于营养钵内,对照则加入等量的灭菌接种物,并与钵中土壤混匀后播种。待西瓜幼苗长至两片真叶时移栽入大田,小区面积120 m2,每666.7 m2定植 650株,试验期间除草、灌水等管理正常,西瓜成熟时收获。收获时,按照五点法采集西瓜、土壤样品,每小区采集5个植株样品,采集时将西瓜根系从土壤中挖出,用抖土法收集西瓜根际土壤待测,将每株西瓜所有果实称重计产。
1.3 样品采集与测定
1.3.1 植株生物量及磷吸收量 盆栽试验收获后,采集植株地上部和地下部的鲜样,105℃杀青,70℃烘至恒重,测定干物质量。称取烘干样0.100 0 g,采用硫酸-过氧化氢消煮,取消煮液采用钼锑抗比色法测定全磷含量[12],计算磷吸收量。
1.3.2 抗性相关基因表达量 从葫芦科基因组网站(http://cucurbitgenomics.org)查得西瓜基因组抗性相关酶几丁质酶、β-1,3-葡聚糖酶和PAL酶基因序列,并设计引物(表1)[18]。RNA提取和cDNA合成及实时荧光定量(RT-qPCR)分析参照文献[19]。

表1 PCR扩增引物Table 1 Primers used for PCR amplification
1.3.3 西瓜根系酶活性 分别用几丁质酶、β-1,3-葡聚糖酶、苯丙氨酸解氨酶试剂盒(苏州科铭生物技术有限公司)进行测定。
1.3.4 土壤酸性磷酸酶活性 采用磷酸苯二钠法测定[12],于660 nm波长处比色。
1.3.5 土壤有效磷含量 采用钼锑抗比色法测定[12]。
1.3.6 菌根侵染率 采用曲利苯蓝染色法[14]。菌根侵染率/%=Σ(0%×根段数+10%×根段数+20%×根段数+···+100%×根段数)/总根段数。
1.3.7 枯萎病调查方法及枯萎病分级标准 0级:健康植株,无发病症状;1级:叶片或茎蔓由下而上萎蔫,萎蔫面积占全株的1/4或1/4以下; 2级:叶片或茎蔓由下而上萎蔫,萎蔫面积占全株的1/4~1/2,茎蔓上有琥珀色胶状物;3级:叶片或茎蔓由下而上萎蔫,萎蔫面积占全株的1/2以上,茎蔓上有琥珀色胶状物;节间变短,下部病茎表面产生白色或粉红色霉层,阻碍发育;4级:整株枯萎死亡。
病情指数/%=Σ(级数×该级数发病株数)/(总调查数×最高级数)×100
发病率/%=发病株数/总调查数×100
防治效果/%=(对照的病情指数-接种AM真菌的病情指数)/对照的病情指数×100
1.3.8 土壤中西瓜枯萎病病原菌数量和AM真菌孢子数 用选择培养基稀释分离法测定土壤中枯萎病病原菌数量[19]。采用湿筛倾注-蔗糖离心法,体视镜(OLYMPUS MVX10,南京奥利科学仪器有限公司,南京)下计数AM真菌孢子数[18]。
1.4 数据处理
用Microsoft Excel 2013对数据进行统计与图表处理,采用SPSS 17.0单因素方差分析(One-way ANOVA)的图基(Tukey)方法进行不同处理的差异显著性检验,显著性水平为P≤0.05。
2 结 果
2.1 丛枝菌根育苗对西瓜枯萎病发病率的影响
表2 表明丛枝菌根育苗可有效抑制西瓜枯萎病。在接种FON处理下,与非丛枝菌根育苗处理相比,丛枝菌根育苗的西瓜植株发病率降低了22.22%,病情指数降低了23.15%,防治效果达到36.23%。接种FON的西瓜根际土壤中发现了大量的尖孢镰刀菌,丛枝菌根育苗显著降低西瓜根际土壤病原菌数量。

表2 丛枝菌根育苗对西瓜枯萎病的影响Table 2 Effects of inoculation of arbuscular mycorrhizae at the seedling stage on Fusarium wilt of watermelon
2.2 丛枝菌根育苗对西瓜植株生物量积累和菌根侵染率的影响
如图1所示,接种FON处理时,丛枝菌根育苗的西瓜地下部干物质量显著高于非丛枝菌根育苗处理,表3表明西瓜根际接种FON对西瓜根系菌根侵染率无影响。
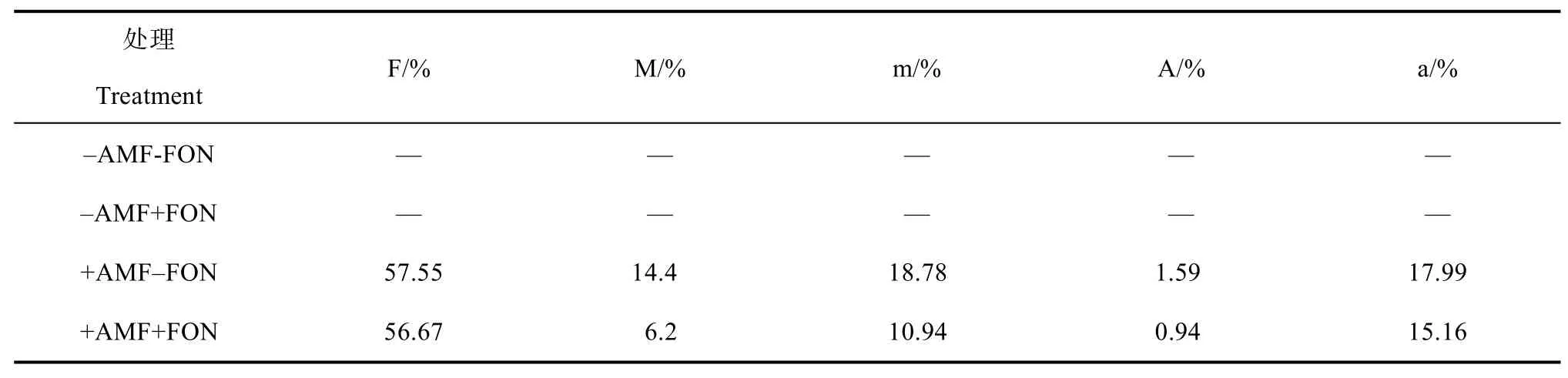
表3 西瓜根系菌根侵染率Table 3 Arbuscular mycorrhizal colonization rate of watermelon root
2.3 丛枝菌根育苗对西瓜基因表达量的影响
ClPR4、ClPR5和ClPR6是西瓜中编码几丁质酶基因,如图2a所示,与对照处理相比,丛枝菌根苗接种FON时,显著提高西瓜根系和叶片ClPR4表达量;图2b所示,丛枝菌根苗接种FON时,西瓜根系ClPR5表达量显著提高,为非丛枝菌根苗不接种FON处理的2倍;丛枝菌根育苗同时接种FON处理时,西瓜根系和叶片ClPR5表达量较其他处理显著提高。图2c表明丛枝菌根育苗接种FON处理时,西瓜叶片ClPR6表达量显著高于其他处理。
ClGlu1、ClGlu2和ClGlu3是西瓜中编码β-1,3-葡聚糖酶的基因。图3a表明接种FON处理时西瓜根系ClGlu1表达量显著高于对照,丛枝菌根育苗接种FON处理时,西瓜根系ClGlu1表达量显著高于对照,相对表达量提高了38倍;丛枝菌根育苗接种FON处理时,西瓜叶片ClGlu1表达量显著高于其他处理。图3c表明丛枝菌根育苗接种FON处理时,西瓜叶片ClGlu3表达量显著高于其他处理,分别为丛枝菌根育苗不接种FON、单接种FON和对照处理的1.4倍、1.3倍、71倍;丛枝菌根育苗不接种FON或单接种FON时,西瓜根系ClGlu3表达量均显著高于对照,且丛枝菌根育苗接种FON处理时,根系ClGlu3表达量显著高于其他处理。
ClPAL4、ClPAL8和ClPAL11是西瓜中编码苯丙氨酸解氨酶的基因。图4a表明接种FON处理时,根系ClPAL4表达量显著提高;丛枝菌根育苗接种FON处理时,西瓜根系及叶片ClPAL4表达量显著高于其他处理。图4b表明,丛枝菌根育苗接种FON处理时,西瓜叶片ClPAL8相对表达量较其他处理显著提高。图4c表明,丛枝菌根育苗接种FON处理时,西瓜根系ClPAL11表达量显著高于其他处理。
2.4 丛枝菌根育苗对西瓜植株抗性相关酶活性的影响
如图5a所示,与对照相比,接种AM菌提高了西瓜根系几丁质酶活性。图5b所示,在西瓜根际接种FON时,丛枝菌根育苗可提高西瓜叶片β-1,3葡聚糖酶活性,较非丛枝菌根育苗处理提高27.3%。图5c所示,丛枝菌根育苗接种FON、丛枝菌根育苗不接种FON以及单接种FON处理时,西瓜叶片苯丙氨酸解氨酶活性均显著高于对照处理,其中丛枝菌根育苗不接种FON处理时苯丙氨酸解氨酶活性为对照处理的1.3倍。
2.5 丛枝菌根育苗对西瓜根际土壤酸性磷酸酶活性的影响
如图6所示,大田试验表明,与非丛枝菌根育苗处理相比,丛枝菌根育苗显著提高了西瓜根际土壤酸性磷酸酶活性,与非丛枝菌根育苗相比,提高了7.3%(图6a),并显著提高西瓜根际土壤有效磷含量。
2.6 丛枝菌根育苗对西瓜发病率的影响
如图7所示,丛枝菌根育苗显著提高西瓜根系菌根侵染状况(图7a、图7b、图7c),并且丛枝菌根育苗显著提高根际土壤及非根际土壤孢子数(图7d),改善西瓜根系环境,显著降低了西瓜发病率(图7e)。
2.7 丛枝菌根育苗对成熟期西瓜生物量及磷吸收量的影响
如表4所示,大田试验表明,丛枝菌根育苗处理下,西瓜地上部干物质量显著高于非丛枝菌根育苗处理;丛枝菌根育苗显著降低西瓜根、茎、叶、瓜皮的磷吸收量;丛枝菌根育苗处显著提高西瓜单瓜生物量。
3 讨 论
植物形成丛枝菌根提高抗生物胁迫和非生物胁迫的能力。丛枝菌根植物提高抗逆能力的可能机制有:
3.1 提高植物抗性相关酶活性
几丁质和葡聚糖是真菌细胞壁的主要成分,几丁质酶和β-1,3葡聚糖酶通过降解菌丝细胞壁,破坏菌丝端部生长而使其顶端细胞壁变薄,导致病原体死亡而降低病害发生[20]。苯丙氨酸解氨酶催化L-苯丙氨酸脱氨生成反式肉桂酸,进一步合成植保素、木质素和酚类等抗病性次生代谢物[21]。叶片是PAL酶活性高效表达的部位,PAL酶活性表达呈周期性变化,PAL酶活性与枯萎病抗性呈正相关[22]。本研究结果进一步证实,西瓜在苗期形成丛枝菌根,诱导表达的抗性相关酶基因,在移栽大田后表达量仍处于上调的水平,具有较高的抗枯萎病能力。主要有根系几丁质酶编码基因ClPR4、ClPR5上调(图2a,图2b),根系β-1,3葡聚糖酶编码的ClGlu1基因上调(图3a),以及编码PAL酶的ClPAL4基因在西瓜叶片及根系中的表达量均上调(图4a)。而且通过对菌根豌豆根系中病原菌Aphanomyces euteiches的肽酶活性和葡萄糖-6-磷酸脱氢酶活性的关系研究,证实了真菌提高植物的抗病性并不是减少了病原菌的生物量,而是抑制了病原菌酶的活性[23]。本研究进一步证实,培育丛枝菌根苗,西瓜移栽后能够保持抗病性,显著降低西瓜枯萎病发病率及病情指数(表2)。西瓜在发生枯萎病害时,组织内的相关抗病基因表达量提高,AM真菌的定殖也上调西瓜根系ClaPR4、ClaPR5、ClaGlu3和ClaPAL4的表达量,提高西瓜的抗病性。
3.2 促进植物矿质养分吸收,提高植物抗病性
AM真菌与植物根系共生可产生互惠互利的生态效应,其根外菌丝可增强对土壤养分和水分的吸收,尤其是有效提高了植物组织中的磷含量,提高植物抗逆性。植物磷营养的改善对植物的抗逆能力有显著的提高效果[24-25],丛枝菌根通过菌丝体促进根系对水分和土壤矿质养分的吸收[26],提高植物抗逆能力。酸性磷酸酶催化有机磷水解,产生植物可吸收的无机磷。植物根系酸性磷酸酶基因表达量上调,提高根系分泌酸性磷酸酶活性,进而增强根际土壤酸性磷酸酶活性,从而提高植物利用有机磷的能力[27]。本研究进一步证实,丛枝菌根化育苗显著提高根际土壤酸性磷酸酶活性(图6a),水解根际有机磷,提高根际土壤中磷的有效性,也提高了根际土壤中有效磷含量(图6b)。因此,培育丛枝菌根西瓜苗,在移栽后仍可有效提高西瓜根际土壤酸性磷酸酶活性,增强根系利用有机磷的能力,改善西瓜磷营养,从而提高西瓜抗枯萎病的能力。
3.3 其他可能机制
(1)抑制根际环境中的病原菌数量。番茄形成丛枝菌根,显著降低根际土壤中番茄专化型尖孢镰刀菌数量,有效防控番茄枯萎病[28]。(2)调控植物根际微生物区系结构。丛枝菌根育苗提高了西瓜根际土壤的孢子数(图7e),改善了根际微生物环境。
4 结 论
西瓜在发生枯萎病害时,AM真菌的定殖通过上调西瓜根系ClPR4、ClPR5、ClGlu3和ClPAL4的表达量,提高抗病相关酶活性,从而提高西瓜的抗病性;丛枝菌根育苗能够改善根际微生物环境,并通过提高根际土壤酸性磷酸酶活性促进难溶磷的水解,提高土壤有效磷含量,从而促进西瓜对养分的吸收,提高西瓜抗病能力,降低西瓜枯萎病发病指数,有效防控枯萎病。

