牦牛蹄筋胶原蛋白提取工艺优化
孙培利,谈花,王晓燕,曹效海,王树林,2*
(1.青海大学农牧学院,青海西宁810016;2.青海大学省部共建三江源生态与高原农牧业国家重点实验室,青海西宁810016)
胶原蛋白主要分布在动物皮肤及软骨组织中,占总蛋白质的25%~30%,I型胶原蛋白由3条α链组成,每条α链约由1 014个氨基酸组成,分布相对较广[1-3]。因胶原蛋白具有一定的功能特性,如低免疫原性、生物可分级性、生物相容性、亲水性、易加工性等[1],引起广大学者的兴趣,通过对其提取方法及理化性质的研究发现,胶原蛋白是一种可降解的生物材料,应用领域广泛[4],具有难以替代的生物学价值。
目前,关于胶原蛋白的提取工艺因原料或所需产品的性质而有所不同。Muralidharan等[5]用胃蛋白酶提取鲢鱼胶原蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electro-pheresis,SDS-PAGE)及微观结构表征其为Ⅰ型胶原蛋白。王晓军等[6]以牦牛骨为原料,提取酸溶性及酶溶性胶原蛋白,发现采用酶解法提取的牦牛骨胶原蛋白提取率较高。温慧芳等[7]通过碱法提取鮰鱼皮胶原蛋白,发现在料液比 1∶10(g/mL)、温度 70℃条件下,添加1.6%的氢氧化钙提取9 h,提取率高达79.67%。Kim等[8]采用超声辅助酸法提取鱼皮胶原蛋白,发现在0.1 mol/L乙酸介质中,以80%振幅处理鱼皮3 h与只添加乙酸处理相比,得率高出4.4倍。可见,胶原蛋白的提取方法各异,且提取材料多集中在鱼类加工副产物中,而对牦牛蹄筋胶原蛋白的提取鲜有报道。牦牛蹄筋作为烹饪原料,有悠久的食用历史[9],较高的胶原蛋白含量(约19%)使其成为获取胶原蛋白的原料之一。青海省在国内拥有牦牛数量最多,其牦牛蹄筋资源丰富,将其作为原料生产胶原蛋白,具有广阔的市场前景。
本试验以牦牛蹄筋为原料,采用热水法及酶解法提取牦牛蹄筋胶原蛋白,优化提取工艺,获得最佳提取方法,旨在充分利用青海牦牛蹄筋资源,为牦牛蹄筋新资源的开发提供新的方法及研究数据。
1 材料与方法
1.1 材料与试剂
青海牦牛蹄筋:青海百德食品有限公司;胃蛋白酶(200 U/mg):河南三化生物科技有限公司;L-羟脯氨酸(纯度>99%):中国食品药品检定研究院;高氯酸:天津政成化学制品有限公司;氯胺T:福晨化学试剂有限公司;氢氧化钠:天津市河东区红岩试剂厂;正丁醇:天津市凯通化学试剂有限公司;对二甲氨基苯甲醛:天津市瑞金特化学品有限公司;硫酸:江苏彤晟化学试剂有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
冷冻干燥机(CS55-9):北京博医康仪器有限公司;紫外可见分光光度计(UV-1780):岛津企业管理有限公司。
1.3 试验方法
1.3.1 牦牛蹄筋胶原蛋白提取工艺
牦牛蹄筋→预处理→去杂→脱脂→提取→离心→盐析→离心→透析→冷冻干燥→成品
1.3.2 关键操作点
1.3.2.1 样品预处理
牦牛蹄筋样品的处理参照卢静等[10]的方法。将冷冻牦牛蹄筋解冻,切碎后加入NaOH溶液,浸泡除去杂蛋白和部分色素,用蒸馏水洗至中性,加入正丁醇进行脱脂处理,用蒸馏水洗至中性,充分沥干备用。
1.3.2.2 热水法提取牦牛蹄筋胶原蛋白
热水法提取牦牛蹄筋胶原蛋白参照温慧芳等[11]的方法。
1.3.2.3 酶解法提取牦牛蹄筋胶原蛋白
酶解法提取牦牛蹄筋胶原蛋白参照王杉杉[4]的方法。
1.3.3 提取方法的比较研究
试验采用热水法和酶解法对牦牛蹄筋中胶原蛋白进行提取。均进行3次平行试验,通过测定胶原蛋白得率、提取率及纯度,比较两种提取方法的差异,筛选适宜的提取方法。
1.3.4 酶解法提取牦牛蹄筋胶原蛋白工艺单因素试验
按1.3.2.3酶解法,固定牦牛蹄筋胶原蛋白料液比1∶15(g/mL),温度 37 ℃,时间 12 h,加酶量 3%,调节pH 3,以牦牛蹄筋胶原蛋白得率、提取率及纯度为测定指标,考察料液比[1∶10、1∶15、1∶20、1∶25、1∶30(g/mL)]、温度(35、37、39、41、43 ℃)、时间(6、9、12、15、18 h)和加酶量(1%、2%、3%、4%、5%)对牦牛蹄筋胶原蛋白提取工艺的影响。
1.3.5 酶解法正交试验
在单因素试验基础上,选择料液比、温度、时间和加酶量为因素,以牦牛蹄筋胶原蛋白得率、提取率及纯度为指标,对酶解法提取牦牛蹄筋胶原蛋白工艺进行L9(34)正交优化试验,因素水平见表1。

表1 酶解法提取牦牛蹄筋胶原蛋白正交试验因素水平设计Table 1 Factor and level of orthogonal test for extracting collagen by enzyme digestion
1.4 指标的测定方法
1.4.1 胶原蛋白得率计算
获得的胶原蛋白粗品与提取原料的比值即为胶原蛋白得率。计算公式如下。

1.4.2 胶原蛋白提取率计算
L-羟脯氨酸含量的测定参照GB/T 9695.23—2008《肉与肉制品羟脯氨酸含量测定》[12]。以L-羟脯氨酸标准品浓度为横坐标,吸光度为纵坐标绘制标准曲线,得出L-羟脯氨酸浓度与吸光值的回归方程为y=0.1438x+0.092(R2=0.999)。
胶原蛋白提取率按公式(2)、(3)、(4)计算。
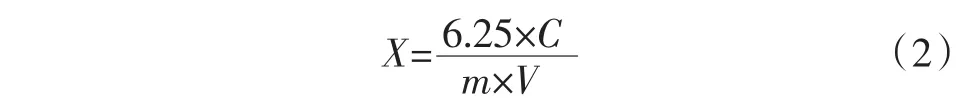
式中:X为试样中羟脯氨酸的含量,%;C为试样中羟脯氨酸的浓度,μg/mL;m为称取试样的质量,g;V为滤液体积,mL。

1.4.3 胶原蛋白纯度测定
胶原蛋白纯度计算公式如公式(5)。

1.5 数据处理
使用Excel 2010和Spss 20.0进行数据统计分析。试验结果用“平均值±标准差”表示。
2 结果与分析
2.1 提取方法的筛选
热水法和酶解法提取牦牛蹄筋胶原蛋白结果如图1所示。
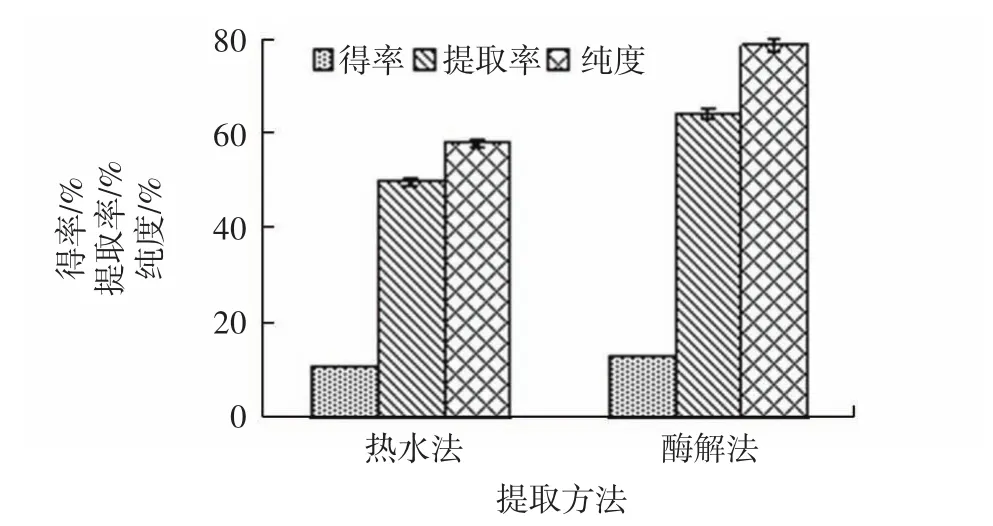
图1 不同提取方法下胶原蛋白的得率、提取率及纯度Fig.1 Yield,extraction rate and purity of collagen under different extraction methods
结果显示,酶解法和热水法提取的胶原蛋白得率分别为10.62%、12.91%,其中酶解法获得的胶原蛋白的提取率及纯度分别为63.94%、78.44%,热水法获得的胶原蛋白的提取率及纯度分别为49.67%、57.78%。热水法提取温度超过40℃,部分胶原蛋白变性成为明胶且发生水解,使胶原蛋白提取率和纯度均有明显降低[14]。而酶解法提取条件温和,仅水解胶原蛋白非螺旋结构区域,提取效果较好[15]。Jeong等[16]研究发现胃蛋白酶能够特异性地切割蛇头鱼鳞的胶原端肽区,这也可能是酶解法的提取率及纯度较高的原因。综合上述分析,选取酶解法进行下一步试验。
2.2 酶解法提取胶原蛋白工艺单因素试验
2.2.1 料液比对牦牛蹄筋胶原蛋白提取效果的影响
不同料液比对胶原蛋白得率的影响见图2。
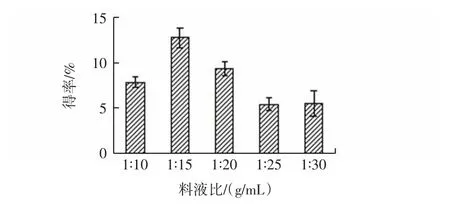
图2 不同料液比对胶原蛋白得率的影响Fig.2 Effect of different ratios of solid-to-liquid ratios on collagen yield
由图2可见,牦牛蹄筋胶原蛋白得率随溶剂体积增加整体呈先升高后降低趋势,当料液比为1∶15(g/mL)时,得率最高为12.83%。由于加酶量与牦牛蹄筋质量一定,当料液比从 1∶10(g/mL)到 1∶15(g/mL)时,酶能够充分与底物接触,从而使牦牛蹄筋胶原蛋白得率增加,而当溶剂体积继续增加,体系中的酶被过度稀释,不能与底物充分结合,导致牦牛蹄筋胶原蛋白得率下降,这与王锡念等[17]的研究结果相似。
不同料液比对胶原蛋白提取率和纯度的影响见图3。

图3 不同料液比对胶原蛋白提取率及纯度的影响Fig.3 Effect of different solid-to-liquid ratios on collagen extraction rate and purity
由图3可知,牦牛蹄筋胶原蛋白提取率及纯度随溶剂体积的增加均呈先上升后下降趋势,在料液比为1∶15(g/mL)时,提取率和纯度均达到最大值,分别为64.09%,78.94%。宋乐等[18]对骆驼掌胶原蛋白的提取中同样发现,当料液比为1∶15(g/mL),提取率最高。可见,过高的溶剂体积不利于胶原蛋白的提取。综上结果分析,在牦牛蹄筋胶原蛋白提取过程中料液比应控制在1∶15(g/mL)左右。
2.2.2 温度对牦牛蹄筋胶原蛋白提取效果的影响
温度对牦牛蹄筋胶原蛋白得率的影响见图4。
由图4可见,随着温度升高胶原蛋白得率呈上升趋势。何云等[19]研究发现用胃蛋白酶提取鮟鱇鱼骨胶原蛋白时,当提取温度超过40℃,胶原蛋白含量急剧下降,与该试验结果相反。可能是因为随着温度升高,反应速率增加,使牦牛蹄筋中其它非胶原物质溶出。

图4 不同温度对胶原蛋白得率的影响Fig.4 Effect of different temperatures on collagen yield
温度对牦牛蹄筋胶原蛋白提取率和纯度的影响见图5。

图5 不同温度对胶原蛋白提取率及纯度的影响Fig.5 Effect of different temperature on collagen extraction rate and purity
由图5可见,胶原蛋白提取率及纯度随着温度增加呈先上升后趋于平缓趋势。当温度为41℃时,胶原蛋白提取率达到65.07%;而当温度为39℃时,胶原蛋白纯度最大,为70.69%。可见提取率和纯度最优值不在同一温度条件下。研究发现胃蛋白酶的最适作用温度在40℃左右[17],酶促反应受温度的影响较大,温度过高或过低会影响酶活性及反应速率[20]。当温度为41℃时,胃蛋白酶活性较高,因此使胶原蛋白提取率增加。Muyonga等[21]研究发现,生活在寒冷环境中的鱼类的胶原蛋白羟脯氨酸含量低,热稳定性差。牦牛生活环境寒冷,因此其胶原蛋白热稳定性可能较低,温度的升高会使胶原蛋白易发生降解。相关研究表明胶原蛋白在较高的温度下结构发生变化,进而使胶原蛋白结构中的α-肽链被切断,产生多肽[22],致使胶原蛋白纯度下降。综上结果分析,牦牛蹄筋胶原蛋白提取温度控制在41℃时较为适宜。
2.2.3 时间对牦牛蹄筋胶原蛋白提取效果的影响
时间对牦牛蹄筋胶原蛋白得率的影响见图6。
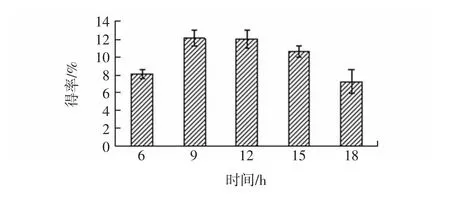
图6 不同时间对胶原蛋白得率的影响Fig.6 Effect of different time on collagen yield
由图6可见,随着时间延长胶原蛋白得率呈先上升后下降的变化趋势,在9 h时牦牛蹄筋胶原蛋白得率最大,为12.09%。研究报道,胶原蛋白的等电点在pH6~9之间[23],表明胶原蛋白在微酸性及碱性体系中溶解度相对较大[24],当时间超过12 h时,提取出的胶原蛋白在酸性环境中复溶于提取液,并在酶的作用下降解,在透析过程中流失[6],从而使胶原蛋白得率降低。
时间对牦牛蹄筋胶原蛋白提取率和纯度的影响见图7。
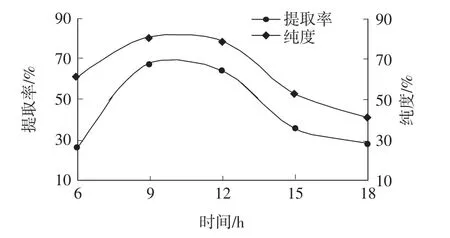
图7 不同时间对胶原蛋白提取率及纯度的影响Fig.7 Effect of different time on collagen extraction rate and purity
由图7可见,随着时间延长,胶原蛋白提取率及纯度均呈先升高后降低的趋势。当时间9 h时,提取率和纯度均达到最大,分别为66.92%、79.69%。原因可能是,随着提取时间的延长,提取出的胶原蛋白被水解为胶原蛋白肽。同时,牦牛蹄筋胶原蛋白中羟脯氨酸的含量较高[25],长时间的水解可能对羟脯胺酸产生不利的影响[7],从而导致牦牛蹄筋胶原蛋白提取率及纯度降低。综合上述分析,并结合实际能源节约问题,牦牛蹄筋胶原蛋白在提取过程中酶解时间应控制在9 h时较为适宜。
2.2.4 加酶量对牦牛蹄筋胶原蛋白提取效果的影响
加酶量对牦牛蹄筋胶原蛋白得率的影响见图8。
由图8可见,随着加酶量增加,牦牛蹄筋胶原蛋白得率总体呈先升高后降低趋势,在加酶量为2%时,得率最高为15.05%。原因可能是:当所添加的酶与底物充分反应后,继续增加酶的量,只会将所得的胶原蛋白降解,并不能提高其得率。
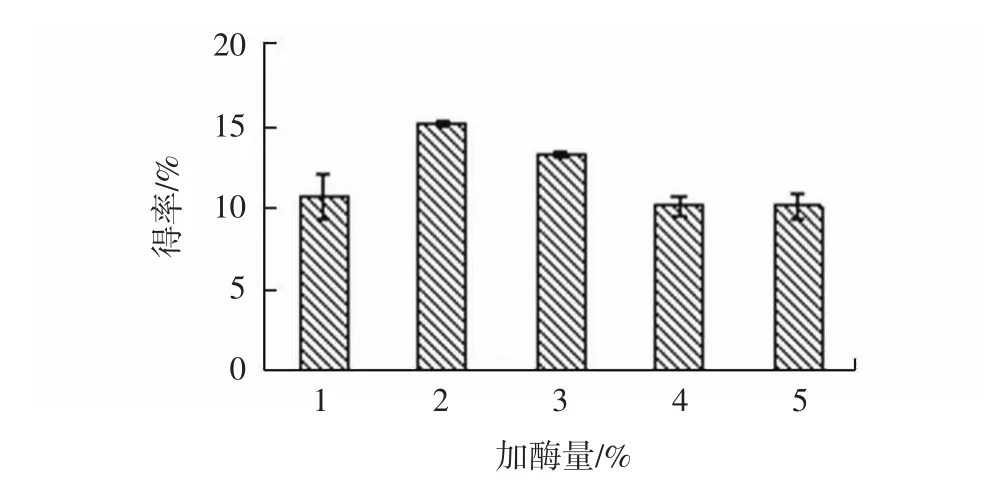
图8 不同加酶量对胶原蛋白得率的影响Fig.8 Effect of different enzyme additions on collagen yield
加酶量对牦牛蹄筋胶原蛋白提取率及纯度的影响见图9。
由图9可见,提取率及纯度均呈现先升高后下降的趋势。当加酶量在2%~3%时,提取率分别为64.93%、63.41%,之后迅速下降;纯度分别为79.16%、78.45%,之后迅速下降。这可能是由于在提取过程中,持续增加胃蛋白酶量可能导致酶相互附着,降低胃蛋白酶与底物的传质效率[26],影响胶原蛋白的溶解提取,同时会破坏胶原蛋白的三螺旋结构[27],使提取的牦牛蹄筋胶原蛋白发生酶解,产生低分子量的肽,从而使胶原蛋白提取率及纯度下降[28]。综合上述分析,在牦牛蹄筋胶原蛋白提取过程中,加酶量应控制在2%较为适宜。
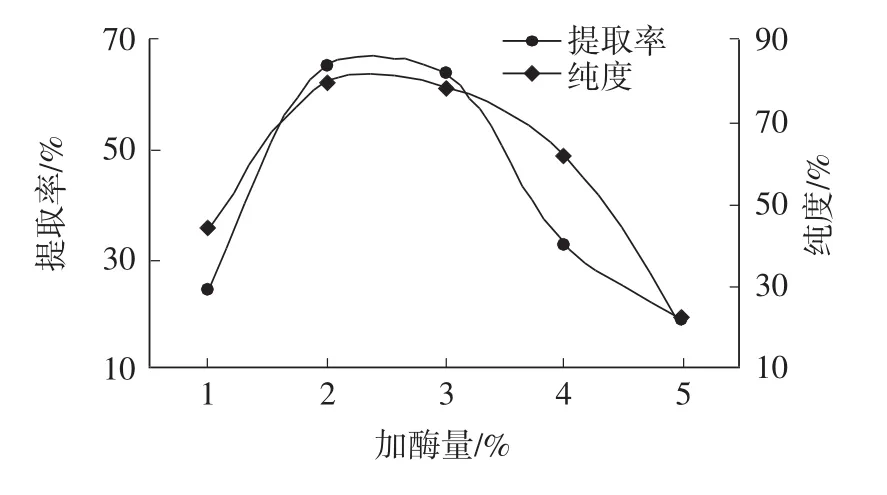
图9 不同酶添加量对胶原蛋白提取率及纯度的影响Fig.9 Effect of different enzyme addition on collagen extraction rate and purity
2.3 正交试验结果
酶解法提取牦牛蹄筋胶原蛋白正交试验结果见表2。
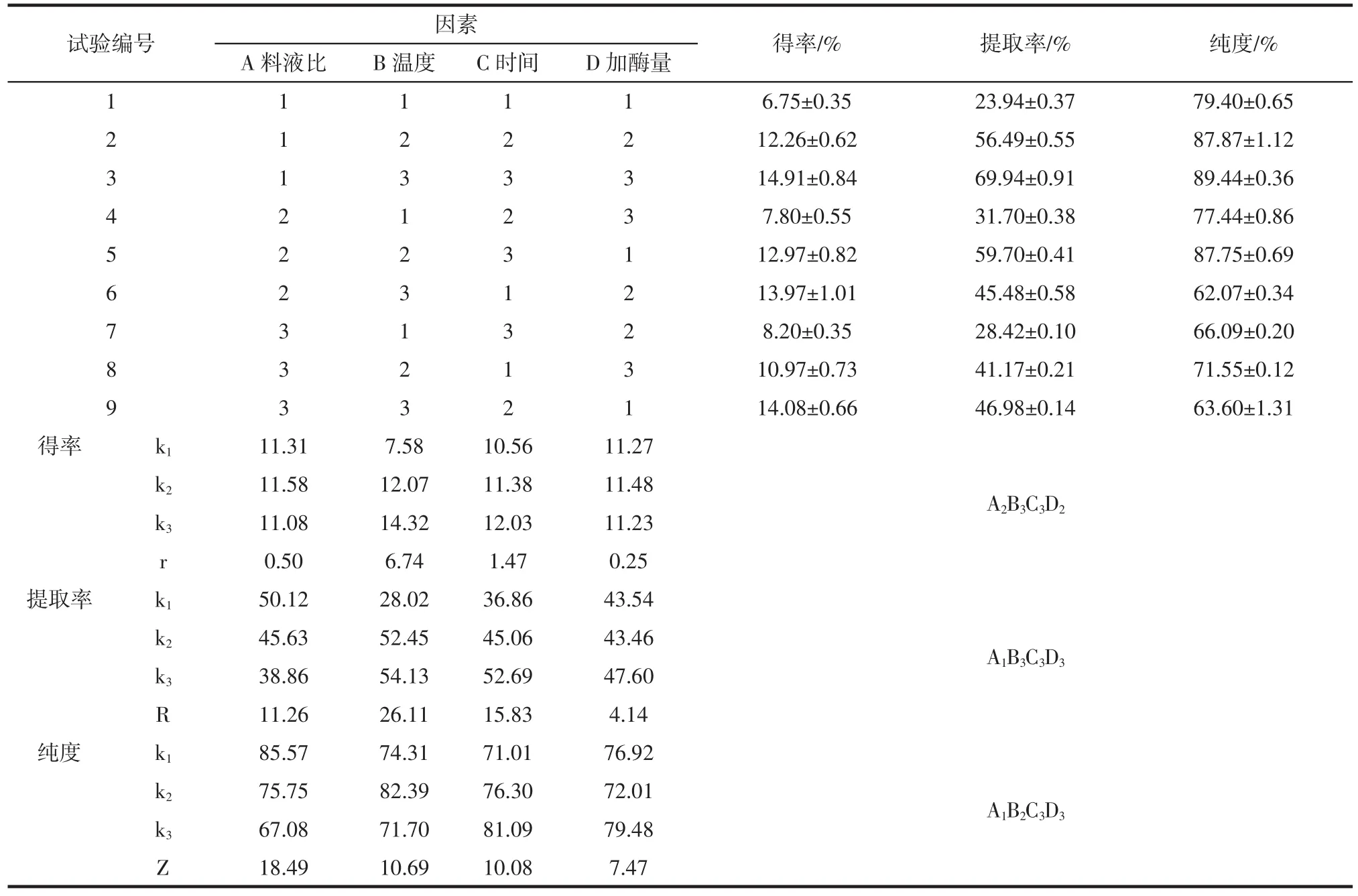
表2 酶解法提取牦牛蹄筋胶原蛋白正交试验结果分析Table 2 Results of orthogonal test for extraction of yak tendon collagen by enzymolysis
以牦牛蹄筋胶原蛋白得率、提取率及纯度为考察指标,由极差分析得,各因素对胶原蛋白得率影响大小为 rB>rC>rA>rD,最优提取工艺 A2B3C3D2;各因素对胶原蛋白提取率影响大小为RB>RC>RA>RD,最优提取工艺A1B3C3D3;各因素对胶原蛋白纯度影响大小为ZA>ZB>ZC>ZD,最优提取工艺 A1B2C3D3。 可见各因素对牦牛蹄筋胶原蛋白得率、提取率及纯度的影响大小有差异,最优提取工艺也不相同。由极差分析数据可知,加酶量对牦牛蹄筋胶原蛋白得率、提取率、纯度的影响均最小,综合考虑,选择牦牛蹄筋胶原蛋白提取最优工艺组合为A1B3C3D3,即加酶量2.5%,料液比1∶12(g/mL),温度 43 ℃,时间 11 h,胶原蛋白的得率、提取率及纯度分别为14.91%、69.94%和89.44%。
2.4 验证试验
为进一步确定酶解法提取牦牛蹄筋最佳工艺条件,对正交试验的提取工艺组合A1B3C3D3进行3次重复试验,结果表明,牦牛蹄筋胶原蛋白平均提取率为(69.82±0.32)%,得率为(15.11±0.85)%,纯度为(89.95±1.16)%。
3 结论
从牦牛蹄筋胶原蛋白得率、提取率和纯度可以看出酶解法更有利于提取牦牛蹄筋胶原蛋白。通过正交优化试验发现,酶解法的最佳工艺条件为:料液比1∶12(g/mL)、温度 43℃、时间 11 h、加酶量 2.5%,此时的平均提取率为(69.82±0.32)%,得率为(15.11±0.85)%,纯度为(89.95±1.16)%。料液比、温度、时间、加酶量等因素影响胶原蛋白的提取,因此在试验过程中应严格把控酶解条件,以获得更高的胶原蛋白提取率。试验所建立的工艺流程为高原牦牛蹄筋中深加工胶原蛋白的规模化生产提供了有力依据。

