癫痫发作的新皮质中差异表达基因生物信息分析
彭金香,吴 沣
癫痫是最常见的慢性神经系统疾病之一,是一种复杂性疾病,主要原因为遗传因素和环境因素(如癫痫家族史、神经性合并症、早产、母亲酗酒、妊娠期吸烟等)[1]。我国癫痫患病率为0.68%,近1 000万名癫痫病人中有20%~30%为药物难治性癫痫[2]。寻找候选生物标志物及致病机制对于癫痫的早期诊断和有效治疗极为重要。转录组学是寻找癫痫候选生物标志物及致病机制的有效方法之一。一些学者针对癫痫发作开展了一系列转录组学研究[3-8]。本研究通过提取基因芯片公共数据库(GEO)中的相关数据,利用GE02R、DAVID及STRING等分析平台对癫痫发作新皮质中的相关差异表达基因(DEGs)及信号通路进行分析,探讨新皮质在癫痫发作中所发挥的作用。
1 资料与方法
1.1 芯片数据及分组 以“epilepsy”作为搜索词,进入美国国立生物中心的 GEO 数据库(https:www.ncbi.nlm.nih.gov/geo)中搜索已公布的epilepsy基因芯片数据集,获取一个来自日本群马大学医学研究生院的数据集GSE6388。该数据集包含6只尼古丁诱导癫痫发作小鼠的新皮质及6只对照健康小鼠的新皮质,所有小鼠均采用Affymetrix Murine Genome U74A Version 2 Array芯片分析大脑新皮质的基因表达谱。本研究选取该数据集中尼古丁诱导小鼠癫痫发作的新皮质组及对照健康小鼠的新皮质组。通过将尼古丁诱导癫痫发作小鼠的新皮质组及对照健康小鼠的新皮质组进行比较以获取DEGs。
1.2 DEGs的筛选及分析 采用GEO数据库提供的GE02R芯片分析平台对6只尼古丁诱导癫痫发作小鼠的新皮质及6只对照健康小鼠的新皮质芯片数据进行预处理,并用贝叶斯分析法对出生后第30天癫痫发作小鼠的新皮质中DEGs进行筛选。差异基因筛选条件为P<0.05且logFC>1。利用DAVID6.8(https://david.ncifcrf.gov/tools.jsp)分析平台[9]对DEGs进行基因本体(GO)分析和京都基因与基因组百科全书(KEGG)信号通路分析。
1.3 候选基因直接与癫痫致病性的基因相互作用 选取尼古丁诱导小鼠癫痫发作的新皮质组差异基因和癫痫致病性的基因构建网络,最后利用STRING11.0(https://string-db.org/)分析平台进行蛋白-蛋白相互作用(PPI)网络分析,分析结果采用cytoscape 3.7.1软件绘制相互作用网络图,并利用BiNGO模块分析相关的生物学过程[10]。
2 结 果
2.1 DEGs筛选结果 与对照组比较,出生后第30天尼古丁诱导小鼠癫痫发作的新皮质组共筛选出214个DEGs,其中95个上调基因及119个下调基因,前10个上调基因及下调基因见表1、表2。
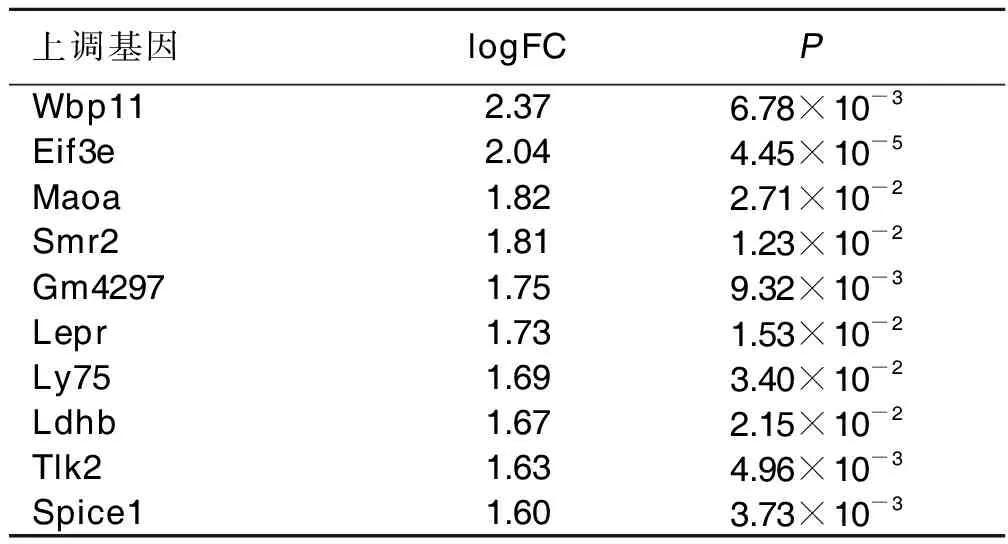
表1 尼古丁诱发小鼠癫痫发作的新皮质组中前10个上调基因
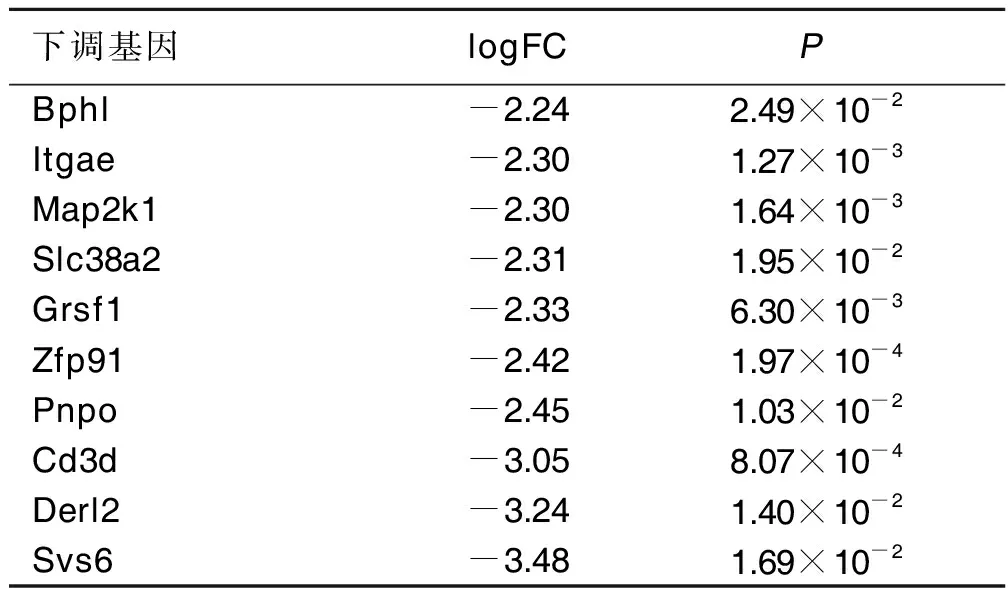
表2 尼古丁诱发小鼠癫痫发作的新皮质组中前10个下调基因
2.2 GO分析和KEGG信号通路分析 将尼古丁诱导小鼠癫痫发作的新皮质组和对照健康小鼠的新皮质组DEGs进行GO分析(P<0.05),发现高表达基因细胞组分显示,主要定位于核染色体、核小体、细胞间黏附连接、染色质等。生物学过程显示,主要集中在基因沉默、胞嘧啶上的DNA甲基化、DNA复制偶联的核小体组装等方面;分子功能显示,主要为核小体DNA结合、钙黏附素参与细胞黏附等(见表3);对低表达的基因细胞组分显示,主要定位于细胞质膜外、血微粒、次级内体等。生物学过程显示,主要集中在细胞凋亡过程的调控、RNA聚合酶Ⅱ启动子转录的调控等方面;分子功能显示,主要为DNA结合等方面(见表4)。
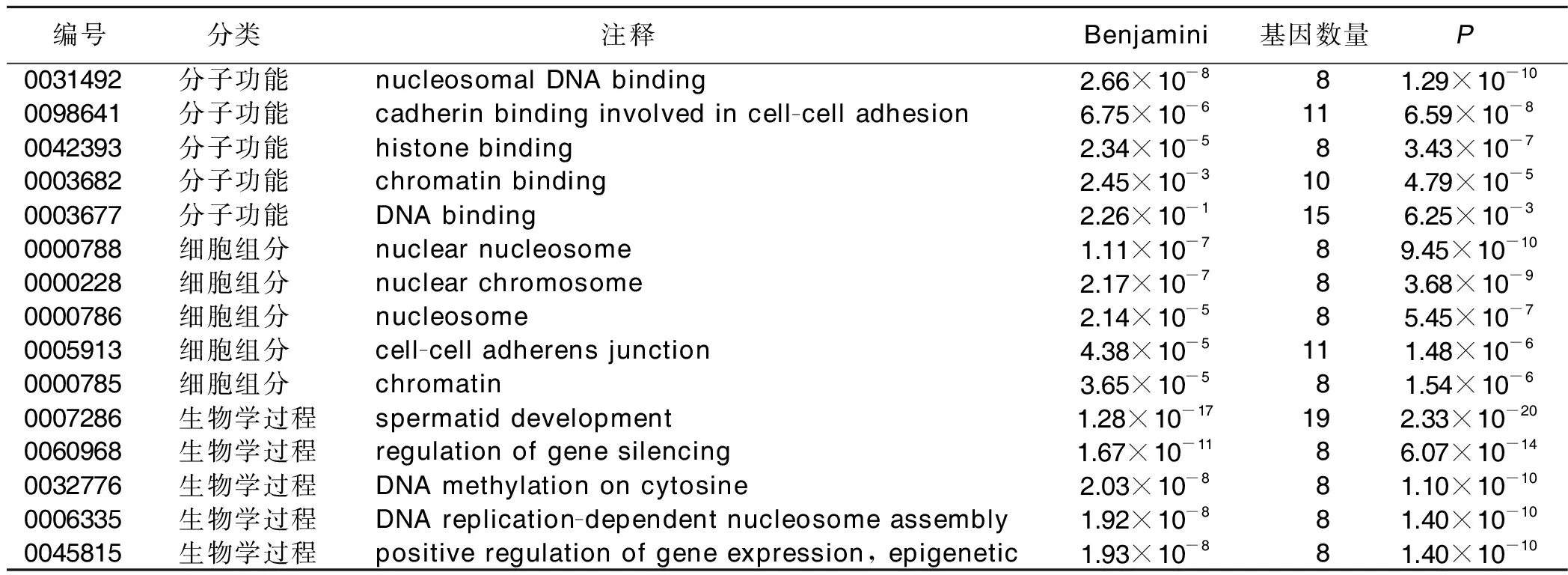
表3 尼古丁诱导小鼠癫痫发作的新皮质组和对照健康小鼠的新皮质组DEGs的GO分析

表4 尼古丁诱发小鼠癫痫发作的新皮质中基因低表达的GO分析
将尼古丁诱导小鼠癫痫发作的新皮质组和对照健康小鼠的新皮质组DEGs进行KEGG分析,结果显示,对高表达的基因主要富集在细胞因子-细胞因子受体相互作用、刺激神经组织的配体受体相互作用通路(见表5);低表达的DEGs主要富集在核转录因子-κB(NF-κB)信号通路、T细胞受体信号通路(见表6)。

表5 尼古丁诱发小鼠癫痫发作的新皮质中基因高表达信号通路分析

表6 尼古丁诱发小鼠癫痫发作的新皮质中基因低表达信号通路分析
2.3 蛋白相互作用网络分析 从Nature杂志子刊Genetics in Medicine中检索癫痫致病性基因[11]。将尼古丁诱导小鼠癫痫发作的新皮质214个DEGs及癫痫致病性的27个基因导入STRING平台并分析构建蛋白相互作用网络,得到228个节点、399条关系。将上述蛋白相互作用网络导入cytoscape 3.7.1软件中,结果显示37个DEGs与癫痫明确致病性基因有相互作用,分别是Vsx2、Vegfc、Try5、Try4、Tnfaip3、Tlk2、Spta1、Slc38a2、Sfn、Rps26、Rpl38、Rgs9、Ptpn5、Pnpo、Pax3、Neurog1、Map2k1、Lhx8、Lepr、Klf4、Kifap3、Kcnmb1、Kcna5、Huwe1、Eif5a、Egfr、Cd3d、Calca、Braf、Bcl2l11、Gns、Irf1、Sall4、Dntt、Pign、Decr1、Ldhb。与癫痫致病性基因节点最多的6个DEGs分别是Spta1、Rps26、Ptpn5、Pnpo、Huwe1、Egfr,DEGs所编码的蛋白与其他蛋白存在广泛的相互作用(见图1)。通过cytoscape 3.7.1软件的BiNGO模块分析该相互作用网络,提示其与细胞骨架蛋白的调控、肌动蛋白丝聚合的调节等生物学过程相关。

图1 癫痫致病性基因与27个DEGs的网络相互作用
3 讨 论
本研究利用已报道的GEO芯片数据集进行分析,并通过提取该数据集中6只尼古丁诱导癫痫发作小鼠的新皮质及6只对照健康小鼠的新皮质基因表达谱。分析尼古丁诱导小鼠癫痫发作的新皮质差异基因。本研究成功筛选出的214个差异基因,其中95个上调基因及119个下调基因。DEGs细胞组分显示,主要定位于核染色体、核小体、细胞间黏附连接、染色质、细胞质膜外、血微粒、次级内体等。生物学过程显示,主要集中在基因沉默、胞嘧啶上的DNA甲基化、DNA复制偶联的核小体组装、细胞凋亡过程的调控、RNA聚合酶Ⅱ启动子转录的调控等方面。分子功能显示,主要为核小体DNA结合,钙黏附素参与细胞黏附、DNA结合等方面。对DEGs进行KEGG分析,结果提示DEGs主要富集在细胞因子-细胞因子受体相互作用、刺激神经组织的配体受体相互作用通路、NF-κB信号通路、T细胞受体信号通路。
通过尼古丁诱导小鼠癫痫发作的新皮质214个DEGs与癫痫致病性基因构建蛋白相互作用网络,共有228个节点、399条关系,最终有37个DEGs与癫痫明确致病性基因有相互作用,其中与癫痫致病性基因节点最多的6个DEGs分别是Spta1、Rps26、Ptpn5、Pnpo、Huwe1、Egfr,并提示其与细胞骨架蛋白的调控、肌动蛋白丝聚合的调节等生物学过程相关。对这些基因进行文献挖掘,其中Pnpo、Egfr与癫痫的发生发展密切相关[12-13]。表皮生长因子受体(EGFR,ErbB1)属于受体酪氨酸激酶家族,酪氨酸激酶是胚胎和肿瘤发展的关键调节剂。使用EGFR基因敲除小鼠和缺乏EGFR小鼠,通过两种不同的Cre系(Nestin-Cre和GFAP-Cre)来阐明EGFR在大脑中的功能。缺乏EGFR小鼠会在出生后早期出现额叶皮层和嗅球变性,并显示皮质星形胶质细胞凋亡增加。EGFR基因敲除小鼠的不良健康状况和早期致死性阻止了成年大脑中EGFR神经变性。尽管条件等位基因进行了基因重组,但与EGFR基因敲除小鼠相比,大脑中缺乏EGFR的小鼠显示出较低的皮层变性穿透性。成年大脑中缺乏EGFR小鼠建立了适当的血脑屏障,并对机械性和感染性脑损伤做出反应性星形胶质变,但对海因酸引起的癫痫发作更敏感。缺乏EGFR的皮质星形胶质细胞(而非中脑星形胶质细胞)谷氨酸转运蛋白Glt1和Glast的表达降低。
癫痫可由脑内的神经元细胞死亡和神经胶质反应性引起[14-18]。VEGF-C和VEGFR-3在多种疾病中上调,包括心肌梗死、自身免疫性脑脊髓炎、缺血性中风和癫痫[19-21]。Cho等[22]研究了毛果芸香碱诱导C57BL/6N小鼠癫痫持续状态(SE)的VEGF-C和其受体VEGFR-3的时空表达。小鼠癫痫持续状态1 d后,海马星形胶质细胞和小胶质细胞被激活。小鼠癫痫持续状态4 d后观察到金字塔形神经元死亡。在锥体束下层区域,VEGF-C表达在小鼠癫痫持续状态7 d后逐渐增加并达到峰值,而VEGFR-3在小鼠癫痫持续状态4 d后明显上调,并在癫痫持续状态7 d后开始下降。多数表达VEGF-C/VEGFR-3的细胞是锥体神经元。但是,在小鼠癫痫持续状态4 d和7 d后,VEGFR-3和VEGF-C的免疫反应性主要发生在星形胶质细胞中以及在放射状层的某些小胶质细胞和海马的腔隙小分子中。这些数据表明,毛果芸香碱诱发的癫痫持续状态后海马星形胶质细胞和小胶质细胞中VEGF-C和VEGFR-3的表达上调。
颞叶癫痫是成人局灶性顽固性癫痫的常见形式。为了确定VEGF-C及其受体是否参与颞叶癫痫的发生,Sun等[23]研究了28例颞叶癫痫病人和10例对照病人在颞新皮层和海马中VEGF-C及其受体的水平和表达模式,结果显示,与对照组相比,颞叶癫痫组VEGF-C、VEGFR-2和VEGFR-3的mRNA和免疫反应蛋白水平上调。VEGF-C在神经元和星形胶质细胞(包括反应性星形胶质细胞和血管内皮细胞)中高表达,VEGFR-2在反应性星形胶质细胞和血管内皮细胞中高表达,在神经元中不表达,而VEGFR-3仅在反应性星形胶质细胞中过表达。
本研究首次应用生物信息学的方法对尼古丁诱导小鼠癫痫发作的新皮质中相关基因进行分析,上述研究结果证实了部分关键基因在癫痫病理生理等方面的作用,但关于Spta1、Rps26、Ptpn5、Huwe1基因在癫痫中作用的报道较少,仍需要对这些相关基因进一步深入研究。

