微小RNA-124-3p对自发性高血压大鼠心肌线粒体功能和PI3K/AKT信号通路的调控作用
吴哲,邹彩霞,廖锋
高血压导致的心肌细胞超负荷工作会引起心室重塑、心脏肥大等影响射血功能,甚至发展为心力衰竭。目前关于高血压引起的心肌细胞损伤的机制仍不清楚[1]。ATP是心肌细胞的主要能量来源,由线粒体产生。当心肌细胞超负荷工作时会导致活性氧自由基的累积激活线粒体凋亡途径,导致心肌细胞损伤和凋亡[2]。PI3K/AKT对高血压造成的器官损伤具有保护作用,研究显示PI3K/AKT通路过表达可抑制缓解血管紧张素诱导的H9c2心肌母细胞凋亡[3]。研究显示PI3K/AKT通路通过缓解线粒体损伤抑制心肌细胞凋亡[4]。微小RNA(miRNA)是一种长度约为22个核苷酸长度的、高度保守的单链RNA,可在转录后的水平上导致信使RNA(mRNA)的降解或者翻译抑制[5]。最新研究显示miR-124-3p通过抑制PI3K/AKT通路诱导膀胱癌细胞的凋亡[6]。研究显示抑制miR-124-3p可通过抑制心肌细胞的凋亡来缓解急性心肌梗塞[7]。本文分析miR-124-3p在自发性高血压(SHR)大鼠心肌线粒体凋亡中的作用及其对PI3KAKT信号通路的调控机制。
1 主要材料与方法
1.1 主要实验材料SHR大鼠(45只)和健康的同源性WKY大鼠(15只)雄性SPF级,190~210 g,上海斯莱克实验动物中心,中国。miR-124-3p激动剂(agomir)和抑制剂(antagomir),广州瑞博生物技术有限公司。HE染色试剂盒(C0105S)、ELISA和TUNEL染色试剂盒来自(碧云天公司,中国)。Hoechst 33258(Sigma,美国)。RNAspin Mini和miRNeasy Mini试剂盒(GE Healthcare,美国)。Bestar qPCR RT和Bestar™qPCR试剂盒(DBI Bioscience公司,德国)。TaqMan miRNA试剂盒(Thermo Fisher公司,美国)。抗体、一抗和山羊抗免疫球蛋白G(IgG)二抗(1:1000稀释,#ab6721)购于(Abcam公司,美国)。硝酸纤维素膜(EMD Millipore,美国)。ECL 显色试剂盒(Thermo Fisher公司,美国)。显微镜(Carl Zeiss公司,德国)。心肌细胞H2c9(ATCC,美国)。DMEM培养基和抗体(Gibco公司,美国)。Lipofectamine®3000(Invitrogen公司,USA)。pGL4荧光素酶载体(Promega公司,美国)。miR-124-3p类似物(mimic)、相应的阴性对照(NC)、快速定点诱变试剂盒和Renilla荧光素酶质粒(Thermo Fisher公司,美国)。荧光素酶报告试剂盒和检测仪1000 System(Promega公司,美国)。
1.2 分组45只大鼠分为SHR组、SHR+miR-124-3p agomir和SHR+miR-124-3p antagomir组(eachn=15),另选15只健康大鼠作为对照组。SHR+miR-124-3p agomir和SHR+miR-124-3p antagomir分别尾静脉注射miR-124-3p agomir和miR-124-3p antagomir,以提高和抑制心肌细胞中miR-124-5p的水平[8],300 μg/次,连续4周。
1.3 检测指标和方法
1.3.1 RT-qPCR对于PI3K和AKT mRNA,使用RNeasy Mini试剂盒取心肌组织中的总RNA,Bestar qPCR RT试剂盒将其逆转转录为cDNA,条件如下:37℃/15 min;98℃/5 min,使用Bestar™qPCR预混液进行qPCR实验,条件如下:95℃/2 min,94℃/20 s,58℃/20 s,72℃/20 s,40个循环,在72℃下延伸4 min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。通过比较循环阈值并以GAPDH作为内参计算PI3K和AKT mRNA相对表达水平。
对于miR-124-3p,使用miRNeasy Mini试剂盒提取总miRNA,通过TaqMan miRNA反转录试剂盒形成cDNA。然后使用TaqMan miRNA分析试剂盒测量miRNA的表达水平。比较循环阈值并以U6作为内参计算miR-124-3p相对表达水平。
1.3.2 ELISA检测血清指标应用ELISA检测心肌酶指标。大鼠安乐死前采集尾静脉血液样本,离心(2000 rpm,20 min)后收集上层血清。根据说明书加入抗体和显色剂,酶标仪检测450 nm处吸光度,根据标准曲线计算乳酸脱氢酶(LDH)、肌酸激酶同工酶(CK-MB)浓度。
1.3.3 HE染色评估心肌细胞损伤大鼠安乐死后去除心肌组织,在10%福尔马林中固定48 h,经过脱蜡、包埋、切片,切片水化后制成玻片标本,加入苏木精孵育5 min,0.5%伊红染色5 min,洗涤后透化,固定,在显微镜下观察。
1.3.4 TUNEL检测凋亡将1.3.2中切片脱蜡并与蛋白酶K孵育。按TUNEL试剂盒说明书进行染色,Hoechst 33258对细胞核复染。复染后荧光显微镜下观察拍照,凋亡细胞呈荧光绿色,200倍放大,随机选择10个视野计数。
1.3.5 Western blot检测线粒体凋亡相关蛋白将心肌组织裂解后收集总蛋白。通过8%的SDSPAGE分离每个样品中等量(50 μg)的蛋白质,将其转移到硝酸纤维素膜上。将5%脱脂牛奶完全浸没硝酸纤维素膜来封闭非特异性抗原(室温下2 h),将膜与分别与一抗(1:800稀释)4℃孵育过夜,将山羊抗免IgG二抗按照1:2000比例稀释在室温下孵育1 h进行反应。化学发光试剂显示,使用Quantum One软件分析灰度计算细胞色素C(Cyt C)、caspase9、cleaved-caspase3、PI3K和AKT蛋白相对于GAPDH的表达量。
1.4 细胞实验验证miR-124-3p和PI3K的靶向关系
1.4.1 双荧光素酶报告miR-124-3p和PI3K的碱基结合位点通过工具网站得到(http://www.targetscan.org/vert_72/)。对于PI3K与miR-124-3p靶向的验证,将野生型(wt-)的PI3K mRNA的3’-UTR序列扩增到pGL4荧光素酶载体的下游位点,使用快速定点诱变试剂盒生成突变型(mut-)PI3K。将H2c9细胞以3×104/孔的密度接种在24孔板中,24 h后,使用Lipofectamine®2000将1 μg的wt-PI3K或mut-PI3K荧光素酶质粒、50 nM的miR-124-3p mimic或 miR-124-3p NC、150 ng的Renilla荧光素酶质粒转染进入细胞。将细胞在37℃下孵育36 h。使用双荧光素酶报告基因检测试剂盒检测荧光素酶活性。所有数据均以Renilla荧光素酶活性进行标准化。
1.4.2 细胞分组和处理将H2c9细胞在DMEM完全培养基中培养,环境条件为5%CO2、37℃和95%湿度,培养基含有10%的胎牛血清、100 mg/ml的链霉素和100 U/ml的青霉素。将细胞在5%CO2培养箱中于37℃和95%湿度下培养。细胞分为miR-124-3p NC组和miR-124-3p mimic组,细胞分别转染miR-124-3p NC和miR-124-3p mimic,按说明书利用LipofectamineTM 2000进行转染,转染条件为7℃和5%CO2,48 h后收集细胞。检测miR-124-3p,通过Western blot检测PI3K蛋白。
1.5 统计学方法统计分析采用SPSS 19.0软件。多组间进行方差分析,两两比较使用SNK-q检验,数据以平均值±标准偏差(SD)表示。每个检测设立3个平行实验,重复3次,P<0.05为差异具有统计学意义。
2 结果
2.1 各组miR-124-3p水平比较对照组、SHR组、SHR+miR-124-3p agomir和SHR+miR-124-3p antagomir组大鼠心肌组织中的miR-124-3p水平分别为(0.87±0.12)、(2.56±0.38)、(4.51±0.86)和(1.13±0.16)。SHR大鼠心肌组织中miR-124-3p水平升高,且通过agomir和antagomir提高和降低心肌细胞中miR-124-3p水平。
2.2 miR-124-3p对大鼠心肌酶指标的影响四组大鼠外周血中心肌酶指标比较差异显著(P<0.05)。SHR组的LDH(1982.35±207.44)IU/L和CK-MB(942.55±107.62)IU/L显著高于对照组(P<0.05)。SHR+miR-124-3p agomir组的LDH(2371.92±244.26)IU/L和CK-MB(1301.42±135.49) IU/L显著高于SHR组(P<0.05)。SHR+miR-124-3p antagomir组的LDH(1624.43±176.31) IU/L和CK-MB(722.41±78.43)IU/L显著低于SHR组(P<0.05)。
2.3 miR-124-3p对SHR大鼠心肌组织的影响对照组心肌细胞染色均匀,细胞核饱满,细胞成纤维状且紧密排列;SHR组大鼠心肌细胞染色不均匀,细胞肿胀,紧密排列紊乱;SHR+miR-124-3p agomir组心肌细胞损伤情况加剧;SHR+miR-124-3p antagomir组的心肌组织损伤情况较SHR组有所缓解,排列较为紧密有序(图1)。
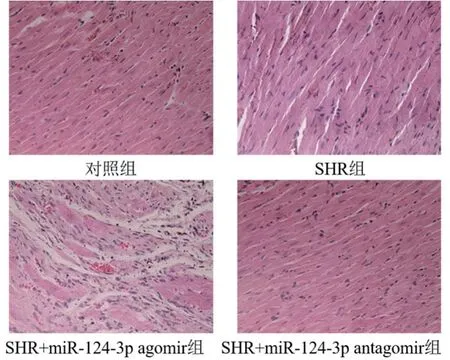
图1 miR-124-3p对SHR大鼠心肌组织损伤的影响(×200)
2.4 miR-124-3p对SHR大鼠心肌细胞凋亡的影响四组大鼠细胞的心肌细胞凋亡情况比较,差异有统计学意义(P<0.05)。SHR组凋亡细胞数目(27.18±2.10)个显著高于对照组。SHR+miR-124-3p agomir组凋亡细胞数目(52.76±3.56)个显著高于SHR组。SHR+miR-124-3p antagomir组凋亡细胞数目(11.85±0.97)个,显著低于SHR组。
2.5 miR-124-3p的水平对SHR大鼠心肌细胞线粒体凋亡途径的影响四组大鼠心肌组织中线粒体凋亡途径标志蛋白水平比较,差异有统计学意义(P<0.05)。SHR组的Cyt C、caspase9和cleaved-caspase3蛋白表达量显著高于对照组(P<0.05)。与SHR组比较,SHR+miR-124-3p agomir组的Cyt C、caspase9和cleaved-caspase3蛋白表达量显著升高(P<0.05),而SHR+miR-124-3p antagomir组显著降低(P<0.05)(图3)。

图2 miR-124-3p对SHR大鼠心肌细胞凋亡的影响(×200)
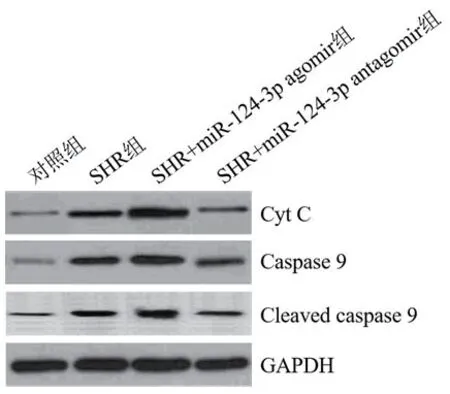
图3 提高和降低miR-124-3p的水平对Cyt C、caspase9和cleavedcaspase3表达量的影响
2.6 miR-124-3p的水平对SHR大鼠PI3K/AKT的影响四组SHR大鼠心肌细胞中PI3K/AKT通路水平比较差异显著。SHR组的PI3K和AKT mRNA和蛋白表达量显著低于对照组。SHR+miR-124-3p agomir组的PI3K和AKT mRNA和蛋白表达量显著低于SHR组。SHR+miR-124-3p antagomir组的PI3K和AKT mRNA和蛋白表达量显著高于SHR组(图4)。

图4 miR-124-3p的水平对SHR大鼠心肌细胞中PI3K和AKT蛋白表达量的影响
2.7 miR-124-3p与PI3K的靶向关系通过双荧光素酶报告在NCI-N87细胞中验证miR-124-3p靶向PI3K mRNA。PI3K是由PIK3CA基因编码的,结果显示同时转染miR-124-3p mimic和wt-PI3K后细胞中相对荧光素酶活性显著降低(P<0.05),提示miR-124-3p与PI3K靶向结合。
2.8 miR-124-3p对PI3K表达的影响miR-124-3p mimic组的miR-124-3p水平(5.76±0.54)显著高于NC组(0.94±0.09)(P<0.05),提示转染实验成功。miR-124-3p mimic组的PI3K mRNA(0.95±0.09)和蛋白(0.52±0.05)的表达水平显著低于miR-124-3p NC组(3.78±0.35vs. 2.13±0.20),(P<0.05)。
3 讨论
血压升高会引起心肌机械压力异常、神经激素改变、生长因子和细胞因子表达异常,使心肌耗氧量增加和凋亡,最终导致心室功能障碍[9]。
miRNA是在转录后调控基因表达水平的重要途径,miRNA通过碱基互补配对方式识别mRNA的3’端的非翻译区域(UTR)并诱导mRNA降解和翻译抑制[10]。最近研究显示miRNA在高血压和心脏疾病中发挥重要作用,可能成为评估高血压相关心力衰竭的临床标志因子[11]。miR-124-p通过调节核受体亚家族3C组成员的表达导致血管内皮细胞损伤促进高血压[12]。在血管紧张素诱导的心肌细胞中,miR-124-3p升高可促进细胞中活性氧自由基的水平,导致细胞损伤和凋亡[13]。Zhao等[14]研究结果显示miR-124-3p会导致心脏重构加剧心力衰竭。本研究结果显示与健康大鼠比较,SHR心肌组织中的miR-124-3p水平上调。提高心肌组织中的miR-124-3p水平会加剧SHR大鼠的心肌损伤和心肌细胞凋亡,而抑制miR-124-3p水平会缓解心肌损伤抑制心肌细胞凋亡。Liu等[15]研究显示miR-124-3p促进缺血/再灌注引起的心肌细胞凋亡。Han等[16]发现miR-124调节氧化应激和缺氧反应诱导的心肌细胞凋亡参与心肌梗塞,提示降低miR-124-3p的水平会缓解高血压导致的心肌细胞损伤和凋亡。
由高血压引起的心肌耗氧量增加会引起活氧化应激反应导致线粒体功能异常,线粒体中的Cyt C释放进入细胞质并激活凋亡执行蛋白cleaved caspase3蛋白导致细胞凋亡[17]。提高PI3K/AKT通路水平能够减弱氧化应激诱导的线粒体依赖性细胞凋亡[18]。本研究结果显示提高miR-124-3p进一步抑制PI3K/AKT通路促进线粒体凋亡,而抑制miR-124-3p会缓解以上影响。miR-124通过调控的PI3K/AKT途径改善缺血后神经元的轴突生长[19],提示抑制miR-124-3p的表达能够恢复PI3K/AKT通路水平,从而缓解氧化应激保护线粒体功能,抑制心肌细胞凋亡。
综上所述,SHR大鼠心肌组织中miR-124-3p升高,miR-124-3p的水平会抑制PI3K/AKT加剧线粒体凋亡途径,导致心肌细胞凋亡。但关于miR-124-3p在高血压心肌病中的临床意义及高血压诱导miR-124-3p过表达的机制尚需进一步研究。

