晚期糖基化终末产物刺激HASMCs细胞lncRNA差异表达的分析与鉴定
黄寅,徐通洁,刘朝林,刘勇
糖尿病作为全球公认的严重公共卫生问题,其在中国的严峻形势也不容忽视,糖尿病血管并发症是近年来糖尿病患者致残、致死率不断上升的主要原因[1]。其中,糖尿病血管钙化被认为是一个主要独立危险因子,在糖尿病患者心血管疾病发生发展中占重要作用[2-4]。
机体在持续高血糖状态下会形成一种稳定不可逆的终产物,即晚期糖基化终末产物(AGEs),伴随在糖尿病患者体内的异常积累,AGEs通过参与肾脏病变、动脉粥样硬化、糖尿病视网膜疾病等病变导致一系列糖尿病并发症的发生和恶化[5,6]。前期研究也发现AGEs能通过结合人主动脉血管平滑肌细胞(HASMCs)膜上的晚期糖基化终末产物受体(RAGE)激活相关通路,上调钙化相关蛋白的表达从而促进钙化的发生发展[7]。
长链非编码RNA(lncRNA)是一类转录本长度大于200个核苷酸的转录物,没有明显的蛋白质编码功能[8]。目前发现lncRNA能通过合成位点局部调节、远端染色体相互作用、靶向特定基因组等不同模式参与细胞内各种转录调控过程[9]。LncRNA通过调控血管细胞的表型、凋亡、迁移、自噬和增殖等过程,参与动脉粥样硬化、糖尿病微血管病变、心肌肥厚、心肌梗死等病理过程,进而在心血管疾病的发生发展中发挥重要的生物学功能[10-14]。LncRNA发挥的生物学功能不仅可作为诊断血管疾病的生物学指标,更可能是血管疾病临床治疗的新方向。然而lncRNA在糖尿病血管钙化中的作用机制仍不清楚。本研究旨在通过高糖产物构建细胞钙化模型,通过基因芯片技术筛选出与糖尿病动脉平滑肌细胞钙化有关的lncRNA,并对相关lncRNA参与血管平滑肌钙化的机制进行预测和初步验证,为糖尿病血管病变的发生、发展机制和临床治疗提供参考方向。
1 材料和方法
1.1 材料正常HASMCs原代细胞购自美国ScienCell公司。平滑肌细胞培养基(SMCM)购自美国ScienCell公司;AGEs BSA购自日本Biovision;BCA 蛋白定量试剂盒购自武汉碧云天生物技术公司;一抗二抗稀释液购自北京索莱宝生物技术公司;β-actin、OPG、RUNX2、COX2兔抗人一抗、荧光二抗均购自英国Abcam;lncRNA Smart Silencer抑制试剂盒、转染试剂盒购自广州锐博生物科技有限公司;细胞总RNA提取试剂盒购于成都福际公司;荧光定量PCR试剂盒购于德国Qiagen;逆转录试剂盒购自日本东洋纺公司;引物设计及合成购自上海生工生物工程有限公司。
1.2 方法
1.2.1 HASMCs培养和干预将HASMCs原代细胞复苏后于37℃、5%CO2培养孵箱中继续培养,取第5~8代平滑肌细胞进行实验。
1.2.2 蛋白表达的测定使用蛋白提取试剂盒提取各组细胞总蛋白,通过BCA法测定蛋白浓度,蛋白样本每孔定量通过SDS-PAGE凝胶进行电泳分离,然后将蛋白在400 mA恒流下湿转60 min至PVDF膜上,然后在含5%脱脂奶粉-TBST中室温封闭1 h,将PVDF膜分别同β-actin(1:1000)、OPG(1:1000)以及PTGS2(1:1000)等一抗置于4℃冰箱中孵育过夜。次日与荧光二抗(1:5000)室温下孵育1 h,再次加入TBST洗膜3次,最后放入荧光蛋白质免疫印迹成像系统中成像并测定灰度值。
1.2.3 样本及芯片分析通过Trizol法提取总RNA进行芯片杂交。使用Agilent Feature Extraction软件(v11.0.1.1)获得芯片图,使用GeneSpring GX v12.1软件(Agilent Technologies)对原始数据进行Quantile标准化和随后的数据处理。对差异表达mRNA进行Pathway和GO的富集分析,使用编写脚本进行层次聚类和关联分析。样本芯片分析由上海康成生物有限公司合作完成。
1.2.4 RNA的提取与测定采用RNA提取试剂盒从各组细胞中提取RNA,按照细胞总RNA提取试剂盒说明书步骤进一步提纯,使用分光光度仪测得总RNA纯度和浓度后,按照逆转录试剂盒说明书步骤反转录成cDNA后,采用SYBR green 染料方法进行实时荧光定量PCR,在Rochee Light Cycler480荧光定量PCR仪上进行PCR程序反应、数据收集和分析。PCR反应体系(20 μl)为:2×SYBR Green mix 10 μl,正向引物(10 μmol/L)1.4 μl,反向引物(10 μmol/L)1.4 μl,无酶水5.7 μl,cDNA 1.5 μl,无菌水7 μl。PCR反应程序为:95℃预变性5 min,95℃变性5 s,60℃退火10 s,72℃延伸15 s,共40个PCR循环反应,使用β-actin RNA作为内参,采用2-△△Ct法进行结果分析。引物序列:β-actin,正义5'-CCTGGCACCCAGCACAAT -3',反义5'-GCCGATCCACACGGAGTA -3';PACERR,正义5'-ACTGATCGCCTTGGATGGGA -3',反义5'- CGTGACTTCCTCGACCCTCT-3';PTGS2,正义5'- TCTCCTGCCTACTGGAAGCC-3',反义5'-CTAGTCCGGAGCGGGAAGAA -3'。
1.2.5 统计学分析使用SPSS 20.0统计软件进行数据分析,多组间比较采用单因素方差分析,两组间比较用t检验。以P<0.05为差异具有统计学意义。每组实验均重复3次。
2 结果
2.1 HAVSMCs培养AGEs对HAVSMCs钙化的作用取生长状态良好的细胞在倒置相差显微镜下可见单个人主动脉平滑肌细胞(HAVSMCs)呈梭形、三角形或多边形,细胞生长到一定密度可见“波峰一波谷”状的平滑肌细胞生长特征(图1A、B、C)。与对照组相比,AGEs钙化干预组的钙化相关蛋白水平明显增加,加入100 mg/L AGEs时钙化相关蛋白表达最明显(图1D、E),表明100 mg/L是AGEs诱导平滑肌细胞钙化的最佳浓度。
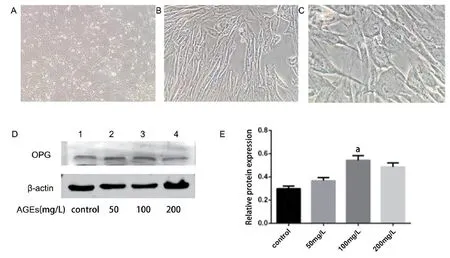
图1 HASMCs细胞形态学和不同浓度AGEs对HASMCs细胞诱导钙化的情况
2.2 LncRNA在钙化HAVSMCs中的差异表达谱通过与对照组相比较,AGEs钙化干预组经芯片检测分析(图2),有661个lncRNA表达上调,293个lncRNA表达降低(P<0.05),并且有741个mRNA表达上调,235个mRNA表达降低(P<0.05)。AGEs钙化干预组的分析结果相比对照组,lncRNA存在明显的差异表达,提示lncRNA很有可能参与人主动脉平滑肌细胞钙化的生物学过程(图3)。

图2 芯片扫描图

图3 对照组与AGEs干预组细胞差异lncRNA基因表达谱
2.3 生物信息学分析使用top GO进行差异mRNA的GO分析以推断它们参与的分子功能。GO分析包括生物学过程、细胞组成和分子功能三个部分,表达上调的mRNA中富集显著前10的GO条目分别包括防御反应、外部刺激反应、受体配体活动、受体调节因子活动、细胞外区域、细胞外基质等(图4A、C、E),表达下调的mRNA中富集显著前10的GO条目分别包括前列腺素受体活性、多细胞生物过程、结构形态发生、胞质区、细胞皮层、结构分子活动、肌动蛋白结合等(图4B、D、F),说明血管细胞钙化可能是细胞针对外界刺激,如高糖、糖基化产物、炎性因子等刺激做出异常应答产生一系列的病理生理过程。同时,差异表达mRNA参与的包括TNF信号通路、细胞因子-细胞因子受体相互作用、移植物抗宿主疾病、矿物质吸收等前10通路上存在显著富集(图5),进一步说明细胞钙化过程涉及矿物质沉积、钙化相关信号通路激活的过程。
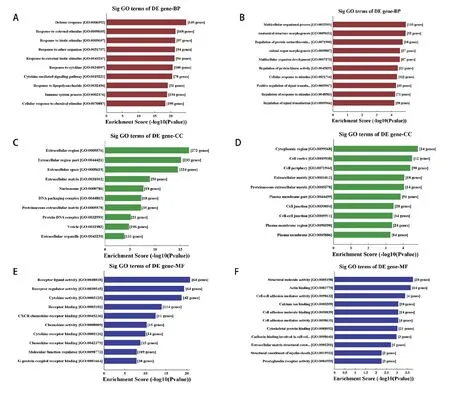
图4 差异表达mRNA GO分析
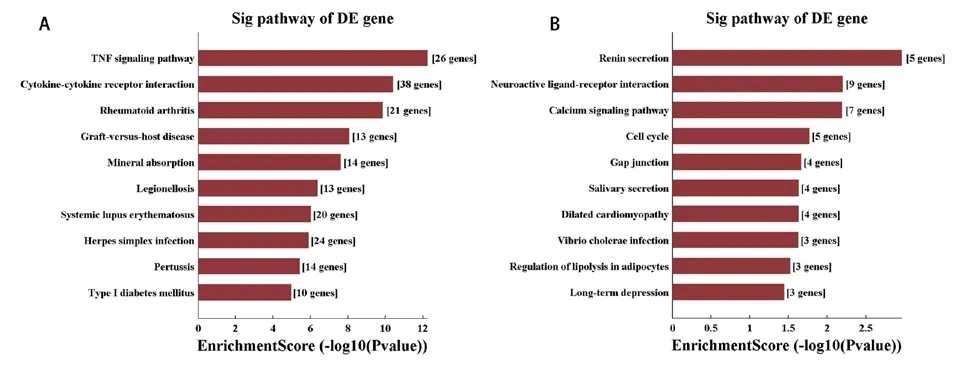
图5 差异表达mRNA KEGG通路分析
2.4 钙化相关lncRNA预测及初步验证通过芯片分析筛选出的差异表达的lncRNA中,我们发现一个序列名为PACERR的lncRNA(图6)在钙化干预组中明显上调,该转录本位于1号染色体,含825个碱基,通过预测发现其与前列腺素-内过氧化物合酶2(PTGS2)蛋白编码基因位置关系密切,PTGS2是参与前列腺素生物合成的关键酶,正如我们之前预测的GO分析富集的前列腺素受体活性结果相一致,因此猜测PACERR可能通过调控PTGS2在平滑肌细胞钙化中发挥作用。
通过qPCR法验证可见相对于对照组,AGEs钙化干预组中PACERR表达绝对上调(图7A),邻近蛋白编码基因PTGS2表达在转录(图7B)和翻译水平(图7C、D)也同时上调,与芯片结果相符。随着AGEs干预浓度上调和干预时间延长,PACERR表达量逐渐升高,在干预48 h时达高峰(图7C),AGEs浓度在200 mg/L时表达丰度最明显(图7E)。沉默PACERR后其表达量降低(图8A),位于其下游的PTGS2基因转录和蛋白翻译表达同时下降(图8B、C、D),且钙化相关蛋白OPG降低,进一步验证了我们的预测。
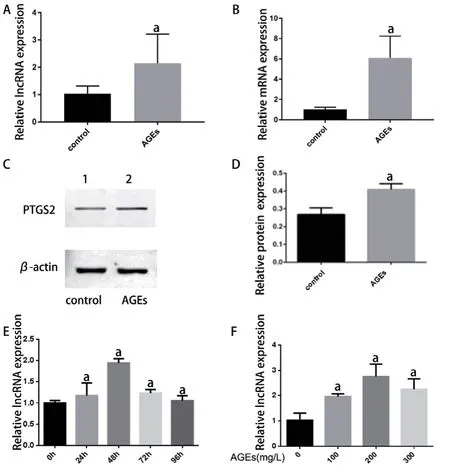
图7 RT-PCR和Western blot验证lncRNA PACERR和功能蛋白的差异表达
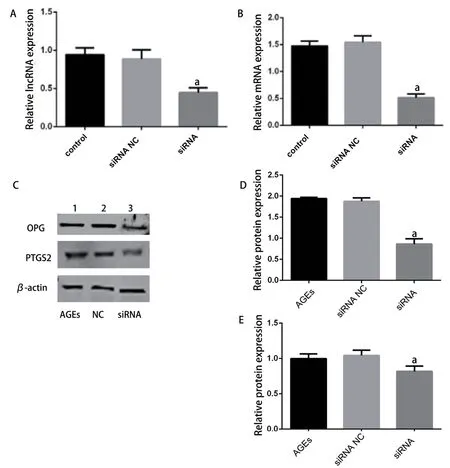
图8 RT-PCR和Western blot验证lncRNA PACERR抑制和抑制lncRNA对功能蛋白的影响
3 讨论
在既往研究中,lncRNA被认为是“转录噪音”或者是“转录副产物”,其本身不参与机体基因的调控过程,随着实验技术的提高和前期大量研究的探索,lncRNA在生物转录本功能逐渐被挖掘出来,激起研究人员的广泛兴趣。尽管目前lncRNA研究成果颇丰,甚至在临床诊疗上已经取得了重大实践进展,但大多数lncRNA的特征和功能仍尚不清楚。与其他非编码RNA相比,lncRNA在空间和结构上体现出了多重复杂性,使其在携带更多的生物学信息上具有更多优势。目前根据lncRNA在基因组上相对于蛋白编码基因的定位及其来源,人们把lncRNA分为主要的6大类:正义lncRNA、反义lncRNA、内含子间lncRNA、双向lncRNA、基因间lncRNA和环状RNA[15]。其在基因上的定位与功能相关,不同的lncRNA在胞核和胞质内参与调节染色质重构、转录活性、转录本剪接、蛋白定位、蛋白构象及mRNA稳定性等各种各样的生物学功能。比如lncRNA GAS5在血管重塑过程中通过激活p53途径对VSMC增殖,促进细胞周期停滞并诱导细胞凋亡产生负面影响[16]。还有研究表明过表达的lncRNA MEG3可通过抑制TGF-β1和VEGF的表达而抑制糖尿病性视网膜病变的发展[17]。
本研究利用糖基化终末产物建立人主动脉平滑肌细胞钙化模型,通过芯片技术进行正常平滑肌细胞和钙化平滑肌细胞的lncRNA及其共表达mRNA表达谱分析,筛选出大量的差异表达的lncRNA数据,相比对照组,其中有661个lncRNA表达上调,293个lncRNA表达降低,并且有741个mRNA表达上调,235个mRNA表达降低。通过GO分析和KEGG通路分析其共表达mRNA的生物学功能,其中在上调的共表达mRNA中,TNF信号通路细胞因子富集度较高,在下调的共表达mRNA中,神经活性配体受体相互作用、钙信号通路富集度较高,而钙信号通路参与调剂钙离子与血管平滑肌细胞表型转化[18],这些结果再次提示lncRNA可能通过调节相关通路、细胞因子在血管平滑肌细胞钙化中发挥重要作用。我们通过预测lncRNA上下游邻近的mRNA预测lncRNA发挥生物学功能的作用靶点,其中筛选出上调的lncRNA PACERR,与细胞钙化诱导作用呈正相关,并在一定条件下表达量达到峰值,与其下游的功能蛋白PTGS2转录及翻译呈正相关,而研究表明PTGS2在转录水平和翻译水平上参与了成骨分化、肿瘤等多种病理过程[19,20]。我们研究结果显示,长链非编码RNA PACERR在钙化人主动脉平滑肌细胞显著上调,很可能通过PTG2靶基因的调控参与血管平滑肌细胞钙化的发生发展中起重要作用。同时验证了PTGS2在钙化平滑肌细胞中明显上调,这与芯片结果一致。但lncRNA与共表达mRNA作用于细胞共同参与钙化的具体机制仍不明确,需进一步研究机制靶点。
综上所述,本研究发现并筛选出晚期糖基化终末产物诱导的特异表达的lncRNA谱及其共表达下游mRNA,这些差异表达的lncRNA及共表达靶基因可能在血管钙化的发生、发展中发挥重要的生物学作用,其中lncRNA及其共表达下游mRNA关系得到验证,利用芯片进行生信分析获得的数据,为研究糖尿病血管钙化的发生机制提供了新的思路,可能在未来成为糖尿病血管疾病临床诊疗的重要部分。

