基于TCGA数据库分析TUBA1C在肺腺癌中的表达及临床意义
陈 兰,林远生,刘建生
(1.赣南医学院 a.研究生院医学部2019级; b.研究生院医学部2017级;2.赣州市人民医院呼吸内科,江西 赣州 341000)
肺癌是世界上最常见的恶性肿瘤,其发病率及病死率均居恶性肿瘤首位,2018年仅在美国就有新增肺癌患者234 030例,且有154 050例患者死于肺癌[1-2]。在肺癌患者中,非小细胞肺癌占其绝大多数,约占整体发病率的80%,而在非小细胞肺癌中肺腺癌又是最常见的病理类型,约占肺癌总数的40%[3]。早期肺癌患者大多缺乏典型的临床症状,确诊时大多已进展为晚期或局部晚期,可采取的治疗措施往往有限,因此多数患者预后不良[4-5]。虽然靶向治疗已广泛应用于临床并提高了部分肺腺癌患者的生存率,但肺腺癌患者总体预后仍不理想,5年生存率仍不超过25%[6]。因此,深入了解肺腺癌的发病机制,寻找影响肺腺癌分子治疗和预后的相关标志物具有重要意义。
α-微管蛋白特异性1c链(alpha-tubulin specific 1c chain,TUBA1C)是α-微管蛋白的一种亚型,与β微管蛋白相互作用共同构成微管结构,参与维持细胞的形态、运动、分裂、分泌及胞内运输等重要生物学过程[7]。有研究[8-11]表明,TUBA1C与多种恶性肿瘤的细胞增殖及细胞周期有关,其上调可以显著影响肿瘤的生长与进展。虽然目前已存在一些关于α-微管蛋白与肺癌关系的研究报道,但却未见有关TUBA1C在肺腺癌中表达及与其预后关系的公开研究报道。本研究利用TCGA数据库资源,分析TUBA1C在肺腺癌组织中的表达,并预测其在肺腺癌发生发展中的作用,旨在为肺腺癌的靶向治疗及分子标志物的筛选提供科学依据。
1 资料与方法
1.1 资料来源
从癌症和肿瘤基因图谱(TCGA,http://tcga-data.nci.nih.gov/)网站下载肺腺癌中所有TUBA1C mRNA转录组数据及临床病理资料,获取肺腺癌组织样本535例,癌旁正常组织样本59例,具有配对的癌旁组织共有57例。主要临床资料包括年龄、性别、TNM分期、T分期、N分期、M分期及预后等。
1.2 TUBA1C的表达与肺腺癌患者临床病理特征及预后的相关性分析
根据TCGA数据库下载的的mRNA转录组数据及临床资料,以TUBA1C在肺腺癌患者中mRNA表达量的中位值为界限,将患者分为TUBA1C高表达组和TUBA1C低表达组。并采用χ2检验比较2组年龄、性别、TNM分期、T分期、N分期、M分期等临床病理特征的差异。同时,结合TUBA1C表达量,利用单因素及多因素COX分析TUBA1C表达与肺癌患者临床病理特征的相关性。采用R 4.0.4软件“survival”包分析肺腺癌患者中TUBA1C高、低表达组总体生存率(OS)的差异。
1.3 统计学方法
采用SPSS25.0软件对数据进行处理。用Mann-WhitneyU检验分析TUBA1C在肺腺癌组织和癌旁组织样本中的表达差异;对TUBA1C表达水平与肺腺癌患者的临床病理特征的相关性进行χ2检验;单因素分析及多因素COX比例风险模型用于评价TUBA1C与肺腺癌患者预后的关系。生存分析使用Kaplan-Meier法,生存曲线比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肺腺癌组织和癌旁正常组织中TUBA1C mRNA表达水平的比较
TCGA数据库中TUBA1C的mRNA表达结果显示,与癌旁组织相比,肺腺癌组织中TUBA1C表达水平显著增高,差异有统计学意义(P<0.001)。见图1。在57对配对的肺腺癌组织与癌旁组织样本中,肿瘤组织TUBA1C表达水平较癌旁肺组织也显著上调(P<0.001)。见图2。
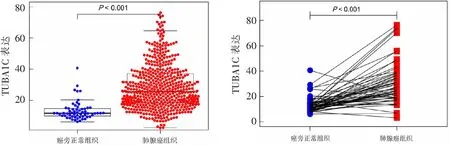
图1 TUBA1C在肺腺癌组织和癌旁组织中的表达 图2 57对配对肺腺癌组织和癌旁组织中TUBA1C的表达
2.2 肺腺癌组织中TUBA1C表达与患者临床病理特征及预后的关系
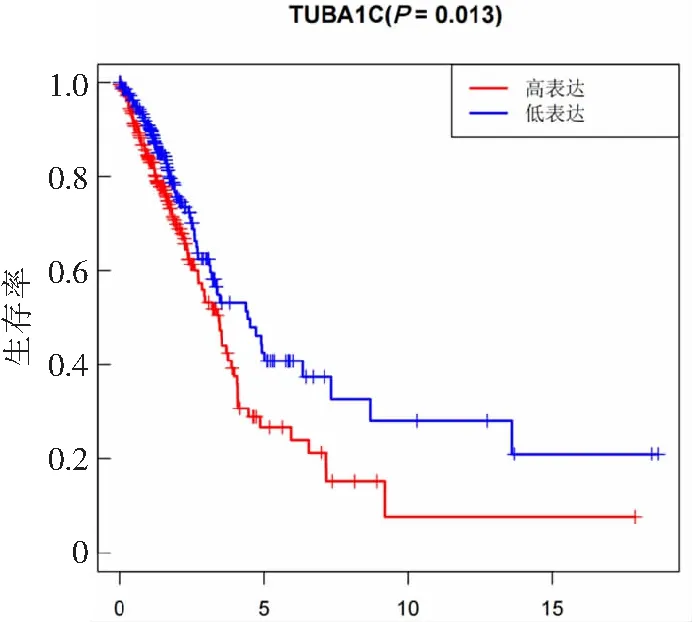
肺腺癌组织中TUBA1C表达与临床病理特征的关系见表1。肺腺癌组织中TUBA1C表达量与年龄、性别、TNM分期、T分期、N分期及M分期显著相关。在TNM(Ⅰ-Ⅲ),TUBA1C基因的表达呈上调趋势,两两比较差异均具有统计学意义(P<0.001)。见图3。生存预后分析结果显示, TUBA1C低表达患者OS显著优于TUBA1C高表达患者(P=0.013)。见图4。单因素Cox比例风险模型结果显示TNM分期(HR=1.653,95%CI:1.401~1.951,P<0.001)、T分期(HR=1.631, 95%CI:1.315~2.024,P<0.001)、N分期(HR=1.789,95%CId1.458~2.196,P<0.001)及TUBA1C表达状态(HR=1.013,95%CI:1.003~1.023,P=0.008)与总生存率显著相关。多因素Cox比例风险模型结果显示,仅TNM分期可以作为肺腺癌的独立预后影响因素(HR=1.948,95%CI:1.228~3.091,P=0.004)。见表2。

图3 TUBA1C在肺腺癌组织不同临床TNM分期中的表达
t/年
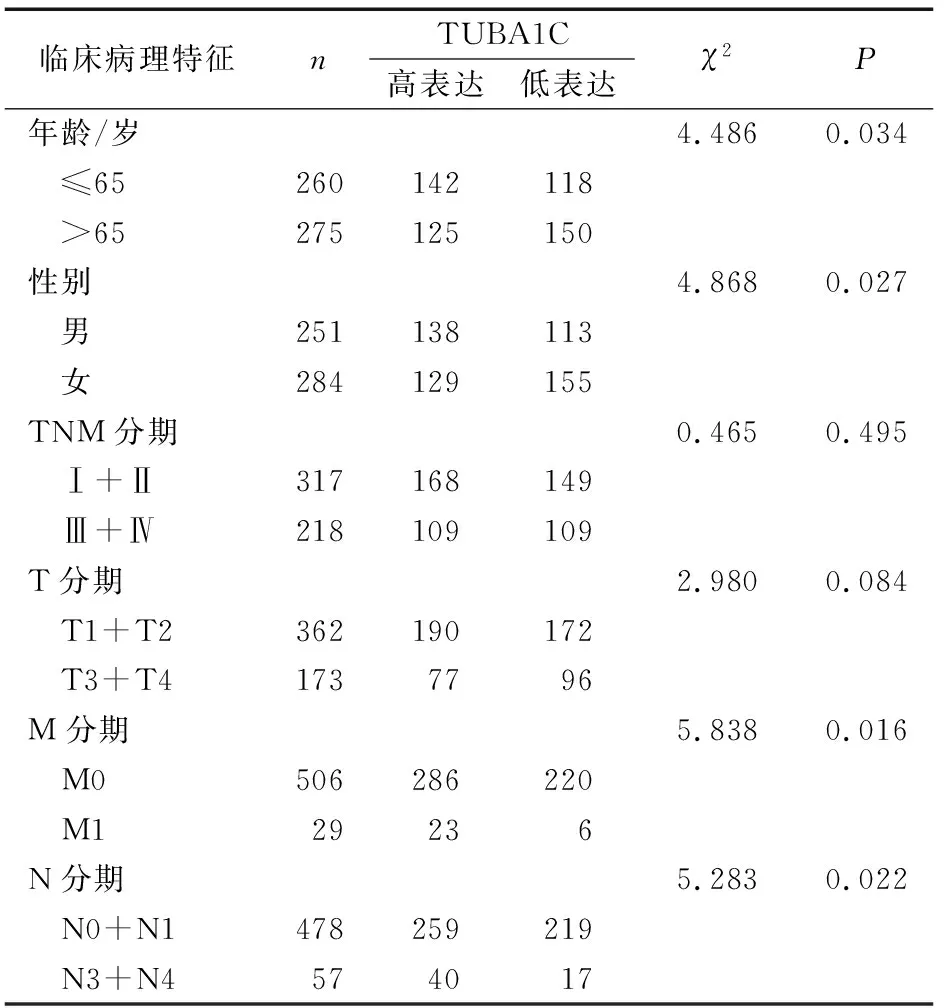
表1 肺腺癌组织中TUBA1C的表达与患者临床病理特征的关系 例
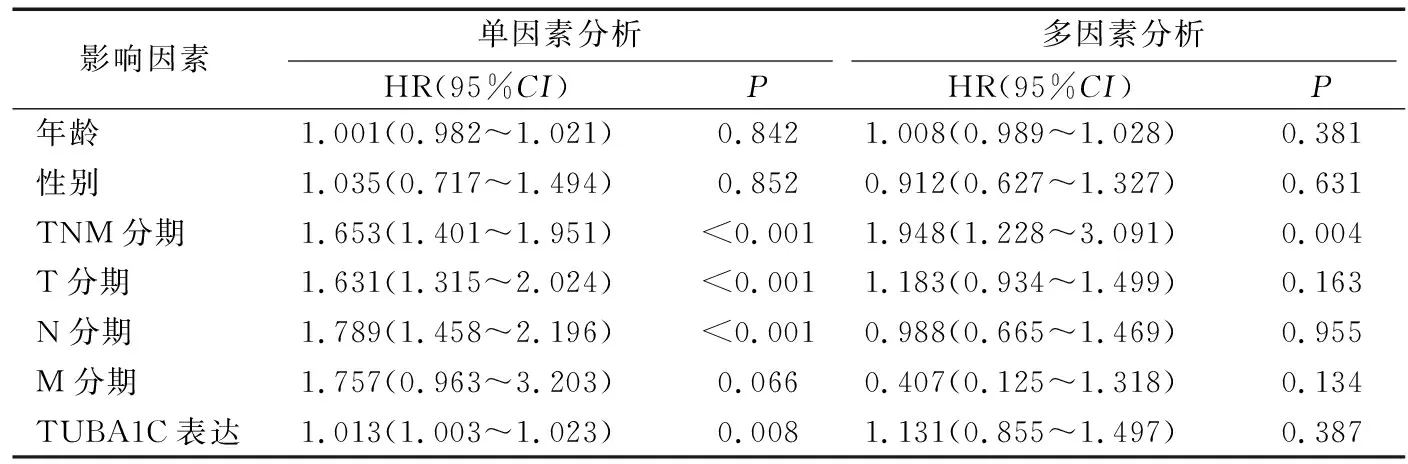
表2 单因素及多因素Cox回归分析
3 讨论
微管是真核细胞骨架的重要组成部分,是由高度保守的α微管蛋白和β微管蛋白异二聚体(大小4 nm×5 nm×8 nm,质量100 000 Da)构建而成的中空管状纤维,主要通过细胞复制和分裂参与动态聚合和解聚过程,是最多功能的蛋白质之一[12-13]。既往研究[7]发现,微管可与许多微管相关蛋白相互结合,参与维持细胞形态、细胞运动、细胞分裂、细胞分泌、及胞内运输等重要生物学过程。微管还在调节有丝分裂装置方面起重要的作用,从而影响细胞的增殖、分化和凋亡等过程[7,14]。有研究[15-19]表明,包括α-微管蛋白、β-微管蛋白和γ-微管蛋白在内的几种微管蛋白与小细胞肺癌、胸腺上皮性肿瘤、乳腺癌、胃癌和肾细胞癌等肿瘤进展密切相关。尤其是α-微管蛋白,其作为微管的重要组成部分,与肺癌、前列腺癌、乳腺癌等恶性肿瘤的发生发展有关[20]。
TUBA1C是α-微管蛋白的一种亚型,位于12号染色体上,是一种多功能的细胞骨架蛋白,参与细胞的有丝分裂及细胞分裂过程[21-22]。有研究[8-9,23-24]显示,TUBA1C的表达上调可显著影响肿瘤细胞的生长及进展,提示TUBA1C与许多癌症的细胞增殖和细胞周期有关。既往研究[25]还显示,TUBA1C是细胞周期通路中的关键中介。在LI等[26]研究中,TUBA1C在骨肉瘤中的表达明显上调,而在骨肉瘤中异常表达的细胞骨架微管蛋白可通过影响微管的稳定性来影响肿瘤的浸润及转移,从而影响患者的预后。江若安等[27]研究发现抑制TUBA1C基因的过表达可抑制CAOV3、SKOV3细胞的增殖、侵袭能力,并认为TUBA1C基因有望成为卵巢癌抗肿瘤药物耐药、基因治疗的新靶点。有研究[18]发现,TUBA1C基因在肝癌组织中明显上调,且TUBA1C基因高表达患者OS相对较低,TUBA1C的高表达可增加肿瘤细胞的增殖及迁移能力,并认为高表达的TUBA1C可通过作用于细胞周期通路影响细胞的增殖及迁移过程。有研究[28]发现,在胰腺导管腺癌患者中,TUBA1C高表达患者具有较低的总生存期(OS)及无病生存期(DFS),而TUBA1C低表达患者OS及DFS相对较高;敲低TUBA1C的表达可诱导细胞周期停滞在G0/G1期,而免疫印迹结果也显示在敲低TUBA1C表达后细胞周期蛋白CDK2、CDK4、CDK6、cyclin D1和cyclin E1的表达同时会受到抑制,提示TUBA1C可通过调节系细胞周期信号通路来影响胰腺癌细胞的迁移、侵袭和凋亡等过程。
既往多项研究[8-9,23-24]结果都提示TUBA1C是与恶性肿瘤密切相关的候选癌基因。本研究通过分析TCGA数据库中肺腺癌相关数据,比较肺腺癌组及癌旁对照组中TUBA1C基因的表达情况,结果显示TUBA1C在肺腺癌组中的表达明显高于癌旁对照组,且随着TNM分期增加TUBA1C的表达也呈现出上调趋势,提示TUBA1C可能是肺腺癌的一个重要的致癌基因,并与肿瘤细胞的进展相关。生存分析结果表明TUBA1C高表达患者预后相对不良,单因素Cox分析结果显示TUBA1C高表达是肺腺癌预后的影响因素,提示TUBA1C的表达状态可能是肺腺癌预后的影响因素。
综上所述,本研究通过分析TCGA数据库中TUBA1C在肺腺癌中的表达及临床意义,推测TUBA1C基因可能为肺腺癌临床预后评估指标及靶向治疗新靶点。但是,本研究仍存在一些不足之处,从TCGA下载的TUBA1C的RNA-seq 数据不能完全代表TUBA1C的表达情况,且纳入的临床样本量不够大也可能会影响统计结果的准确性,且TUBA1C在肺腺癌中的具体作用机制目前仍不清楚,仍需要对TUBA1C基因进行更深入的研究,并加大临床样本量对目前结论加以验证,从而为肿瘤的诊断和治疗提供新思路。

