四价流感病毒裂解疫苗在成人及3岁以上儿童中的免疫原性和安全性评价
李晓波,郭占龙,徐晓腾,徐文,李爽,李利,郭雪,吴业红,张雪梅,刘晓强
1.长春生物制品研究所有限责任公司,吉林长春130012;2.云南省疾病预防控制中心,云南昆明650034
流感病毒可感染动物和人类,引起急性呼吸道传染病[1],流感疫苗接种是预防流感病毒感染及其诱发的严重并发症的最有效手段。接种疫苗不仅能保护接种者,对与接种者接触的未接种人群,也有间接保护作用,即群体免疫效应[2]。
导致人类流感的病毒株通常包括两种甲型流感病毒株(A/H1N1和A/H3N2)和两种乙型流感病毒株(B/Victoria和B/Yamagata)。尽管甲型流感一直是大多数研究和预防工作的重点,但乙型流感病毒目前被认为是罹患流感、住院治疗和死亡的常见原因[3],乙型流感病毒包含抗原性截然不同的两个谱系,二者自1985年后在全球地区呈现共同流行[4]。原有的三价流感疫苗由于仅包含1个B型抗原,降低了接种人群对B型流感病毒的保护率[5]。四价流感疫苗增加了另一个谱系的B型抗原,因此能够提高接种人群对B型流感病毒的保护率[6]。
长春生物制品研究所有限责任公司研制的流感病毒裂解疫苗(四价)是一种包含4种流感病毒株的疫苗。本次临床试验通过对成人及3岁以上儿童接种试验疫苗,以上市的三价流感疫苗和含另一谱系B型的三价流感疫苗作为阳性对照,评价不同配伍流感疫苗的免疫原性和安全性,该研究于2017年7月—2018年9月在云南省勐海县与澜沧县疾病预防控制中心进行,现将Ⅲ期临床试验结果报道如下。
1 对象与方法
1.1 研究对象 经云南省疾病预防控制中心伦理委员会审查通过,以受试者和/或法定监护人知情同意、自愿参加为原则,在云南省勐海县与澜沧县疾病控制中心临床试验现场,筛选符合临床研究方案中规定的入选排除标准志愿者共2 400名,按照1∶1∶1的比例分别接种试验疫苗和对照疫苗。
1.2 疫苗 试验疫苗[流感病毒裂解疫苗(四价),批号:S20170105,成分:A/California/7/2009(H1N1)(NYMCX-179A)、A/Hong Kong/4801/2014(NYMCX-263B)、B/Phuket/3073/2013(B/Yamagata)、B/Brisbane/60/2008(B/Victoria)]、对照疫苗A[流感病毒裂解疫苗,批号:S20170101,成分:A/California/7/2009(H1N1)(NYMC X-179A)、A/Hong Kong/4801/2014(NYMCX-263B)、B/Phuket/3073/2013(B/Yamagata)]和对照疫苗B[流感病毒裂解疫苗,批号:S20170103,成分:A/California/7/2009(H1N1)(NYMCX-179A)、A/Hong Kong/4801/2014(NYMCX-263B)、B/Brisbane/60/2008(B/Victoria)]均由长春生物制品研究所有限责任公司制备,规格为:0.5 mL/支,每次人用剂量为0.5 mL,含各型流感病毒株血凝素为15μg。疫苗有效期至2018年1月19日,均在有效期内使用,于2~8℃保存,冷链运输。
1.3疫苗接种 使用前应充分摇匀,于上臂外侧三角肌肌内注射,成人及3岁以上儿童接种1针次,每次接种剂量为0.5 mL[7]。
1.4 免疫原性观察 采用单中心、随机、双盲、阳性疫苗对照的非劣效试验,成人及3岁以上儿童按1∶1∶1接种1剂试验疫苗或2种对照疫苗。所有受试者均于免疫前、免疫后28 d采集静脉血,分离血清,由中国食品药品检定研究院采用微量血凝抑制试验测定疫苗免疫前后血清的HI抗体滴度[8]。抗体几何平均滴度(GMT)比值(试验组 /对照组)95%CI下限不低于0.67则非劣效检验成立。免疫前HI抗体滴度<1∶10,免疫后HI抗体滴度 ≥1∶40或免疫前HI抗体滴度≥1∶10,免疫后HI抗体滴度4倍增长为阳转。免疫后HI抗体滴度≥1∶40为具有抗体保护。抗体阳转率率差(试验组减去对照组)95%CI下限>-10%则非劣效检验成立。
1.5 安全性观察 收集所有受试者于每次接种后30 min内任何不良事件(adverse event,AE)的发生情况,免疫第0~7天征集性AE发生率,免疫第8~28天非征集性AE发生率,接种疫苗后6个月内严重不良事件(serious adverse event,SAE)的发生情况。疫苗接种后的AE严重程度参照国家食品药品监督管理局《预防用疫苗临床试验不良反应分级标准指导原则》[9]进行评估。
1.6 统计学分析 应用SAS9.4软件进行统计学分析,计量资料用均数、标准差、中位数、最大值、最小值进行统计描述;计数资料或等级资料用频数、频率表述。免疫原性组间比较采用卡方检验/Fisher确切概率检验;抗体GMT比较采用对数转换后的t检验;安全性分析基于SS集,组间AE(反应)率比较采用Fisher确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 受试者脱落情况 共入组2 400名受试者,进入安全性分析集SAS集2 400名(100.0%);进入全分析集FAS集2 400名(100.0%),其中试验组、对照组A和对照组B各800名(100.0%);进入PPS分析集2 356名(98.17%),其中试验组786名(98.25%)、对照组A 787名(98.38%)、对照组B783名(97.88%);试验过程中无受试者脱落。
2.2 受试者人口学特征分布 试验组、对照组A、对照组B平均年龄和性别构成组间差异均无统计学意义(F分别为0.090和1.020,P分别为0.913 9和0.600 5),见表1。
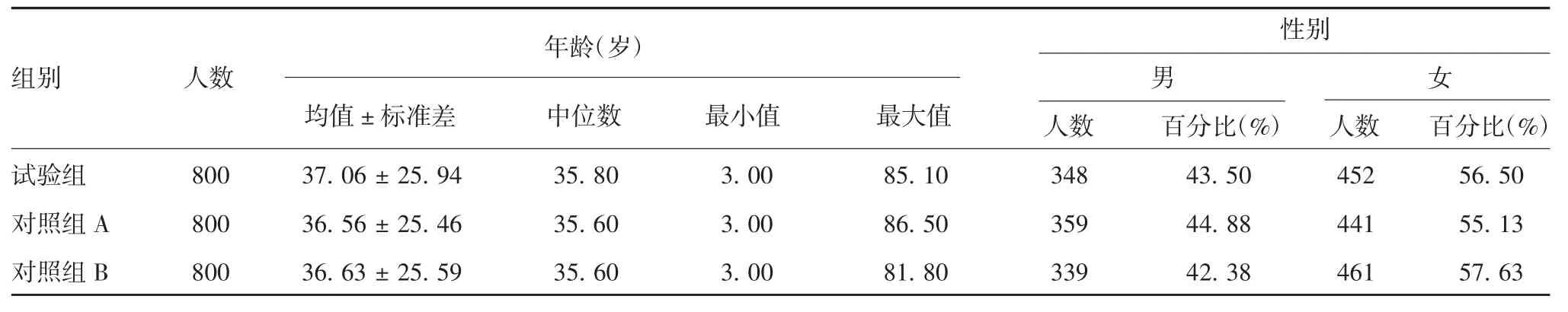
表1 全研究人群人口学基线Tab.1 Demographic baseline of the whole study population
2.3 免疫原性
2.3.1 全研究人群免疫后PPS数据集H1N1、H3N2、BY、BV型抗体GMT 试验组全研究人群免疫后H1N1、H3N2、BY和BV型抗体GMT分别为465.09、668.26、382.06、257.37,试验组与对照组H1N1、H3N2、BY、BV型抗体GMT比值的95%CI下限均>0.67,试验组非劣效于对照组相同型别(BY与对照组A比,BV与对照组B比),BY和BV型试验组均优于不含相应型别的对照组。试验组和对照组各型抗体GMT增长倍数(GMI)均大于2.5倍。见表2。

表2 全研究人群免疫后抗体GMT和GMI分析(PPS集)Tab.2 Analysis of GMT and GMT of antibody the whole study population(PPSset)
2.3.2 全研究人群免疫后PPS数据集H1N1、H3N2、BY、BV型抗体阳转率 试验组全研究人群免疫后H1N1、H3N2、BY和BV型抗体阳转率分别为87.66%、79.39%、86.77%、75.19%,试验组与对照组H1N1、H3N2、BY、BV型抗体阳转率率差的95%CI下限均>-10%,试验组各型抗体阳转率均非劣效于含有相同成分的三价流感对照疫苗(BY与对照组A比较,BV与对照组B比较),BY和BV型试验组均优于不含相应型别的对照组,各型抗体阳转率95%CI下限均大于40%,见表3。

表3 全研究人群免疫后抗体阳转率分析(PPS集)Tab.3 Analysis of antibody positive conversion rate after immunization in the whole study population(PPSset)
2.3.3 全研究人群免疫后PPS数据集试验组与对照组H1N1、H3N2、BY和BV型血清抗体保护率 试验组全研究人群H1N1、H3N2、BY和BV型血清抗体保护率分别为94.91%、99.11%、99.24%、98.09%,试验组与对照组H1N1、H3N2、BY和BV型血清抗体保护率的95%CI下限均>70%,且试验组与对照组相同型别血清抗体保护率差异无统计学意义(P>0.05)(BY与对照组A比,BV与对照组B比),BY和BV型试验组高于不含相应型别的对照组,见表4。
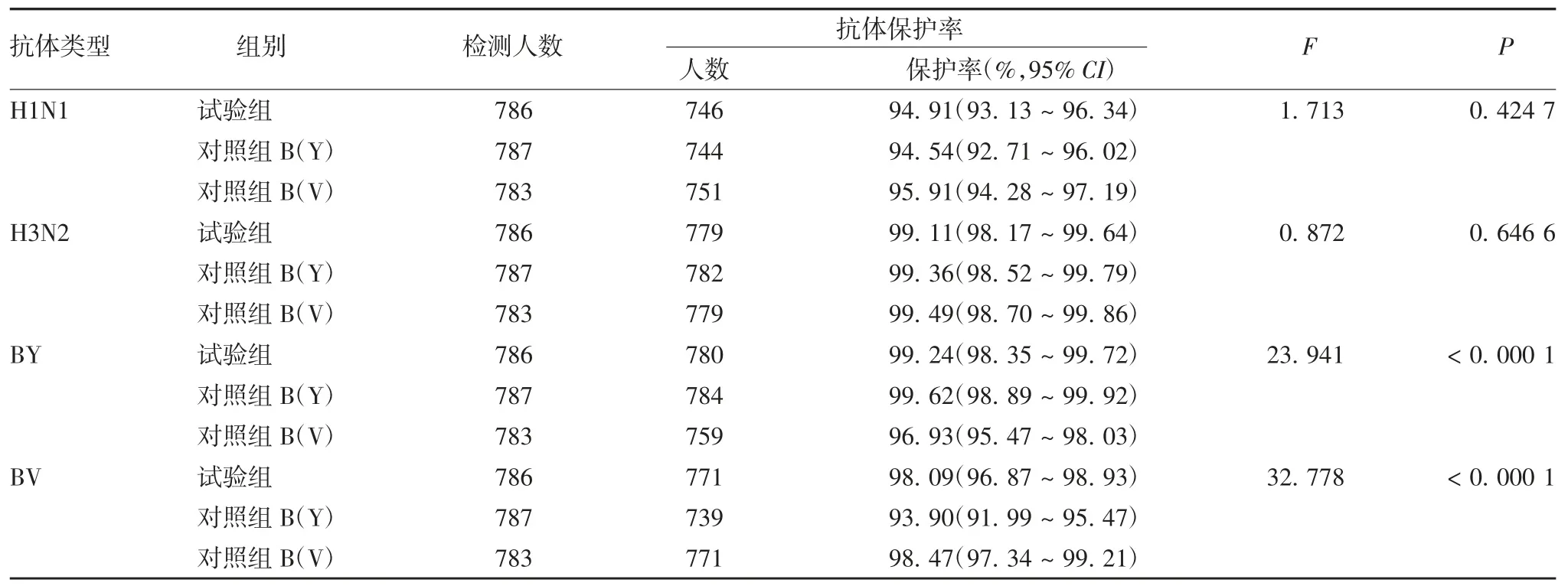
表4 全研究人群免疫后血清抗体保护率分析(PPS集)Tab.4 Analysis of antibody protection rate after immunization in the whole study population(PPSset)
2.4安全性
试验组、对照组A和对照组B总AE分别为208例(26.00%)290例次、200例(25.00%)281例次、218例(27.25%)317例次,征集性事件分别为172例(21.50%)213例次、173例(21.63%)210例次、174例(21.75%)208例次,非征集事件发生率分别为7.50%、6.38%和9.50%。总AE、征集性AE和非征集性AE发生率以及严重程度分布组间差异均无统计学意义(P>0.05)。见表5。

表5 全研究人群不良反应发生情况Tab.5 Incidence of adverse reactions in the whole study population
2.4.1 全身反应症状 全身反应症状主要为发热,试验组、对照组A和对照组B的发热发生率分别为18.38%、18.25%和17.25%,全身发热反应症状组间差异均无统计学意义(P>0.05),见表6。

表6 受试者全身反应症状发生情况Tab.6 Incidence of symptoms of systemic reactions in subjects
2.4.2 局部反应症状 局部反应症状主要为接种部位疼痛,试验组、对照组A和对照组B的疼痛发生率分别为2.38%、2.63%和2.00%,严重程度主要为1级,各种局部反应症状严重程度组间差异均无统计学意义(P>0.05),对照组未观察到严重程度3级的局部反应,见表7。
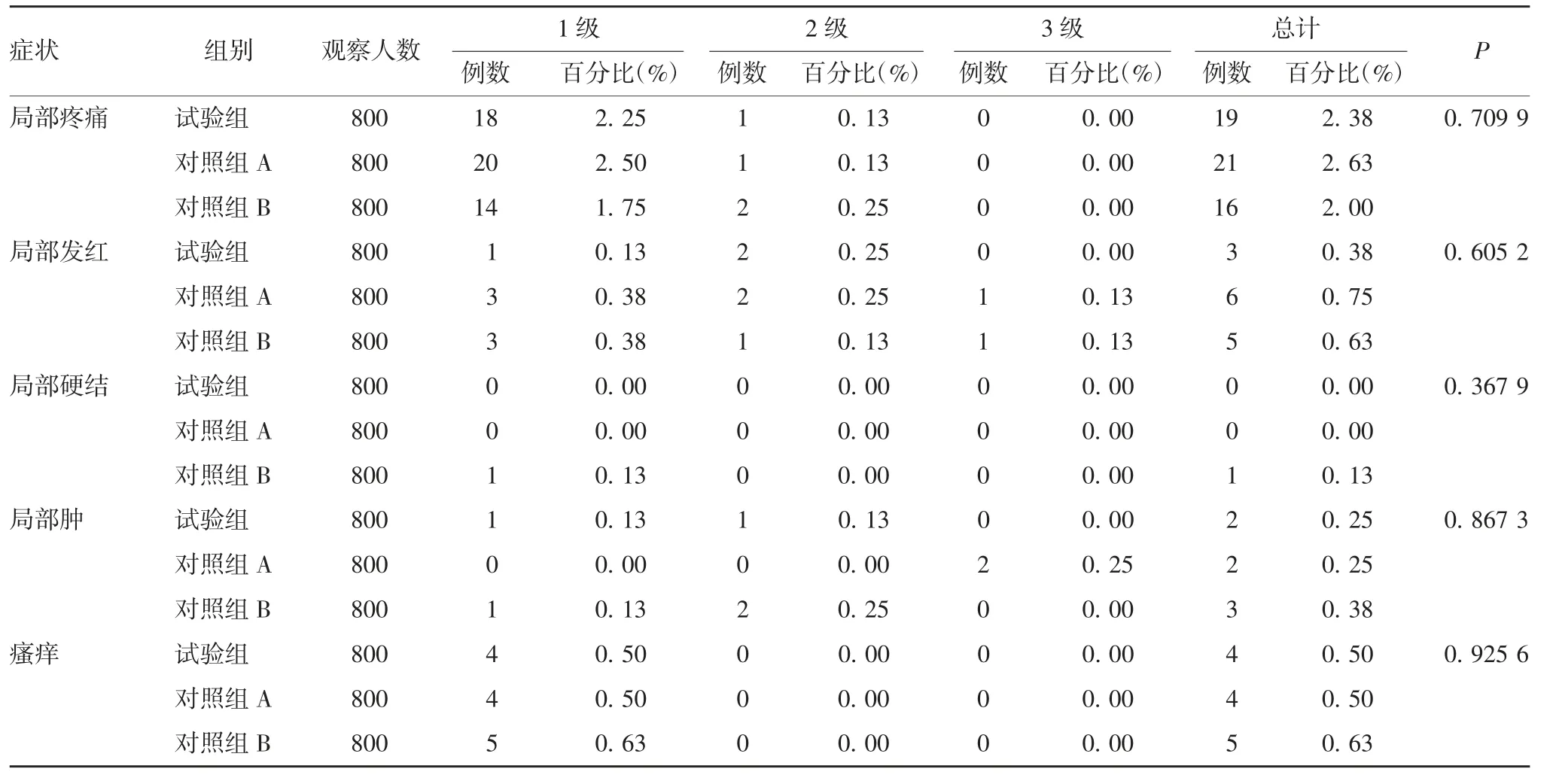
表7 受试者局部反应症状发生情况Tab.7 Incidence of symptoms of local reactions in subjects
2.4.3 SAE 共观察到9例SAE,对照组A 1例和对照组B 3例首次SAE发生于接种疫苗后30 d内,其余均发生于接种后30 d~6个月内,均与疫苗接种无关,见表8。

表8 受试者SAE发生情况Tab.8 Incidence of SAEs in subjects
综上,常见不良反应严重程度以1、2级为主,3级不良反应发生率较低且各组间无差异,未见4级不良反应发生。局部反应症状主要为接种部位疼痛,各种局部反应症状严重程度组间差异均无统计学意义(P>0.05)。共收集到9例SAE,其发生率组间差异无统计学意义(P>0.05),并均与疫苗接种无关。试验组未收集到SAE。
3 讨论
流感会导致严重疾病,并发症,住院和死亡。当流感疫苗病毒株与流行株不匹配时,疫苗保护作用降低[10-12]。四价流感疫苗含有两种B谱系毒株抗原,有效解决了因B型流感病毒错配而造成的疫苗有效性下降的问题,可显著提高对季节性流感的保护效果[13-14]。
自2012年2月世界卫生组织(WHO)推荐将另一个B型毒株纳入四价疫苗,用于北半球2012/2013流感季节[15-16]以来,国内外已有多家企业的四价流感疫苗上市。Sanofi Pasteur和GlaxoSmithKline多项Ⅲ期临床研究表明,接种年龄组从6个月 ~8岁儿童、3~17岁儿童、18~60岁成人、以及60岁以上老人;安全性和反应性方面,季节性四价流感病毒灭活疫苗(QIV)与三价流感病毒灭活疫苗(TIV)相似[17];免疫效果方面,QIV未干扰其他三亚型病毒株的免疫反应,且对另一B亚型流感毒株的免疫反应优于TIV,并能产生对另一B亚型毒株的保护作用,符合FDA生物制品评价和研究中心(Center for Biologics Evaluation and Research,CBER)欧盟人用药物评审协会(Committeefor Medicinal Productsfor Human Use,CHMP)关于流感疫苗的评价标准。
本研究免疫原性结果显示,受试者接种1剂流感疫苗后,试验组流感病毒H1N1、H3N2、BY(B/Yamagata)、BV(B/Victoria)型抗体阳转率和抗体GMT均非劣效于对照组,试验组BY和BV型抗体阳转率和抗体GMT均优于不含相同型别的对照组。试验组流感病毒各型免疫后抗体阳转率均>40%,抗体GMT均较免疫前增长大于2.5倍,血清抗体保护率95%CI下限均达70%,且与对照组无显著差异。
本研究安全性结果显示,试验组、对照组AE发生率组间差异无统计学意义(P>0.05)。常见不良反应为发热和局部疼痛,AE严重程度以1级为主,共观察到9例SAE,均与疫苗接种无关。
本次临床试验结果证明了长春生物制品研究所有限责任公司研制的四价流感病毒裂解疫苗对季节性流感预防的可行性,同时也顺应了替代三价流感疫苗的趋势。四价流感疫苗的安全性及免疫原性与三价流感疫苗相当,新加入的另一种B型抗原未干扰其他型别抗原的免疫原性。四价流感疫苗由于多加入一种B型毒株,对人群防患流感流行提供了更广泛的保护作用。

