环状RNA在炎症所致早产小鼠脑损伤中的作用及机制初步研究
魏思萌 肖谧 郑曦 刘俐
(西安交通大学第一附属医院新生儿科,陕西西安 710061)
[中国当代儿科杂志,2021,23(7):730-734]
母亲孕期炎症反应(如绒毛膜羊膜炎)是目前公认婴儿早产的重要原因。病原体感染后,可经阴道上行到胎膜,或经母血到胎盘使早产发生,甚至引起胎儿炎症反应的激活。同时,胎儿炎症反应的激活可影响其正常的脑神经发育,造成早产儿髓鞘形成、轴突完整性及突触发生等事件受抑制,影响脑白质和深部灰质的发育,从而引起脑结构和功能的改变、行为及认知障碍等严重神经系统后遗症[1-2]。近年来,随着早产儿脑损伤发生机制的不断研究,多种蛋白编码基因如Cdk2基因、Wnt/βcatenin、长链非编码RNA(long non-coding RNA,lncRNA)、炎性细胞因子等被证明参与炎症所致早产脑损伤的发生及发展[3-5],但仍未阐明其调节关键点,转化为临床新防治手段有一定难度。
本课题组已成功建立炎症诱导早产小鼠脑损伤模型,并在证实lncRNA在早产儿脑白质损伤发病机制中起重要作用的基础上[5-6],发现一类环状RNA(circular RNA,circRNA)。circRNA是一类具有稳定闭合环状结构的内源性RNA分子,序列高度保守,在哺乳动物中大量并稳定存在。相比于lncRNA、微 小RNA(microRNA,miRNA)等,circRNA功能及作用机制更丰富[7-9],更易实现对编码基因的多层次体外调控并获得临床应用价值。已有研究表明,circRNA与神经系统发育、分化和生物学功能有密切关系[10-12],但目前circRNA与早产脑损伤的相关性研究甚少。本研究通过微阵列基因芯片技术筛选与炎症诱导早产脑损伤相关的差异表达circRNA,初步探讨circRNA在炎症所致早产脑损伤中的作用,寻找早产脑损伤早期诊治的新突破口。
1 材料与方法
1.1 主要材料与试剂
本研究所用的雌性BALB/c小鼠与雄性C57BL/6小鼠由西安交通大学医学院实验动物中心提供,研究内容已经西安交通大学医学部生物医学伦理委员会批准(2020-229)。所有方法均按照相关指南和规定执行。脂多糖购于美国Sigma公司;GeneChip Mouse Transcriptome(MT)Array 1.0芯片购自美国Affymetrix公司;芯片数据分析由上海康成公司提供;TRIzol购自美国Invitrogen公司。
1.2 炎症诱导早产小鼠脑损伤模型制备
4只C57BL/6雄性小鼠和10只BALB/c雌性小鼠在SPF级环境中饲养至7周龄。适应性喂养1周后,雌雄小鼠按2∶1配种,每日观察2次。检测到阴道栓当日定为妊娠第0天。将孕鼠随机分为炎症早产组(n=3):妊娠17 d时孕鼠腹腔注射适量脂多糖(125μg/kg),在第18天产活仔;非炎症早产组(n=3):孕鼠腹腔注射等量0.9%氯化钠溶液,孕18 d时给予2%异氟醚进行呼吸麻醉,剖宫产法取胎鼠[5-6]。取两组早产小鼠脑组织置于液氮中快速冷却保存。
1.3 样本总RNA的提取与检测
使用TRIzol试剂从胎鼠脑组织中提取总RNA,并使用RNeasy mini试剂盒(Qiagen,Hilden,德国)按照说明书进行纯化。使用1%变性凝胶电泳检测RNA完整性。采用纳米滴分光光度计ND-2000测定RNA浓度和纯度,样品光密度(OD)260/OD280为1.8~2.1,OD260/OD230>1.8为合格样品。
1.4 芯片杂交
两组各取3只仔鼠脑组织,共6个样本。分别对6个样本中提取的总RNA进行circRNA表达分析,用Rnase R(Epicentre Technologies,Madison,美国)消化总RNA,去除线性RNA,丰富circRNA。之后通过随机引物法(Arraystar Super RNA Labeling Kit,美国)扩增并转录成荧光cRNA。将标记的RNA杂交到Arraystar Human circRNA阵列(Rockville,美国)。洗完载玻片后,用安捷伦扫描仪G2505C对阵列进行扫描。采用Agilent Feature Extraction软件(version 11.0.1.1)对获取的阵列图像进行分析。以上芯片测序部分在上海康成公司进行。
1.5 统计学分析
采用SPSS19.0统计软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,两组间比较采用两样本t检验,P<0.05为差异有统计学意义。运用miRanda软件分析预测circRNA可能结合的miRNA。
2 结果
2.1 脑组织样本总RNA质检结果
所有脑组织样本总RNA的OD260/OD280值均在1.8~2.2之间,琼脂糖凝胶电泳可见28S和18S两条核糖体RNA条带(图1),质量检测结果全部通过(表1),可用于后续芯片检测。
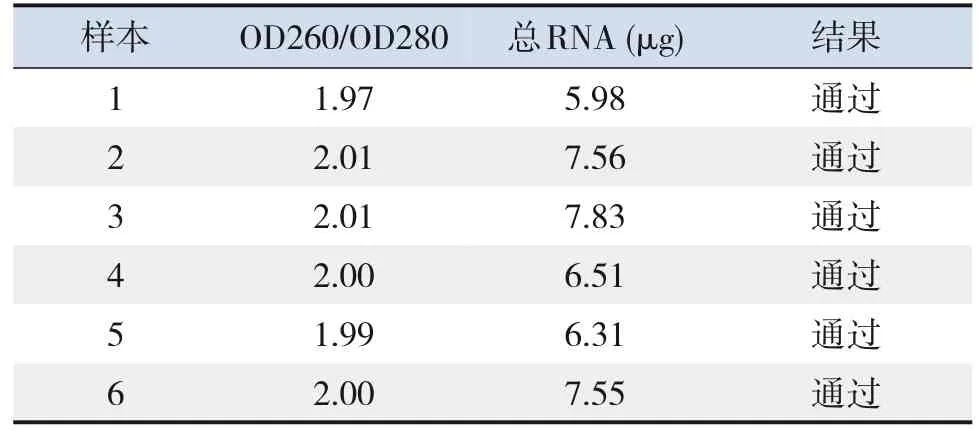
表1 小鼠脑组织RNA质检结果

图1 脑组织样本总RNA电泳图 注:1~3分别为炎症组小鼠脑组织3个样本;4~6分别为非炎症组小鼠脑组织3个样本。
2.2 circ RNA差异表达谱可视分析
将质检合格的6份样本进行芯片检测,将所得芯片结果进行预处理、归一化后选择相对表达量比值在1.5倍以上,且差异有统计学意义的circRNA作为差异表达的circRNA(P<0.05)。根据芯片检测结果绘制散点图,结果显示炎症早产组和非炎症早产组间共筛选出365种差异表达的circRNA,其中差异表达上调有206种,差异表达下调有159种,见图2。

图2 差异表达circ RNA的散点图 图中每个散点代表1种circRNA表达信号,散点颜色由蓝色向红色渐变,代表不同circRNA在样品中的表达量越高。高低绿色斜线为circRNA差异表达倍数的阈值线(差异倍数=±1.5),即绿色高线之上的点为差异表达上调1.5倍以上的circRNA,共206种;绿色低线之下的点为差异表达下调1.5倍以上的circRNA,共159种。
2.3 差异表达circ RNA的数据分析
分别对差异表达上调和下调倍数最高的前10条circRNA进一步分析,发现差异表达的circRNA类型主要为外显子circRNA、重叠区circRNA等,可参与转录、信号转导、凋亡等众多生物学过程。其中上调差异表达倍数最高为circRNA_45982,其差异表达倍数为3.41倍。下调差异表达倍数最高为circRNA_19038,其差异表达倍数为4.70倍。见表2~3。
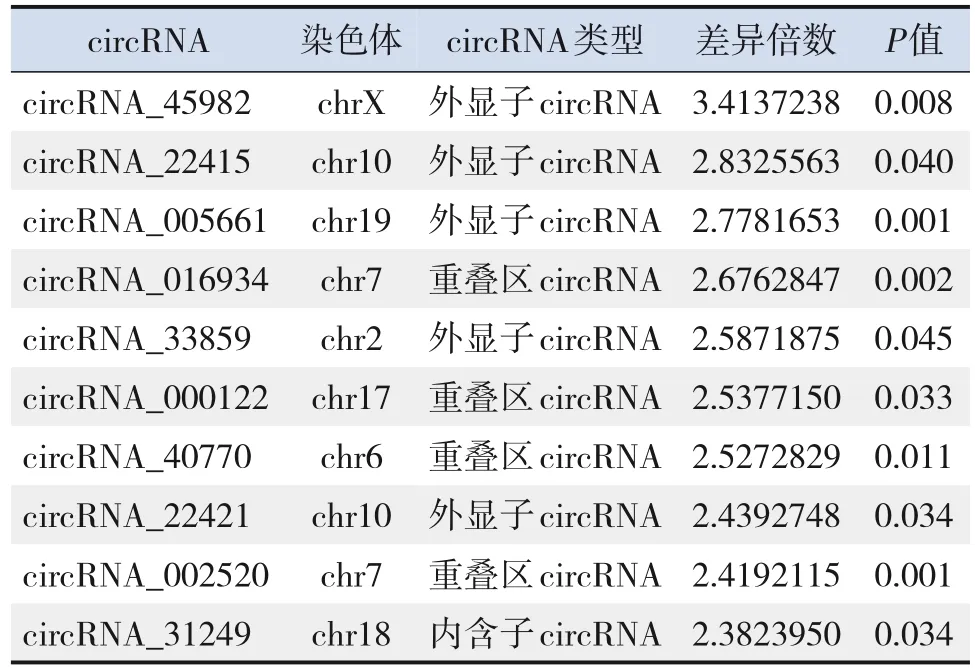
表2 差异表达上调倍数最高的前10条circ RNA
2.4 circ RNA-miRNA共表达分析
通过miRNA靶预测软件预测circRNA和miRNA相互作用的结合位点,结果显示多个circRNA可调节多个目标miRNA,其中1个circRNA可作用数个miRNA,也可见多个circRNA作用1个miRNA。显著差异表达4倍及以上的circRNA及其结合的miRNA见表4。
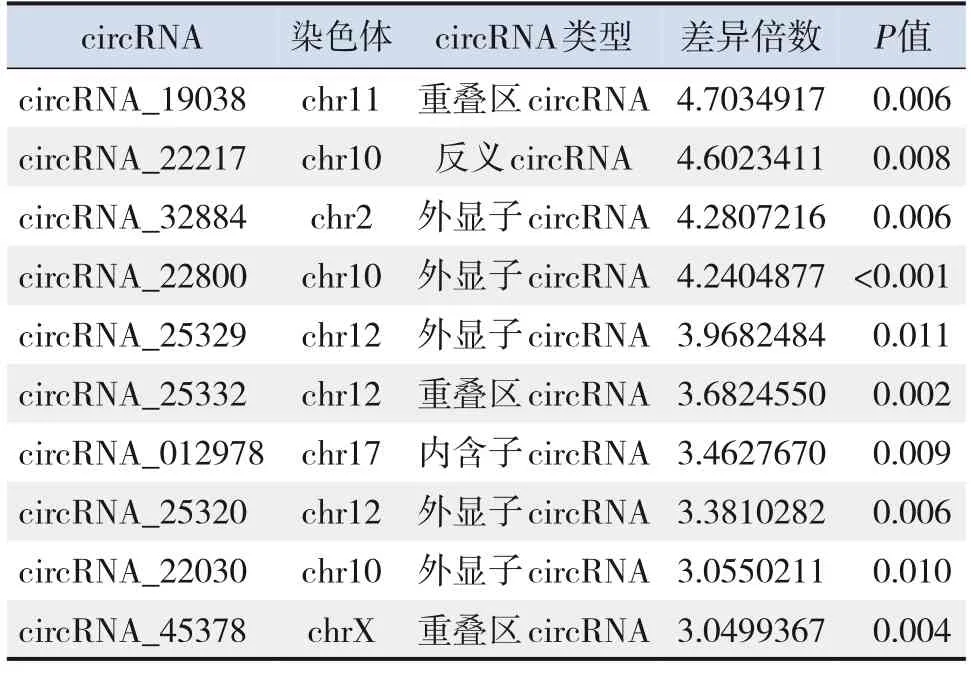
表3 差异表达下调倍数最高的前10条circ RNA

表4 差异表达4倍及以上的circ RNA及其结合的miRNA
3 讨论
目前全球每年有1 200~1 600万婴儿早产,已成为严重的世界公共卫生问题[13]。我国是当今世界早产发生的第二大国,每年早产儿约110~150万,其中早产引发的脑发育异常和损伤发生率较高,约40%~50%幸存者存在运动、认知等近远期后遗症,严重影响早产儿的生长和生活质量[13-14]。因此,深入探究其调控机制,并探索有效的防治措施,已成为急需解决的重要问题。
已有研究表明,中枢神经系统中存在大量的circRNA,这些circRNA不仅与神经系统发育、分化和生物学功能有密切关系,在脑损伤后神经系统的病变和功能失调中也发挥重要调控作用,如circRNA参与缺血性脑卒中、阿尔兹海默症、抑郁症等疾病的发展与调控[15-17]。随着研究的深入,我们发现circRNA的独特结构与功能优势,与线性分子相比,circRNA具有多种调控机制:(1)细胞核内调控亲本基因的转录。(2)作为竞争性内源RNA,与mRNA竞争miRNA的结合位点,从而调控mRNA的表达。(3)可以翻译表达有效蛋白等[9]。因此,circRNA无疑是更具有潜力的新型临床诊断标记物和潜在的治疗靶点。而目前对于早产儿脑白质损伤、脑发育异常的相关circRNA研究甚少。
本研究首次采用微阵列基因芯片对炎症诱导早产小鼠脑损伤相关的差异表达circRNA进行分析。共筛选出365种差异表达的circRNA,其中差异表达上调有206种,差异表达下调有159种。图2结果显示,脑损伤早产鼠脑组织中的circRNA表达谱发生明显变化,其中4个下调circRNA的差异倍数达到4倍以上,下调差异表达倍数最高为cir‐cRNA_19038,其差异表达倍数达到4.70倍。这提示我们差异表达的circRNA很可能参与了早产小鼠脑损伤的发展和调控过程,尤其是circRNA_19038等下调基因可能发挥更重要的调控作用,需进一步研究其可能机制。
miRNA是一类在转录后通过与mRNA结合负性调节其表达的非编码基因。有研究报道,在神经系统调节过程中,circRNA可作为miRNA的海绵吸附体,通过结合特定的miRNA来间接调控mRNA的表达,这对于维持正常脑功能至关重要[18]。为进一步阐明差异表达circRNA在早产小鼠脑损伤中的调控机制,本研究对差异表达倍数4倍以上的circRNA进行miRNA结合预测分析并发现,这些变化的circRNA均有多个串联的结合位点结合多个特定的miRNA来影响miRNA对mRNA的调控,从而影响更多的生物过程,如转录、信号转导、凋亡、细胞周期、炎症反应等。其中,差异表达倍数最高的circRNA_19038可能通过结合miR-709、miR-669n、miR-1187、miR-574-5p和miR-466c-5p调控相关靶基因。据国外与上述miRNA相关文献报道,miR-709可通过lncRNA Mtss1的靶向调控参与并调节脑出血后继发炎症性脑损伤的发生与发展[19]。Li等[20]证明miR-709可通过Wnt/β-catenin通路在脂多糖诱导的炎症反应中发挥调节作用。这提示我们,circRNA_19038很可能通过结合miR-709在早产儿炎症性脑损伤中发挥重要的调控作用。另有文献发现,miR-669n可能通过调控基因Vegfa参与血管新生的过程[21]。Vegfa是神经系统发育中重要的调控基因,已有研究证实,Vegfa参与调节血管神经发生、神经元再生及分化过程,且参与多条与炎症反应相关的通路[22]。本课题组前期研究已发现基因Vegfa可通过lncRNA-AK016022调控参与早产儿炎症性脑损伤的发生发展[5-6]。因此,我们猜想circRNA_19038可能通过与miR-669n、miR-709的结合进一步调节下游靶基因Vegfa的表达,可将其作为下一步研究思路深入挖掘。
综上所述,本研究证实炎症作用使早产鼠脑组织中circRNA的水平发生明显变化,并且筛选出差异表达的circRNA及相关miRNA,可以作为后续实验的潜在调控点。本研究的局限性在于通过芯片筛选的差异表达circRNA尚未进行实验验证。下一步我们将对目标circRNA进行qRT-PCR验证,并在此基础上进一步寻找其下游作用通路及其靶基因,探索与Vegfa、Wnt/β-catenin、lncRNA等已知调控基因及通路的关系,设计早期体外靶向调控目标circRNA的可能性,为临床提供改善早产儿脑损伤预后的新治疗方法提供思路。

