纤维蛋白在聚(2-甲基-2-噁唑啉)/聚丙烯酸混合聚合物刷上的吸附-脱附行为
胡飞,朱良宇,王雨晨,何康,ATIF Muhammad,王延梅
(中国科学技术大学化学与材料科学学院,合肥230026)
纤维蛋白是肝细胞在肝脏合成的一种高度丰富的血浆糖蛋白,它在凝血、血小板活化、炎症反应和白细胞结合中起着重要作用。纤维蛋白的等电点约为5.8,重均分子量约为3.4×105[1,2],结构为棒状(47 nm×5 nm×5 nm)[3,4]。它是一种黏附性极强的蛋白,很容易在硅、金等材料表面发生吸附[5]。目前,纤维蛋白在材料表面的吸附主要有两种机理,即随机吸附机理和侧向吸附机理[6,7]。值得注意的是,纤维蛋白分子上存在不均匀电荷分布,它的末端侧臂在pH为3~10时带正电荷。因此,当环境的pH高于纤维蛋白等电点时,它的末端侧臂与带负电荷的硅、金等材料的表面会产生强烈的吸附,从而出现蛋白质在等电点上发生“wrong side”吸附的现象[8,9]。纤维蛋白单分子层在基底或各种合成材料上的吸附会诱导血小板黏附,从而影响材料表面的功能[10],通过在材料表面接枝具有刺激响应功能的二元混合聚合物刷可以实现对纤维蛋白的选择性吸附和释放行为。
具有刺激响应功能的二元混合聚合物刷通常是由两种不同功能的聚合物在材料表面形成的聚合物刷,其中一种聚合物具有抗蛋白质吸附的功能,另一种具有刺激响应功能[11,12]。聚丙烯酸(PAA)是常见的刺激响应性聚合物,当PAA接枝到材料表面形成聚合物刷后,PAA链的构象会受溶液中pH和离子强度(I)的影响。当环境pH大于PAA的酸度系数时,羧基会发生解离,PAA链带负电,在水溶液中呈伸展状态。在保持环境pH不变的条件下增大离子强度,静电屏蔽效应会导致PAA链的塌缩。因此,将PAA和具有抗蛋白质吸附功能的聚合物接枝到基底表面形成的混合聚合物刷,在研究蛋白质的吸附-脱附行为中有着极其重要的作用。Bratek-Skicki等[13]制备了由PAA和具有抗蛋白质吸附功能的聚乙二醇(PEO)组成的混合聚合物刷,研究表明纤维蛋白可分别在pH = 9、I= 10−3mol/L(I为离子强度)和pH = 9、I= 10−2mol/L的条件下产生吸附,在pH =9、I=0.15 mol/L的条件下能够脱附,而且纤维蛋白的吸附量随PEO分子量的增大而减少。PEO是一种通用的亲水性抗污聚合物[14-16],在材料表面涂覆上PEO可以一定程度地阻抗纤维蛋白的吸附[17],并且PEO的分子量越大,PEO链变形能力越强,对纤维蛋白的阻抗能力越强[18]。然而,PEO在生物体内长期使用时会发生氧化降解[19,20]。聚(2-烷基-2-噁唑啉)(PAOx)是一类应用广泛的类肽聚合物,可通过2-噁唑啉单体的活性阳离子开环聚合(CROP)合成,得到的聚合物具有分子量可控、分子量分布窄的特点,同时聚合物的末端或侧链易于功能化[21,22]。相对于PEO,PAOx具有更良好的亲水性、生物相容性和在氧化性介质中的高度稳定性[23-25],因此这类聚合物在抗污领域受到了广泛关注。Pan等[26,27]采用聚多巴胺(PDA)作为黏结剂,通过末端氨基化聚(2-甲基-2-噁唑啉)(PMOXA-NH2)和末端巯基化PAA(PAA-SH)在各种基材(包括玻璃、硅和金)上的顺序接枝,制备了PMOXA/PAA混合聚合物刷。通过控制PAA的聚合度和接枝密度,改变溶液的pH和I,实现了对牛血清蛋白和溶菌酶87%以上的脱附率。
本文研究了纤维蛋白在PMOXA/PAA混合聚合物刷上的吸附-脱附行为。首先合成聚合度分别为20、40和60的PMOXA-NH2和聚合度为90的PAA-SH,以PDA为黏结剂在硅片等基底上制备了一系列的均聚物刷和混合聚合物刷,通过X-射线光电子能谱(XPS)、可变角光谱椭偏仪(VASE)对其进行了表征,并利用水接触角(WCA)研究了聚合物刷表面的亲/疏水性。然后,选取pH=9、I= 0.01 mol/L作为纤维蛋白吸附条件,pH=9、I=0.15 mol/L为脱附条件,用荧光显微镜和表面等离子体共振(SPR)分别定性和定量地研究了混合聚合物刷对纤维蛋白的吸附-脱附行为。本工作扩大了刺激响应性涂层的生物应用范围,在生物传感器的设计、药物输送、蛋白质吸附-脱附等生物应用中具有广阔的发展前景。
1 实验部分
1.1 原料和试剂
丙烯酸(AA)、二甲基甲酰胺(DMF):分析纯,国药集团化学试剂有限公司,通过减压蒸馏提纯;2-甲基-2-噁唑啉(MOXA):分析纯,Sigma-Aldrich化学品有限公司,用氢化钙干燥后蒸馏提纯;偶氮二异丁腈(AIBN):分析纯,天津光复精细化工研究所,通过乙醇重结晶提纯;盐酸多巴胺、三氟甲磺酸甲酯(MeOTf):分析纯,Sigma-Aldrich化学品有限公司;水合肼、邻苯二甲酰亚胺钾:分析纯,阿拉丁化学试剂(上海)有限公司;三(羟甲基)氨基甲烷(Tris):工业纯,国药集团化学试剂有限公司;乙醇胺、乙腈、三氯甲烷、乙醚、十二烷基三硫代碳酸酯:分析纯,国药集团化学试剂有限公司;二甲基亚砜(DMSO):分析纯,生工生物有限公司;异硫氰酸荧光素(FITC)、纤维蛋白:生物试剂纯度,Sigma-Aldrich化学品有限公司,纤维蛋白等电点约为5.8,Mr约为3.4×105;溶液的pH和I通过盐酸(1 mol/L)、氢氧化钠溶液(1 mol/L)和氯化钠溶液调节;实验用水为去离子水。
1.2 测试与表征
X-射线光电子能谱(XPS)仪:英国VG公司ESCALAB MK II型,激发源为Al(Kα)单色射线(能量1 486.6 eV),光电子的起始角为90°,光斑尺寸为500μm。
可变角光谱椭偏仪(VASE):美国J.A.Woollam公司M-2000型,光谱范围为370~1 000 nm,入射角为65°和75°,用Complete Easy 4.81软件进行拟合,基于广义柯西层模型得到涂层厚度,每组设置3个平行样。
接触角(CA)测量仪:美国KINO公司SL200KS型,测量硅片表面的静态水接触角所用水滴为去离子水,体积为2μL,样品测量前在不同pH和I的溶液中浸泡0.5 h,并立即用氮气干燥,每组设置3个平行样。
光学显微镜:日本Olympus公司BX81型,配备卤素灯、U-MNG2过滤器(λexit= 470~ 490 nm,λemit>510 nm)和DP72摄像机。
表面等离子体共振仪:美国GE Healthcare公司BioScience T200型,实时研究蛋白质吸附和脱附行为,通过共振角的变化(ΔRU)来定量蛋白质的吸附量和脱附量。在SPR技术中,分子相互作用所引起的共振角变化能反映出结合在传感芯片表面的物质质量的变化,ΔRU=10相当于1 cm2芯片表面上蛋白质的质量改变约1.0 ng。
1.3 聚合物的制备[26, 28]
以MeOTf为引发剂引发MOXA的阳离子开环聚合(引发剂和单体的物质的量之比分别为1∶23,1∶43,1∶65),加入邻苯二甲酰亚胺钾封端,再加入水合肼,制得PMOXA-NH2。通过核磁共振氢谱(1H-NMR)得到PMOXA 的聚合度分别为20、40和60(对应的数均分子量分别为1 731、3 431和5 131),理论链长[27]分别为7.24、14.49 nm和21.73 nm。
以AIBN为引发剂、十二烷基三硫代碳酸酯为链转移剂、AA为单体(引发剂和单体的物质的量之比为1∶110),通过RAFT聚合合成PAA,再加入乙醇胺制得PAA-SH。通过1H-NMR得到PAA 的聚合度为90(对应的数均分子量为6 600),理论链长[27]为25.12 nm。
1.4 混合聚合物刷的制备
混合聚合物刷的制备过程如图1所示。将基底(玻璃片、硅片和金片)相继在丙酮、乙醇、水中超声清洗20 min,氮气吹干后浸入Piranha溶液(体积比为7∶3的浓硫酸和双氧水混合物)于50°C下浸泡12 h,然后用乙醇和水冲洗,氮气吹干。将清洗后的基底浸入多巴胺的tris-HCl溶液(2 mg/mL,pH =8.5)中,于室温下振荡一定时间(硅片和玻璃片为4 h,金片为3 h)后,用去离子水冲洗30 s,氮气吹干。由于PMOXA-NH2的氨基和PAA-SH的羧基会发生反应,因此通过顺序接枝的方法制备混合聚合物刷。先将涂有PDA的基底浸入PMOXA-NH2的tris-HCl溶液(3 mg/mL,pH =8.5)中,室温下反应12 h,用去离子水冲洗30 s,氮气吹干。再浸入PAA-SH的tris-HCl溶液(2 mg/mL,pH = 8.5)中于50°C反应24 h,用乙醇和去离子水冲洗1 min,氮气吹干。将涂有PDA的基底在PMOXA-NH2的tris-HCl溶液(3 mg/mL, pH= 8.5)或PAA-SH的tris-HCl溶液(2 mg/mL,pH=8.5)中分别浸泡12 h和24 h,制备纯PMOXA或PAA刷作为对照组。在PDA涂层表面制备的混合聚合物刷记为PMOXA(a)-PAA,在PDA涂层表面制备的纯PMOXA或PAA刷记为PMOXA(a)或PAA,其中a表示聚合物PMOXA-NH2的聚合度。
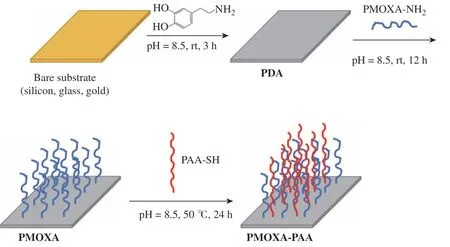
图1 PMOXA-PAA混合聚合物刷制备示意图Fig.1 Schematic illustration for the preparation of PMOXA-PAA mixed polymer brushes
1.5 荧光标记纤维蛋白定性吸附-脱附实验
1.5.1 荧光标记纤维蛋白(FITC-Fib)的制备[29,30]取10 mg纤维蛋白和1 mg FITC于离心管中,加入9.5 mL交联液(0.046 mol/L NaHCO3、0.004 mol/L Na2CO3,pH =9)和0.5 mL DMSO,在黑暗中振荡1 h溶解均匀,然后于4°C反应4 h,冷冻离心除去未结合的FITC,于−18°C冷冻保存。
1.5.2 FITC-Fib定性吸附-脱附实验 将裸玻璃片和聚合物修饰后的玻璃片在室温和黑暗条件下浸泡在FITCFib溶液(1.0 mg/mL,pH =9、I= 0.01 mol/L)中2 h,取出后用pH = 9、I=0.01 mol/L的溶液洗涤3次。随后,将上述样品在pH=9、I= 0.15 mol/L的溶液中浸泡1.5 h,取出后用相同溶液洗涤3次,氮气干燥。通过Olympus BX81型光学显微镜拍摄荧光图片,用Image J软件测量荧光强度。每组设置3个平行样。
1.6 SPR定量研究纤维蛋白吸附-脱附实验
将聚合物修饰前后的金片安装在SPR样品架上,用pH = 9、I= 0.01 mol/L的溶液初始化2次。再用pH = 9、I=0.01 mol/L的溶液冲洗样品800 s以获得基线信号,将纤维蛋白溶液(0.1 mg/mL,pH=9、I=0.01 mol/L)通过金片表面900 s,使蛋白质在金片表面吸附。随后通过3个连续步骤清洗:(1)用pH= 9、I=0.01 mol/L的溶液通过样品表面600 s,除去表面吸附不牢固的蛋白质;(2)用pH=9、I=0.15 mol/L的溶液通过样品表面600 s,进行蛋白质的脱附;(3)用pH = 9、I= 0.01 mol/L的溶液冲洗样品表面600 s。
2 结果与讨论
2.1 均聚物刷和混合聚合物刷的表征
通过XPS研究了修饰前后硅片表面的化学组成,结果如图2和表1所示。裸硅片表面有很强的Si和O信号,并且由于样品制备过程中不可避免存在污染,导致裸硅片表面也出现了微弱的C和N信号。裸硅片经PDA修饰后,C和N的信号峰强度明显增强,Si和O的信号峰强度明显降低,N和O的摩尔分数比(χN/χO)增大,C1s峰主要包含C―N/C―O(286 eV)、C―C/C―H(284.8 eV)2个峰,同时包含微弱的C=O(288.05 eV)峰,该峰与PDA氧化重排的过程有关。当PMOXA涂覆到PDA涂层表面后,N信号进一步增强,χN/χO增大,C1s峰包含C―N/C―O(286 eV)、C―C/C―H(284.8 eV)和N―C=O(288.05 eV)3个峰。当PAA涂覆到PDA涂层表面后,166.4 eV处出现了明显的S信号(图2(a)),与此同时,C1s峰包含COOH(288.4 eV)峰,χN/χO相对于PDA涂层的有所减小。对于混合聚合物刷,均可以观察到S信号,并且混合聚合物刷中的PMOXA聚合度越大,对应涂层的S含量越低,χN/χO越大,混合聚合物刷的C1s峰同时包含N―C=O峰和COOH峰,表明同时存在PMOXA和PAA。这些结果表明在PDA基底上成功制备了聚合物刷。
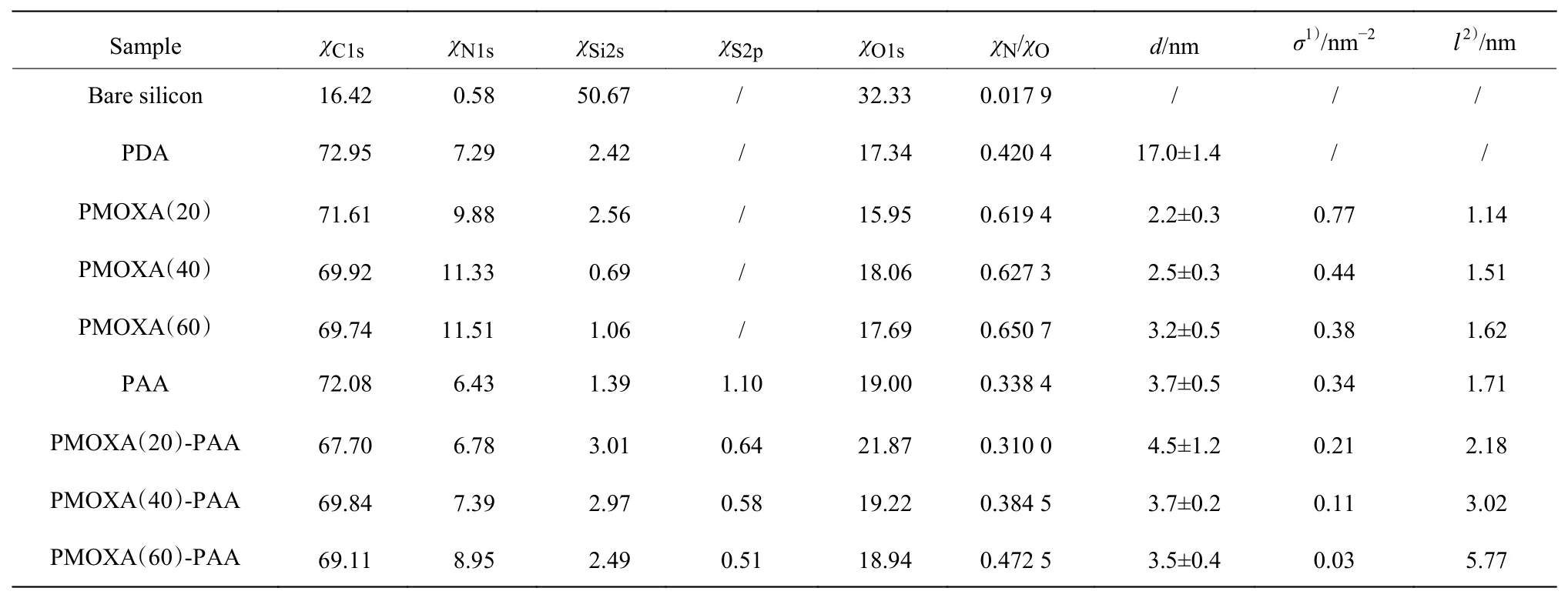
表1 硅片修饰前后表面元素的摩尔分数及聚合物刷的相应厚度、接枝密度和接枝链间距Table 1 Mole fraction of elements on the bare and modified silicon surfaces,and the corresponding thickness,grafting density and grafting chain spacing of the polymer brushes

图2 (a)硅片经修饰前后的XPS谱图;(b,c,d, e)修饰硅片的C1s高分辨XPS谱图Fig.2(a)XPS patterns of bare and modified silicon wafers;(b,c,d,e)High-resolution XPS spectra of C1s peaks of modified silicon wafers
表1 同时给出了涂层厚度(d)和相应涂层聚合物的接枝密度(σ)和链间距(l)。在室温下振荡4 h后,在硅片上得到了厚度为17.0 nm的致密PDA涂层。在PDA表面接枝PMOXA后,涂层的厚度随PMOXA聚合度的增加而增加,PMOXA涂层的厚度为2.2~3.2 nm;接枝密度随PMOXA聚合度的增加而减小,链间距随PMOXA聚合度的增加而增加。在PDA的表面接枝PAA后,PAA涂层的厚度是3.7 nm。混合聚合物刷PMOXA(20)-PAA、PMOXA(40)-PAA和PMOXA(60)-PAA的厚度分别为4.5、3.7 nm和3.5 nm。结果表明,混合聚合物刷的厚度随PMOXA聚合度的增大呈现降低趋势。这里厚度降低趋势是顺序接枝导致的,第一步接枝的PMOXA涂层厚度越大,链长越长,产生的位阻效应则越大,从而使第二步PAA的涂覆量减少,涂层整体厚度降低。由XPS结果可知,混合聚合物刷中的PMOXA聚合度越大,对应涂层的S含量越低,χN/χO越大,与厚度结果一致。
2.2 涂层的亲/疏水性
固定pH =9,聚合物修饰前后的硅片分别在I=0.01 mol/L和I=0.15 mol/L的溶液中浸泡之后的静态水接触角如图3所示。裸硅片分别在I= 0.01 mol/L和I= 0.15 mol/L的溶液中浸泡后,接触角均在6°~9°,表明裸硅片经Piranha溶液清洗之后,亲水性增强。表面涂覆PDA之后,分别在I=0.01 mol/L和I= 0.15 mol/L的溶液中浸泡后,接触角分别增至39°和37°。当PMOXA接枝到PDA表面后,分别在I=0.01 mol/L和I=0.15 mol/L的溶液中浸泡后,接触角均低于15°,表明PMOXA涂层具有良好的亲水性。随着PMOXA聚合度从20增加至60,接触角从14°下降至6°,表明PMOXA的聚合度越大,涂层的亲水性越强。当PAA接枝到PDA表面后,在I=0.01 mol/L的溶液中浸泡后,接触角为52°;在I=0.15 mol/L的溶液中浸泡后,接触角下降至27°。高离子强度下,静电屏蔽效应会造成PAA链塌缩,同时高离子强度可能降低固液界面张力,促使PAA表面的接触角降低[31]。对于PMOXA-PAA混合聚合物刷,在I=0.01 mol/L的溶液中浸泡后,随着PMOXA的聚合度从20增加至60,接触角从52°降低至41°;在I=0.15 mol/L的溶液中浸泡后,混合聚合物刷的接触角均下降至20°以下,PMOXA(60)-PAA刷表面接触角仅为13°。上述结果表明,当I=0.01 mol/L时,混合聚合物刷中PAA链处于伸展状态,居于混合聚合物刷上层,使表面疏水性增加;当I=0.15 mol/L时,由于离子强度的增加使PAA链塌缩,此时PMOXA链居于混合聚合物刷上层,涂层表面亲水性增强。因此通过环境条件的调控,可控制PMOXA-PAA混合聚合物刷的构象,从而达到调节涂层性能的目的。
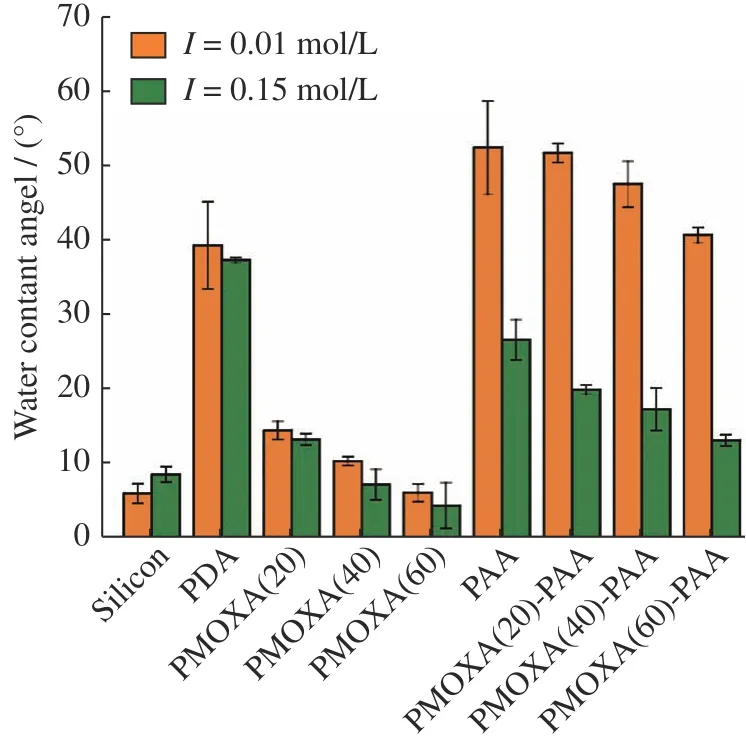
图3 裸硅片和修饰硅片的WCA值Fig.3 WCA values of bare and modified silicon wafers
2.3 纤维蛋白吸附-脱附行为
涂层亲/疏水性研究结果表明,在pH=9、I=0.01 mol/L和pH 9、I=0.15 mol/L条件下,混合聚合物刷表面分别由PAA链和PMOXA链起主导作用,因此可将上述条件分别作为纤维蛋白在混合聚合物刷表面吸附和脱附的实验条件。首先通过荧光显微镜定性研究了聚合物刷对纤维蛋白的吸附-脱附行为。固定pH=9,裸玻璃片和修饰玻璃片在I=0.01 mol/L和I= 0.15 mol/L条件下吸附FITC-Fib的荧光图像和相对荧光强度分别如图4、图5所示(将pH=9、I=0.01 mol/L条件下,PAA修饰玻璃片吸附FITC-Fib的相对荧光强度设定为100%)。

图4 裸玻璃片和修饰玻璃片吸附FITC-Fib的荧光图像Fig.4 Fluorescence images of FITC-Fib adsorbed on bare glass and modified glass
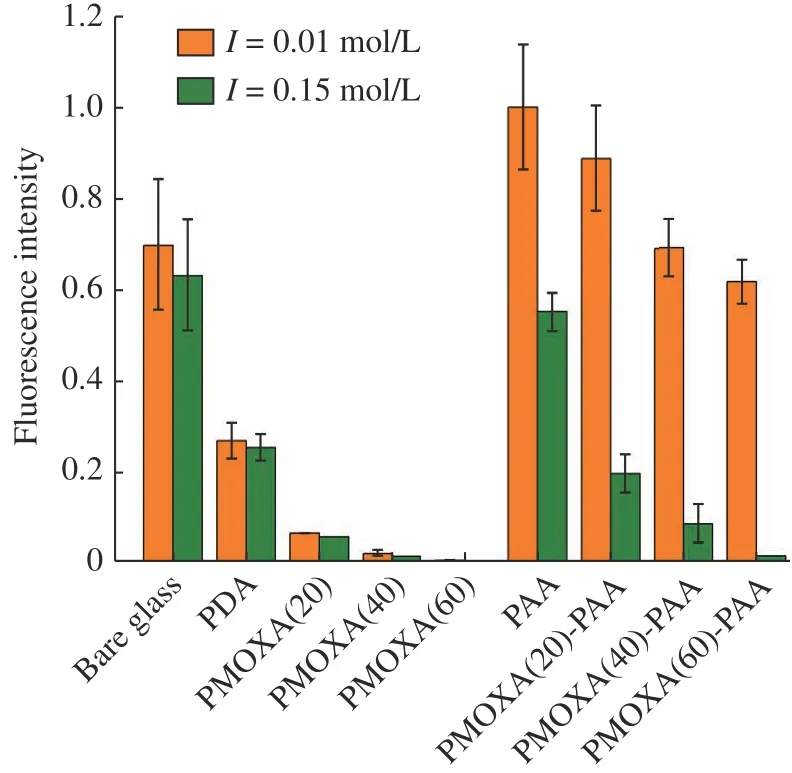
图5 样品的相对荧光强度Fig.5 Relative fluorescence intensities of samples
在I=0.01 mol/L条件下,裸玻璃片表面的大量荧光表明裸玻璃片表面吸附了大量的纤维蛋白,并且在I= 0.15 mol/L条件下,荧光强度并无明显改变。经PDA修饰后,荧光强度降低,且在吸附和脱附条件下无明显差异。接枝PMOXA后,在2种条件下荧光强度都非常低,表明PMOXA可以有效阻抗纤维蛋白的吸附,而且随PMOXA聚合度增加,荧光强度降低,PMOXA(60)刷的荧光强度仅为0.1%。将PAA接枝到PDA表面后,在I=0.01 mol/L条件下,PAA涂层的荧光强度为100%,表明PAA涂层会大量吸附纤维蛋白。在I=0.15 mol/L条件下,荧光强度下降,脱附率为45%。对于PMOXA-PAA混合聚合物刷,在I= 0.01 mol/L条件下,都呈现了较强的荧光,而且随着PMOXA聚合度的增大,荧光强度下降。表明混合聚合物刷依然对纤维蛋白保持了较高的吸附量,且随着混合聚合物刷中PMOXA聚合度的增加,纤维蛋白吸附量呈现下降趋势。在I=0.15 mol/L条件下,相对荧光强度下降,且PMOXA的聚合度越大,下降越明显,表明纤维蛋白的脱附率越高,PMOXA(60)-PAA刷对纤维蛋白可达到90%以上的脱附率。
在选定条件下,为了进一步研究蛋白质在材料表面的吸附,采用SPR对纤维蛋白的吸附-脱附行为进行了实时研究。固定pH=9、I=0.01 mol/L,纤维蛋白在裸金片和不同聚合度PMOXA涂层金片表面上的吸附曲线如图6所示。裸金片对纤维蛋白的吸附量是681.9 ng/cm2,而PMOXA刷对纤维蛋白的吸附量随PMOXA聚合度的增加而下降,PMOXA(60)刷的吸附量降低至67.7 ng/cm2,相对裸金片,纤维蛋白的吸附量下降了90.1%。结果表明PMOXA刷能有效抑制纤维蛋白的吸附,并且抑制效果随着PMOXA聚合度的增大而增强。根据图3的结果可知,PMOXA的聚合度越大,涂层表面的亲水性就越强,亲水性的提高能明显改善聚合物涂层的抗污能力。与此同时,PMOXA链长的增加会产生更多的空间位阻效应,能有效增强与蛋白质之间的体积排斥作用,从而提高涂层的抗污性能[32,33]。
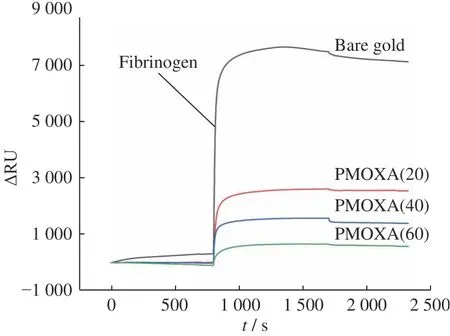
图6 纤维蛋白在裸金片和不同聚合度PMOXA涂层金片上吸附的SPR图(pH = 9, I = 0.01 mol/L)Fig.6 SPR sensorgram of fibrinogen adsorption on bare and PMOXA-coated gold surface with different degrees of polymerization(pH = 9, I = 0.01 mol/L)
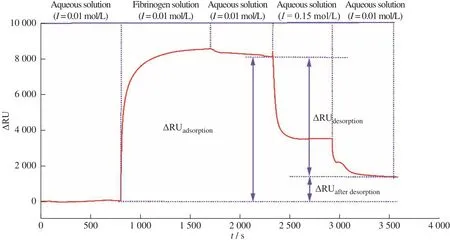
图 7纤维蛋白在PMOXA(60)-PAA混合聚合物刷表面吸附-脱附的SPR图Fig.7 SPR sensorgram of fibrinogen adsorption and desorption on PMOXA(60)-PAA mixed polymer brush surface
聚合物刷分别在pH=9、I=0.01 mol/L和pH 9、I=0.15 mol/L下对纤维蛋白的吸附-脱附SPR过程如图7所 示,吸 附 量(Δmadsorption)和 脱 附 后 剩 余 量(Δmafterdesorption)以 及 脱 附 率[(Δmadsorption−Δmafterdesorption)/Δmadsorption×100%]结果如表2所示。裸金片的吸附量为681.9 ng/cm2,脱附率为17.7%。PDA修饰之后,吸附量增至780.7 ng/cm2,脱附率为1.3%。接枝上PAA之后,涂层对纤维蛋白的吸附量达到1 318.9 ng/cm2,脱附率为44.3%。当混合聚合物刷中PMOXA聚合度从20增大至60,对纤维蛋白的吸附量从1 238.8 ng/cm2降低至806.8 ng/cm2,但脱附率从66.6%提高至83.5%。
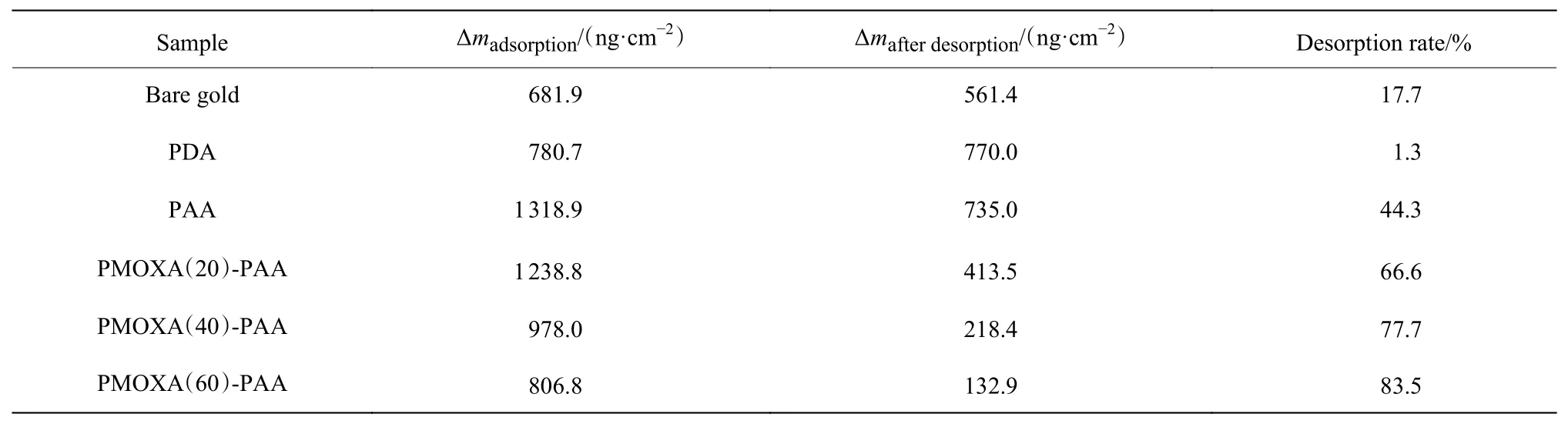
表2 根据SPR数据计算纤维蛋白吸附量、脱附后剩余量和脱附率Table 2 Mass of fibrinogen adsorption,remaining mass after desorption,and desorption rate based on SPR data
结合混合聚合物刷表面亲/疏水性研究实验和纤维蛋白的定性、定量研究实验,推测混合聚合物刷对纤维蛋白吸附和脱附的可能机理如图8所示。在pH=9、I=0.01 mol/L条件下,PAA链在水溶液中伸展并带有负电荷,同时所有混合聚合物刷中PAA的链长(25.12 nm)都较PMOXA的链长长(聚合度20、40和60的PMOXA链长分别为7.24、14.49 nm和21.73 nm),因此,PAA链居于混合聚合物刷上层,在混合聚合物刷中起着主导作用,尽管此时环境pH高于纤维蛋白的等电点(约为5.8),纤维蛋白净电荷为负电荷,但是由于其不均匀的电荷分布,使其带有正电荷的末端侧臂仍会与上层PAA链发生侧向吸附[8,13]。从表1的结果可知,随着混合聚合物刷中PMOXA的聚合度增加,PMOXA层的厚度增大,PAA接枝密度降低,因此纤维蛋白的吸附量随PMOXA聚合度增加而出现下降趋势。在pH=9、I= 0.15 mol/L条件下,高离子强度产生静电屏蔽效应,引起PAA链的塌缩,促使纤维蛋白脱附,同时暴露在混合聚合物刷中上层的PMOXA链使涂层亲水性显著提高,进一步阻抗纤维蛋白的吸附。从图5的结果可知,PMOXA对纤维蛋白的阻抗能力随PMOXA的聚合度增加而增大,所以混合聚合物刷对纤维蛋白的脱附率也随PMOXA聚合度的增加而增大。对于PMOXA(60)-PAA刷,此时在PAA链塌缩、长链PMOXA优异的亲水性和抗蛋白质排斥体积效应的协同作用下,对纤维蛋白脱附率高达83.5%,实现了对蛋白质的吸附和释放功能的调控。该条件下的高脱附率也表明PAA链在高离子强度下的塌缩没有受到PMOXA链之间的位阻效应干扰,体现了PMOXA-PAA混合聚合物刷的高效性和可控性。
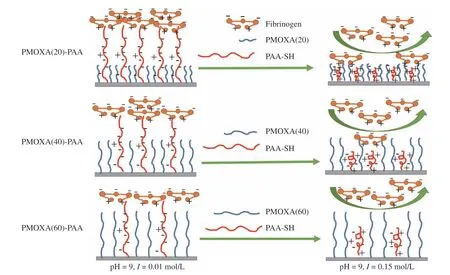
图8 混合聚合物刷对纤维蛋白吸附和脱附的可能机理Fig.8 Possible mechanism of adsorption and desorption of fibrinogen on mixed brushes
3 结论
(1)在不同基底表面制备了组成可控的PMOXA-PAA混合聚合物刷。
(2)当pH=9,离子强度由0.01 mol/L向0.15 mol/L转变时,混合聚合物刷表面会从相对疏水状态转变为亲水状态。
(3)增加PMOXA的聚合度会减少混合聚合物刷对蛋白质的吸附量,同时也会增加混合聚合物刷对蛋白质的脱附率。
(4)聚合度60的PMOXA和聚合度90的PAA以质量比3∶2顺序接枝制备的混合聚合物刷,对纤维蛋白的脱附率可达到83.5%。

