基于线粒体DNA控制区序列的重庆岩原鲤人工养殖群体遗传多样性分析
岳华梅 阮 瑞 曹 宏 周 莉 蒋 伟 李 双 李创举
(1. 中国水产科学研究院长江水产研究所, 农业部淡水生物多样性保护重点实验室, 武汉 430223; 2. 中国科学院水生生物研究所, 武汉 430072; 3. 重庆市水产科学研究所, 重庆 400020)
岩原鲤(Procypris rabaudi), 隶属鲤形目, 鲤科,鲤亚科, 原鲤属, 是我国特有的重要经济鱼类。其主要分布于长江上游干流、支流及金沙江中上游,是一种栖居于岩石缝间的底层鱼, 以四川境内嘉陵江和岷江分布较多[1]。岩原鲤成鱼为杂食偏肉食性鱼类, 主要摄食底栖动物, 如淡水壳菜、蚬、小螺等软体动物和摇蚊幼虫、蜉蝣目和毛翅目幼虫等[2]。由于过度捕捞、环境污染及长江上游大型水坝建立对其栖息环境的破坏, 岩原鲤野生资源锐减, 濒临灭绝, 现已被列入《中国濒危动物红皮书》[3,4]。目前其资源养护手段主要为人工繁殖个体增殖放流。然而, 在岩原鲤人工繁殖过程中, 繁育场面临着有效繁殖群体过小、近亲交配和逆向选择等问题。因此在进行岩原鲤人工育种时有必要对后备亲鱼的遗传背景进行分析, 以抑制养殖群体的种质退化和防止因近交衰退而造成后代成活率降低和生长速度减慢等。
线粒体DNA(mtDNA)呈母系遗传, 具有较高的突变性, 突变固定后形成的多态性位点反映出群体遗传特性、种群分化和种属关系等特点[5,6]。线粒体控制区(Control region, 又称D-loop)是线粒体上的一段非编码区, 位于mtDNA的tRNA-Pro 和tRNAPhe之间, 因缺乏编码选择压力而比其他线粒体基因的进化速率更快, 其碱基替换率比mtDNA的其他区域高5—10倍, 是线粒体基因组中最具多态性的片段, 已成为探讨种群内部遗传多样性和分子系统地理学的良好材料[7—9]。本研究旨在利用D-loop部分序列研究重庆地区岩原鲤人工养殖群体的遗传多样性, 以期为人工繁殖中亲鱼的选择, 避免近交退化及提高用于增殖放流人工繁殖群体的遗传多样性等提供科学依据。
1 材料与方法
1.1 样品采集
实验所用175尾岩原鲤 [全长(36.18±3.14) cm,体重(597.97±166.40) g] 样本采自重庆市农业投资集团养殖基地, 其中117尾个体采自长寿养殖基地,58尾样本采自涪陵养殖基地。分别取鳍条样本, 采用95%乙醇固定保存备用。
1.2 DNA提取、扩增和测序
根据NCBI所下载的岩原鲤D-loop序列信息, 采用Primer premier 5.0软件进行特异引物设计, 上游引物mtD-F: 5′-GGAAAACCACCCCTTATGGTA-3′; 下游引物mtD-R: 5′-TTACACGTTCTTGAG TCCTCC-3′。采用高盐法提取基因组DNA后, 分别利用上下游引物对所有样品进行PCR扩增, 反应体系50 μL, 包括: 2×PremixTaqTM(TaKaRa), 25 μL;10 μmol/L上下游引物, 各1 μL; DNA模板, 1 μL; 灭菌超纯水22 μL。PCR扩增在Bio-Rad C1000型PCR仪上进行, 反应程序: 95℃预变性3min后, 95℃变性30s, 55℃退火35s, 72℃延伸50s, 运行32个循环, 最后72℃下延伸5min。扩增后进行PCR产物双向测序(武汉奥科生物工程有限公司)。
1.3 数据分析
为确保序列的可靠性, 所有测得的DNA序列采用BioEdit[10]软件进行拼接并与测序峰图进行校对,通过BLAST (http://www.ncbi.nlm.gov/BLAST/) 检索确定为目的片段。另外, 从NCBI网站下载获得201条岩原鲤不同单倍型的D-loop部分核酸序列, 并根据相关文献[11—13]进行样本来源及序列核对。所下载序列的GenBank登录号分别为EU683674.1—EU683676.1和HQ199633.1—HQ199832.1。其中用于遗传多样性比较分析的岩原鲤野生样本来源于长江干流中的万州江段(WZ)、合江江段(HJ)、木洞江段(MD)及长江支流中的苍溪江段(CX)、唐河江段(TH)、武隆江段(WL)、通江江段(TJ)、习水河江段(XS)。另外还选取了岩原鲤北碚人工养殖群体(BB)同样用于遗传多样性比较分析。序列比对采用MAFFT软件进行, 并使用Seaview软件[14]进行人工校正。利用DnaSP v5.0软件[15]统计样品的单倍型数、单倍型多样性和核苷酸多样性。随后采用Network 5.0软件[16]构建单倍型网络图, 用以检测单倍型之间的进化关系。应用Mega 7.0软件[17]基于Kimura 2-paramter模型计算单倍型之间的遗传距离, 并利用MrModelTest软件[18]筛选核苷酸替换模型, MrBayes软件[19]进行进化树构建。
2 结果
2.1 序列特征
通过测序, 共扩增获得岩原鲤D-loop 768—769 bp的DNA序列, 序列长度差异来源于5个个体序列中的一个碱基T缺失。对其中692 bp的区域进行后续序列分析, 发现其碱基T、C、A和G的平均含量分别为35.22%、17.86%、33.83%和17.09%, 碱基G的含量明显低于其他3种碱基, 表现出典型的反G偏倚。并且A+T的平均含量为69.05%, 而G+C的平均含量为34.95%。进一步的序列分析共检测得到15个变异位点, 占总分析位点的2.17%, 其中13个变异位点为序列转换(6个A和G转换, 7个T和C转换),1个位点为A和T序列颠换, 1个位点为碱基T缺失(图1)。175条序列共定义11种单倍型, 其中Hap1为主要单倍型, 所含样本为134个, 占总样本量的76.57%。单倍型序列已上传至NCBI, GenBank登录号为MT119068—MT119078。

图1 岩原鲤不同单倍型变异位点分布Fig. 1 The positions of variable sites in different haplotypes of P.rabaudi
2.2 遗传距离分析
采用Network 5.0软件构建单倍型网络连接图,结果显示单倍型Hap10演化速率较快, 与单倍型Hap6遗传距离最远(图2A)。单倍型Hap1与Hap2遗传距离最近。进一步的系统发育树结果显示,11个单倍型共分为7支, 其中单倍型Hap7、Hap8、Hap9和Hap10聚为一支, 然后再与Hap11聚为一支(图2B)。
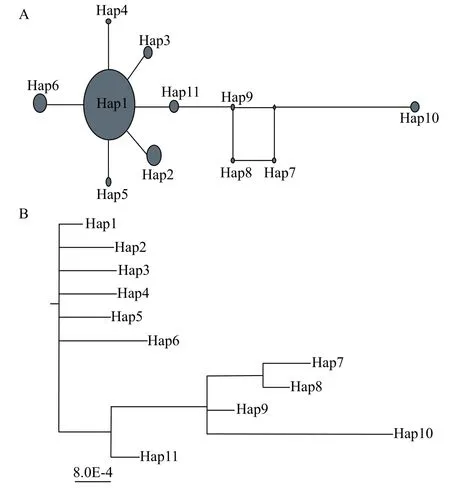
图2 基于D-loop序列构建的岩原鲤不同单倍型简约网络图(A)及系统发育树(B)Fig. 2 The statistical parsimony network (A) and phylogenetic tree (B) constructed based on the D-loop sequences of P. rabaudi
2.3 遗传多样性分析
将本研究所得175条岩原鲤D-loop部分序列与宋君[11,12]、朱成科等[13]研究中201条序列进行遗传多样性比较分析。结果显示, 所有序列分析得到的单倍型个数为49个, 单倍型个数最多及最少的群体分别为木洞江段野生群体(18个)及北碚人工养殖群体(2个; 表1)。另外, 本研究中的重庆人工养殖群体中有两个单倍型(Hap10和Hap11)为群体内独享单倍型, 其他 9个单倍型为群体间共享单倍型。遗传多样性最为丰富的为万州江段野生群体, 其核苷酸多样性及单倍型多样性分别为0.0147±0.0033和0.9590±0.0310, 其次为木洞江段野生群体。本研究中长寿和涪陵地区岩原鲤人工养殖群体核苷酸多样性分别0.0013±0.0003和0.0013±0.0004, 单倍型多样性分别为0.4100±0.0550和0.3970±0.0820。其遗传多样性低于所有野生群体, 但略高于北碚人工养殖群体(表1)。
3 讨论
3.1 岩原鲤种群遗传多样性
遗传多样性是衡量物种进化潜力的重要指标,遗传多样性越高, 表明物种对环境改变的适应能力更强, 进化潜力越大[20]。群体遗传多样性每损失10%, 即会对其繁殖能力、存活率和生长等重要生理性状产生极大的负面影响[21]。核苷酸多样性代表了每个群体内各个单倍型两两配对差异的平均值, 是一个群体的遗传多样性指标, 当核苷酸多样性指数在0.0010—0.0047时, 其群体的遗传多样性较低[22]。在本研究中, 重庆岩原鲤人工养殖群体的核苷酸多样性指数为0.0013, 显示其遗传多样性较低。而8个岩原鲤野生群体中, 有5个野生群体的遗传多样性指数大于0.0047, 显示出较为丰富的遗传多样性。另外, 重庆岩原鲤人工养殖群体的单倍型多样性指数也显著低于野生群体(表1)。根据群体单倍型多样性和核苷酸多样性之间的关系可将群体的扩张事件分为4 种类型[23]: ①低单倍型多样性和低核苷酸多样性(Hd<0.5,π<0.5%), ②高单倍型多样性和低核苷酸多样性; ③低单倍型多样性和高核苷酸多样性; ④高单倍型多样性和高核苷酸多样性。重庆岩原鲤人工养殖群体遗传多样性类型应属于第①中类型, 此种类型表明群体最近发生了瓶颈效应或由单一、少数系群发生了奠基者效应。
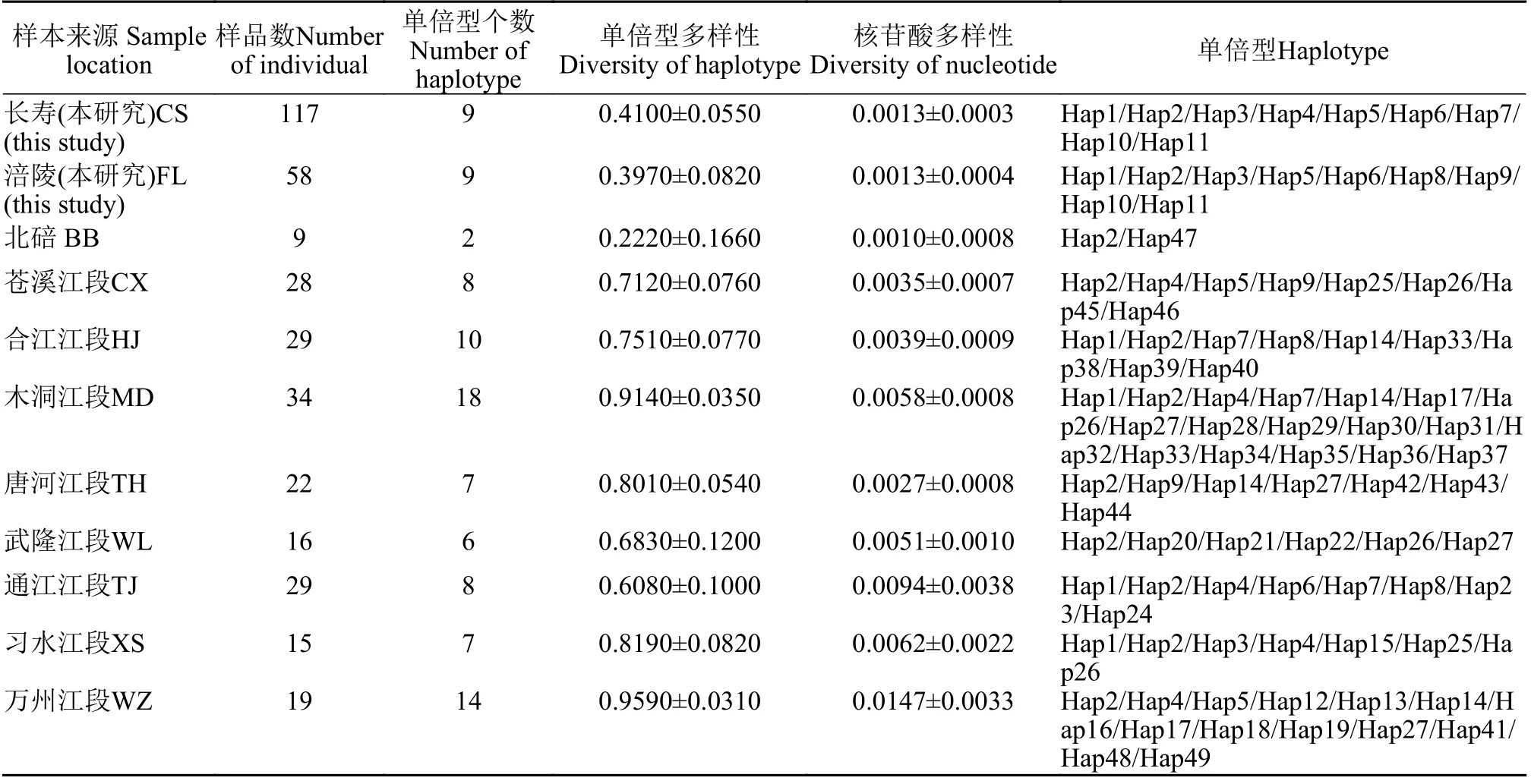
表1 基于D-loop序列的岩原鲤遗传多样性参数Tab. 1 Parameters of the genetic diversity of P. rabaudi based on the D-loop sequences
3.2 岩原鲤的遗传结构分析
岩原鲤重庆人工养殖群体D-loop序列分析显示其碱基G的含量明显低于其他三种碱基, 并且平均(A+T)含量明显高于(C+G)含量, 该结果与其他鱼类中的研究结果相符[24—27]。遗传距离的估计在分析群体间遗传关系、预测杂种优势和指导亲本选配等方面具有重要作用[28]。在本研究中, 重庆岩原鲤养殖群体单倍型Hap1所含样本数量最多, 并且与其他单倍型之间的遗传距离相对较近, 而单倍型Hap10与其他单倍型的遗传距离相对较远。在进行岩原鲤人工繁育时, 应尽量选择遗传距离较远的个体进行配对, 并定期补充不同地区不同群体的个体作为后备亲鱼, 保持其人工繁殖群体的遗传多样性,避免近亲繁殖和瓶颈效应。本研究所得到的岩原鲤种群遗传结构特征对于其人工繁育(引种、人工繁殖、杂交等)及遗传多样性的监测具有重要意义。

