阿根廷滑柔鱼年间生长及体征变化
臧 娜 连晋欣 陈新军, 林东明,
(1. 上海海洋大学海洋科学学院, 上海 201306; 2. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306; 3. 国家远洋渔业工程技术研究中心, 上海 201306; 4. 农业部大洋渔业开发重点实验室, 上海 201306; 5. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 青岛 266071)
阿根廷滑柔鱼(Illex argentinus), 隶属头足纲(Cephalopoda)、枪形目(Teuthoidea)、柔鱼科(Ommastrephidae), 滑柔鱼属(Illex), 主要分布在22°—54°S的西南大西洋大陆架和大陆坡海域, 尤以35°—52°S海域资源最为丰富[1,2]。阿根廷滑柔鱼是西南大西洋生态系统的重要指示种, 起着重要的“生物泵”作用[3]。同时, 该种类因其资源量丰富, 已经成为世界头足类渔业的重要渔业对象, 渔获量约占全球头足类总产量的10%以上[4], 也是我国远洋鱿钓渔业的主要捕捞对象之一[5,6]。然而, 阿根廷滑柔鱼生长快、寿命短[1], 终生一次繁殖, 产卵完成后不久便死去[7—9]。种群大小取决于资源补充量, 后者与个体的繁殖成效(Reproductive effort)密切相关[10]。
生物个体的体征(Body condition)是其健康状况的一个重要表征[11,12], 体征优劣直接影响着生物个体的繁殖成效并随之影响群体资源补充量[13,14]。已有研究表明, 阿根廷滑柔鱼在索饵期间个体生长和性腺发育同步进行[15,16]; 然而性腺发育成熟后个体逐渐停止摄食[17], 胴体和足腕等肌肉组织存储能量将被部分转化以供给性腺发育和配子发生成熟的能量所需[18]。因而, 阿根廷滑柔鱼索饵期间的体征状况对个体的生殖投入具有重要作用, 并在一定程度上影响个体的繁殖成效及其资源补充量。本文根据2012—2014年在西南大西洋索饵场采集的阿根廷滑柔鱼样本, 分析其体质量-胴长关系, 年间个体生长的体征变化特性, 并利用广义线性混合效应模型(Generalized linear mixed-effects models,GLMM)分析体征的月份变化效应关系, 以期认知阿根廷滑柔鱼的体征生长特性, 为可持续开发该种类资源提供科学基础。
1 材料与方法
1.1 样本采集
阿根廷滑柔鱼实验样本来源于我国远洋灯光鱿钓渔业作业船的渔获物。采样时间为2012年1—3月、2013年1—3月和2014年4—6月, 采样海域为西南大西洋公海海域(41°56′—47°09′S、57°48′—60°49′W)。采样方案为根据作业船相对流动性特点, 进行每个站点随机采集样本约60尾。样本经冷冻保存后运回实验室进行分析。
1.2 生物学测定
样本在实验室常温解冻后进行生物学测定, 测定项目包括胴长(Mantel length, ML)、体质量(Body weight, BW)和性别等。胴长测定精确至1 mm, 体质量精确至1 g。本实验共分析了1733尾阿根廷滑柔鱼样本, 其中2012年688尾, 2013年655尾, 2014年390尾。
1.3 数据处理
渔获样本组成根据采样年份和月份, 按雌性和雄性分类统计, 计算分析样本的性别比例、平均胴长和平均体质量。采用频率分布方法分析每个年份雌性和雄性样本的胴长组成, 分析优势胴长分布及其所占的比例。
体质量-胴长关系采用非线性回归方法,分别进行每个采样年份雌性和雄性样本个体的体质量与胴长的幂函数拟合, 求取体质量-胴长(BWML)之间的关系:
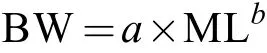
式中, BW为体质量(g); ML为胴长(mm);a、b为待估算参数。
体征指标根据体质量和胴长(BW-ML)的幂函数回归关系, 求取残差并标准化。残差值具有基于个体水平又独立于个体大小且能够反映个体质量特征的特点[19,20]: 残差值为负值时, 表示个体的质量特征不佳; 残差值为正值时, 表示个体的质量特征良好。因此, 体质量和胴长关系的残差值(BW-ML residuals)可作为个体的体征指标(Body condition index,CI)[21], 指标值为正时, 表征个体质量良好; 指标值为负时, 则表征个体体质量不佳。
利用广义线性混合效应模型(Generalized linear mixed-effects models, GLMM)拟合体征指标与胴长的关系, 模型中以采样月份作为随机效应变量及其对个体大小的效应影响。模型方程[22]如下:
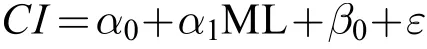
式中,CI为体征指标; ML为胴长(mm);α0为采样月份对模型截距的随机影响,α1为胴长×采样月份作用对体征指标的效应,β0为年份对模型截距的随机影响,ε为模型误差项。在模型拟合时, 胴长取自然对数Ln(ML)以降低数据极值的影响[22]。
实验数据以平均值±标准差(Mean±SD)表示,运用OriginPro 9.1和SPSS等统计分析软件, 及R统计平台进行数据的处理分析。χ2拟合优度检验(Chi-Square Goodness-of-Fit test)分别检验2012、2013和2014年及合并年份样本的雌雄比例是否等于1∶1; 单因素方差分析(ANOVA)检验分析不同年份之间、同年份不同月份之间雌性和雄性样本的体型大小差异性, 并且随后进行TukeyHSD检验分析;t检验分析雌、雄个体体质量-胴长关系b值与匀速生长b=3的差异性; 协方差分析(ANCOVA)检验雌、雄个体之间体质量-胴长关系的差异性; 非参数Kruskal-Wallis检验(K-Wtest)分析雌性和雄性个体在不同年份之间的体征指标差异以及同年度不同月份之间的体征指标差异性。广义线性混合效应模型使用程序包lme4[23]在R平台[24]中进行回归分析。数据分析的显著性水平为P<0.05。
2 结果
2.1 雌雄比例
不同年份样本的雌雄比例分析显示, 2012年份雌雄比例为1.02∶1, 符合雌雄比例1∶1的假设(χ2=0.093,P=0.76); 2013和2014年样本中均以雌性样本占优, 雌雄比例分别为1.45∶1和1.38∶1, 与雌雄比例1∶1的假设存在显著差异(2013年,χ2=22.35,P<0.05; 2014年,χ2=9.86,P<0.05; 表1)。此外, 雌雄比例的月份分析显示(表1), 2012年1—3月阿根廷滑柔鱼的雌雄比例随着月份推移呈下降趋势, 且在3月时雌雄比例最低为0.49∶1, 与雌雄比例1∶1的假设差异显著(P<0.05); 2013年1月雌雄比例最大, 为4.00∶1, 随后雌雄比例呈下降趋势, 3月时最低, 为0.61∶1; 2014年4月和5月的雌雄比例与1∶1假设没有显著差异(P>0.05), 6月时雌性样本数量占优, 雌雄比例为1.89∶1, 且与雌雄比例1∶1的假设差异显著(P<0.05)。
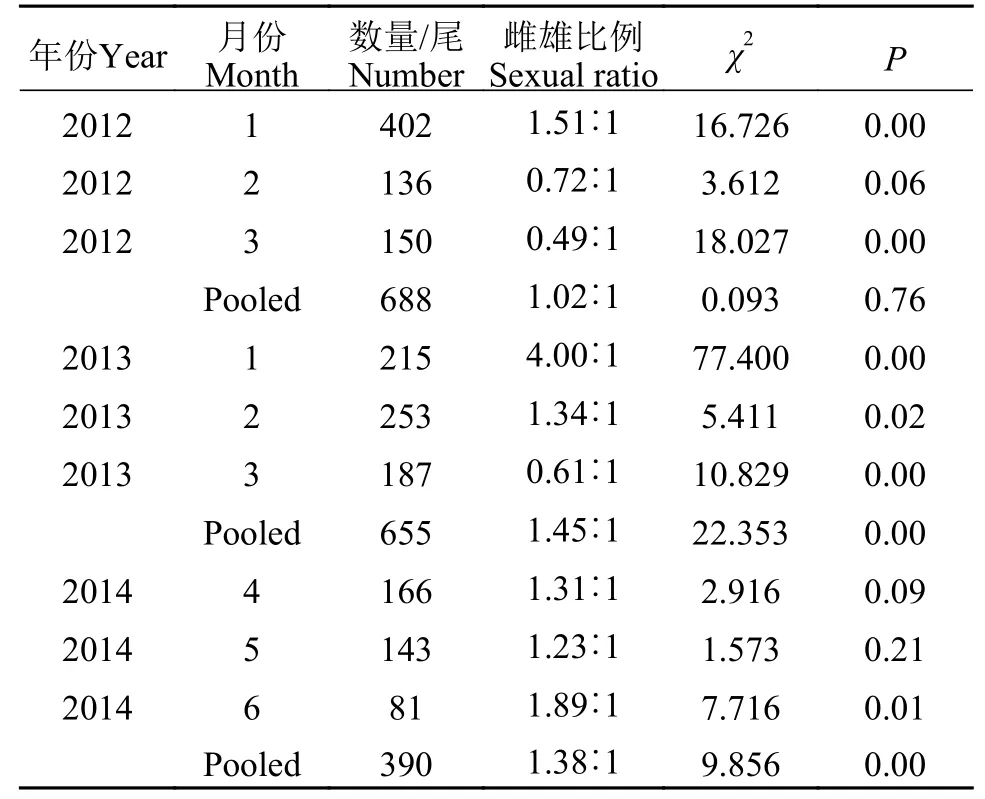
表1 阿根廷滑柔鱼样本的雌雄比例Tab. 1 The sexual ratio for the specimens of Illex argentinus
2.2 个体大小组成
分析显示, 阿根廷滑柔鱼雌性和雄性个体均以2014年样本体型最大(ANOVA, 雌性:F=509.30,P<0.05; 雄性:F=210.70,P<0.05), 平均胴长分别为(271.7±28.3)和(244.7±17.3) mm; 2012和2013年样本雌性和雄性个体的胴长则差异性不显著(Tukey HSD, 雌性,P=0.22; 雄性,P=0.43; 表2)。同时, 雌性和雄性个体的体质量亦以2014年样本为最重(ANOVA, 雌性:F=701.10,P<0.05; 雄性:F=391.60,P<0.05), 平均体质量分别为(488.5±160.9)和(390.2±93.4) g(表2)。

表2 阿根廷滑柔鱼样本的胴长和体质量Tab. 2 The mantle length and body weight of Illex argentinus specimens
此外, 每个采样年份阿根廷滑柔鱼雌性和雄性样本的胴长均随着月份推移增加显著(图1)。其中,2012年3月样本胴长最大, 雌性和雄性样本的平均胴长分别为(258.3±20.6)和(231.3±19.9) mm; 1月样本胴长最小, 雌性和雄性样本的平均胴长分别为(191.8±16.6)和(184.5±20.0) mm。2013年雌性样本亦以3月的胴长为最大, 平均胴长为(221.5±21.0) mm;雄性样本以2月的胴长最大, 平均胴长为(208.1±12.3) mm, 但与3月样本胴长没有显著性差异(TukeyHSD,P=0.19), 后者的平均胴长为(203.8±22.5) mm。2014年雌性样本以6月的最大, 平均胴长为(295.6±14.7) mm, 4月的最小, 平均胴长为(248.0±23.6) mm;雄性样本5月和6月的胴长差异不显著(TukeyHSD,P=0.81), 平均胴长分别为(252.3±14.4)和(254.4±11.2) mm。
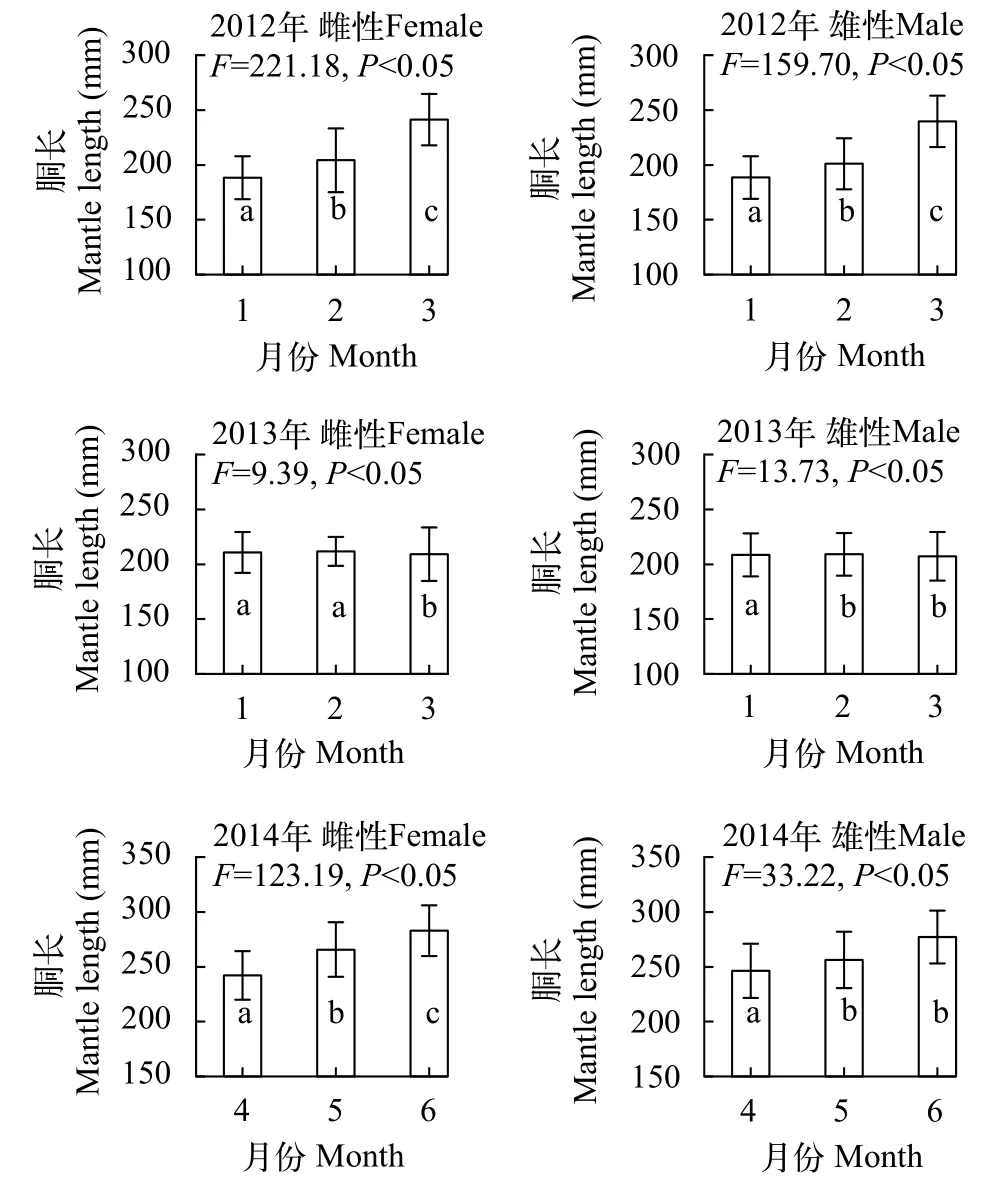
图1 阿根廷滑柔鱼雌雄性个体胴长的月份分布Fig. 1 The monthly distribution of mantle length of female and male Illex argentinus
每个采样年份阿根廷滑柔鱼雌性和雄性样本的胴长分布均为单峰值区间分布(图2)。其中,2012年, 雌性样本的优势胴长为161—220 mm, 占总数的77.30%; 雄性样本的优势胴长为161—240 mm,占总数的84.12%。2013年, 雌性样本的优势胴长为181—240 mm, 占总数的91.24%; 雄性样本的优势胴长为181—220 mm, 占总数的69.66%。2014年,雌性样本的优势胴长为221—300 mm, 占总数的83.63%; 雄性样本的优势胴长为221—260 mm, 占总数的71.95%。
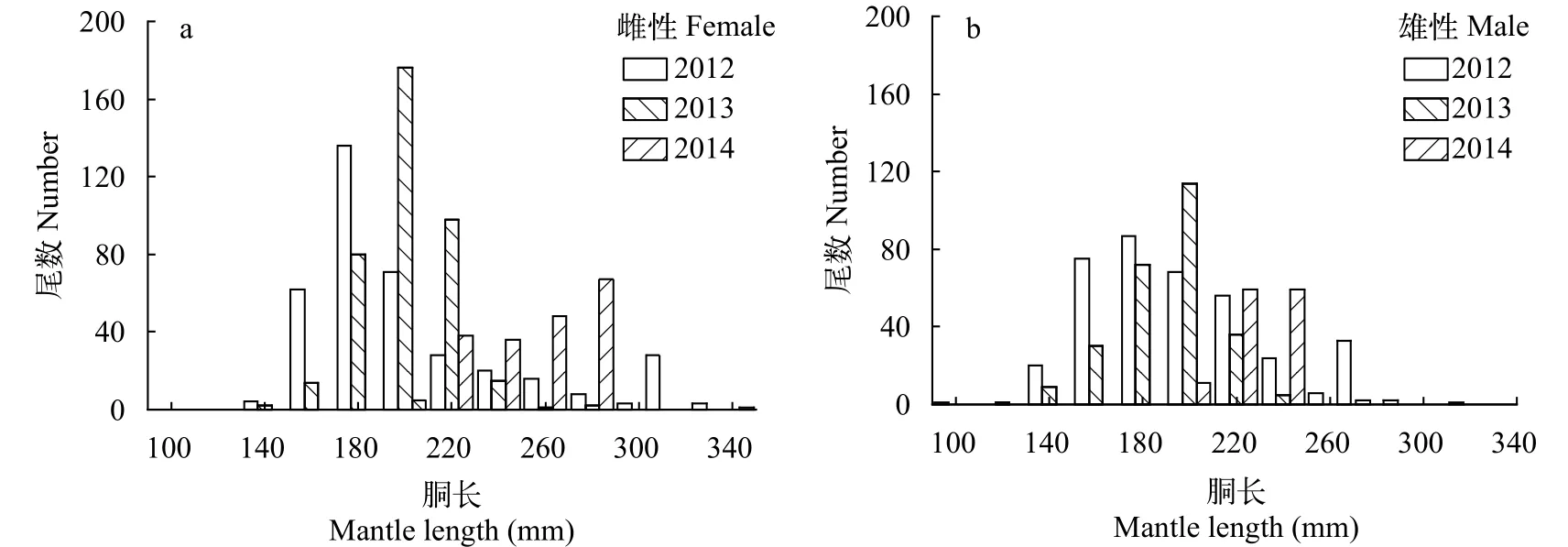
图2 阿根廷滑柔鱼雌雄个体的胴长组成分布Fig. 2 Distribution of mantle length for female and male Illex argentinus
2.3 体质量-胴长关系
2012—2014年, 阿根廷滑柔鱼雌性个体的体质量-胴长的幂函数关系式分别为BW=0.00000082×ML3.58(R2=0.95,P<0.001), BW=0.0000021×ML3.39(R2=0.74,P<0.001), BW=0.000014×ML3.09(R2=0.92,P<0.001); 雄性个体体质量-胴长的幂函数关系式分别为BW=0.000030×ML2.95(R2=0.82,P<0.001),BW=0.000047×ML2.82(R2=0.61,P<0.001),BW=0.000016×ML3.09(R2=0.82,P<0.001; 图3)。t检验显示, 2012年雌雄性个体体质量-胴长关系b值与匀速生长假设b=3之间均存在显著性差异(雌性,t=6.76,P<0.05; 雄性,t=5.67,P<0.05); 2013年雌性个体体质量-胴长关系b值与匀速生长假设b=3之间无显著差异(t=−0.25,P=0.80), 雄性个体的则存在显著性差异(t=−3.28,P<0.05); 2014年雌性个体体质量-胴长关系b值与匀速生长假设b=3之间存在显著性差异(t=4.12,P<0.05), 雄性的没有显著性差异(t=1.39,P=0.17)。同时, 协方差(ANCOVA)结果显示, 2012—2014年雌性和雄性个体的体质量-胴长关系均存在显著性差异(2012:F=128.16,P<0.05;2013:F=13.85,P<0.05; 2014:F=78.54,P<0.05)。
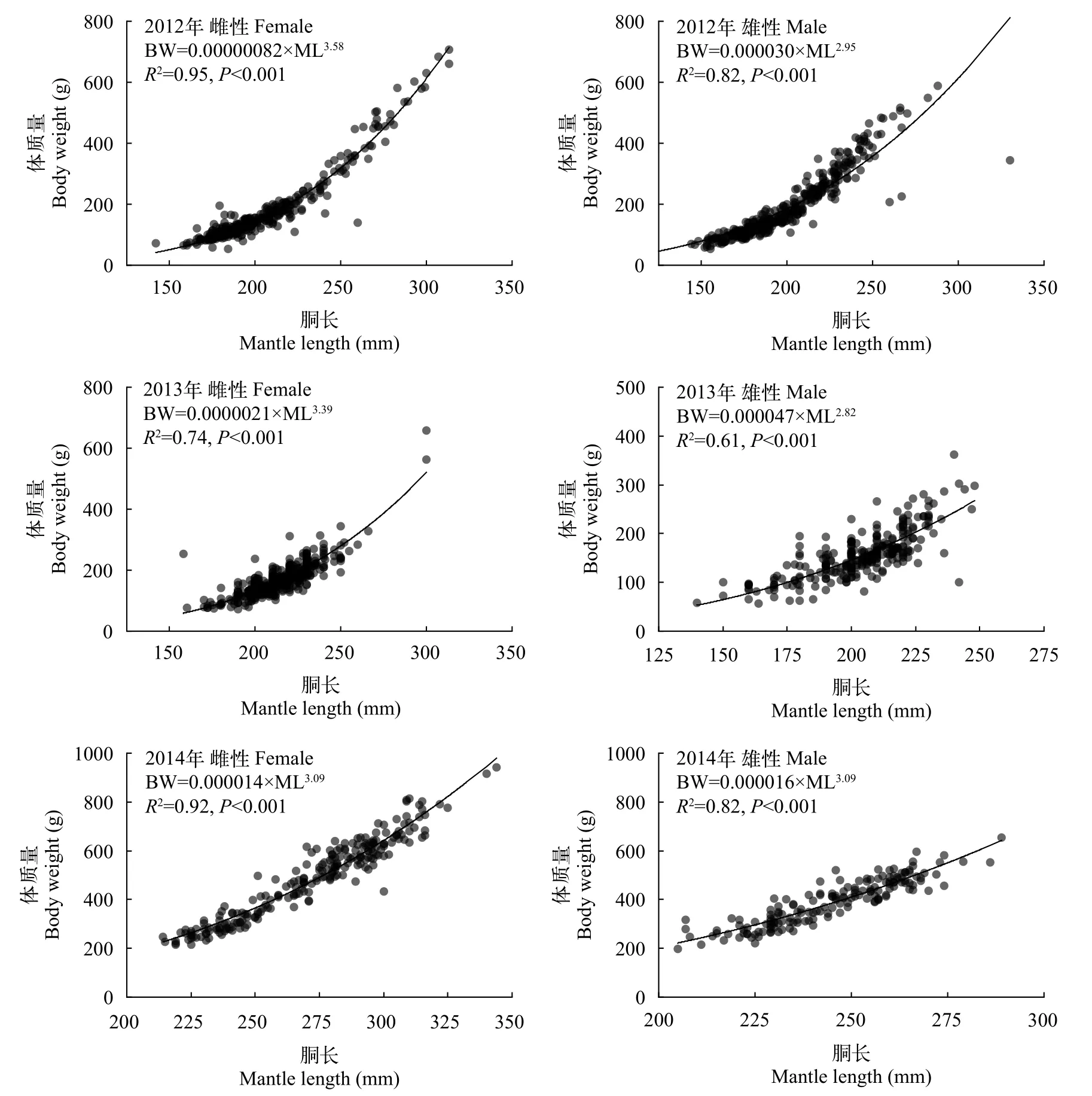
图3 阿根廷滑柔鱼雌雄个体的体质量与胴长关系Fig. 3 The relationship between body weight and mantle length in female and male Illex argentinus
2.4 体征的生长特性
在不同年份之间, 阿根廷滑柔鱼雌性和雄性个体的体征均存在显著差异(雌性:χ2=185.15,P<0.05;雄性:χ2=287.99,P<0.05), 并且两者的体征均在2013年度时最差, 在2014年度时最佳(图4)。
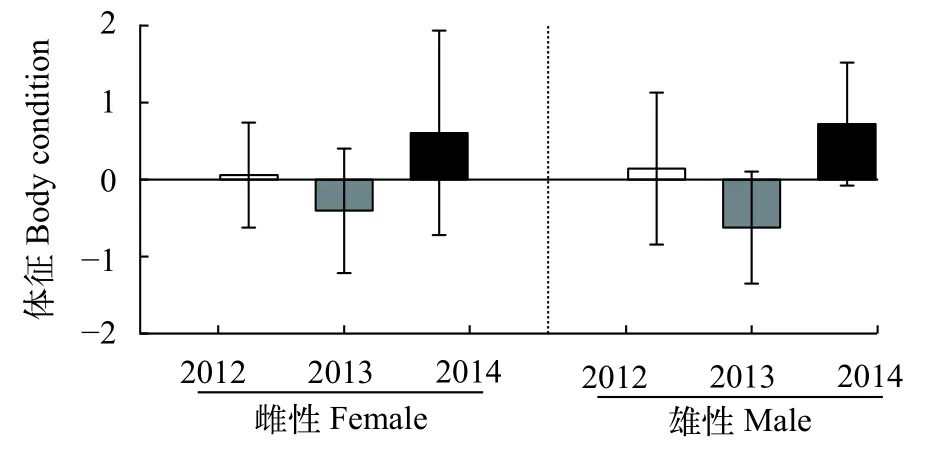
图4 阿根廷滑柔鱼雌、雄个体体征指标的年度分布Fig. 4 The yearly distribution of the body condition index in female and male Illex argentinus
同年度不同月份的体征分析显示, 2012年度雌性个体体征不存在显著的月份差异性(χ2=2.39,P=0.30), 2013年度以2月的个体体征状况最差(χ2=7.39,P=0.02), 2014年度的个体体征自4—5月呈改善趋势, 随后在6月时体征显著下降(χ2=35.79,P<0.05; 图5a)。与雌性相同, 雄性个体2012年度的体征随着月份推移显著改善, 在3月时体征状况达到最佳(χ2=51.95,P<0.05); 2013年度个体体征在2月时最差, 在3月时有所改善(χ2=56.22,P<0.05);2014年度个体体征以5月时最佳(χ2=14.22,P<0.05;图5b)。
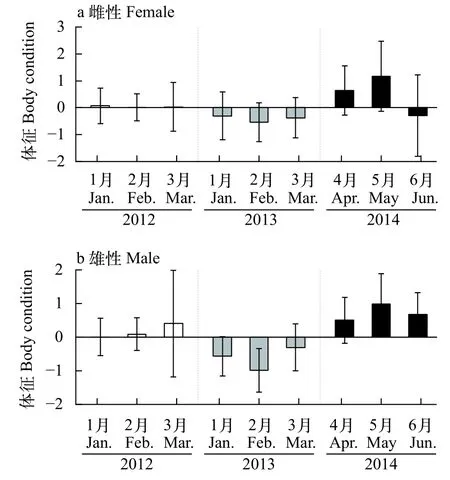
图5 每个年份阿根廷滑柔鱼雌、雄个体体征指标的月份分布Fig. 5 The monthly distribution of the body condition index in female and male Illex argentinus from different sampling years
2.5 个体体征的月份效应关系
广义线性混合效应模型(GLMM)结果显示, 阿根廷滑柔鱼雌性和雄性个体的体征指标与其胴长密切相关(雌性,t=–2.58,P=0.011; 雄性,t=–2.56,P=0.0023), 胴长×月份作用对两者的效应方差分别为33.78和2.84, 模型对雌性和雄性个体体征指标的合计方差解释率分别为91%(R2=0.91)和68%(R2=0.68)(表3和表4)。同时, 阿根廷滑柔鱼的体征与其胴长呈负相关关系, 雌性和雄性个体体征-胴长模型固定效应的斜率估计分别为–6.24和–2.56; 胴长×月份作用对不同月份雌性和雄性个体体征的影响效应具有一致性, 即个体越大, 体征较差(图6)。
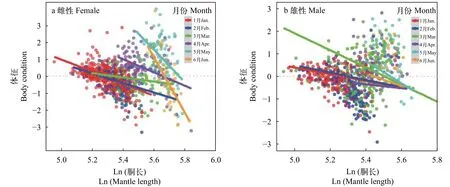
图6 胴长×月份效应对阿根廷滑柔鱼雌性(a)和雄性(b)个体体征的影响Fig. 6 The effects of mantle length×month interactions on the body condition of female (a) and male (b) Illex argentinus
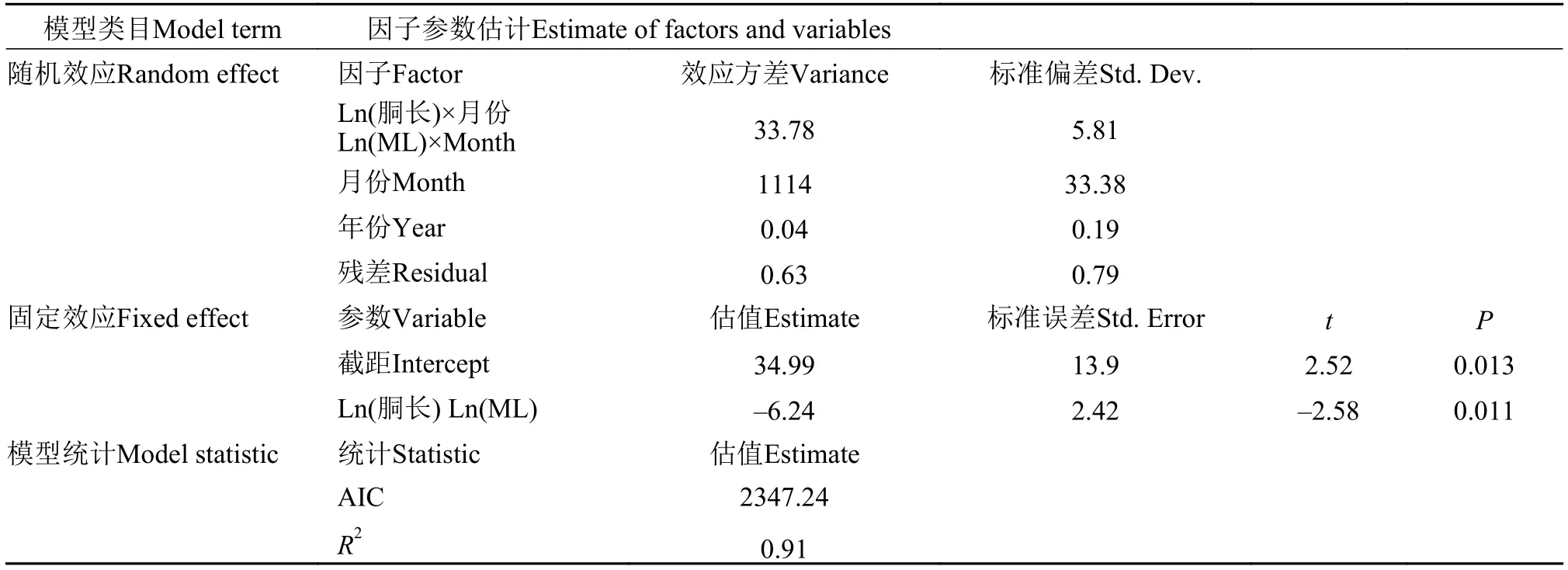
表3 阿根廷滑柔鱼雌性个体体征与胴长的广义线性混合效应模型结果Tab. 3 Results of generalized linear mixed-effects model of body condition regression on mantle length for female Illex argentinus
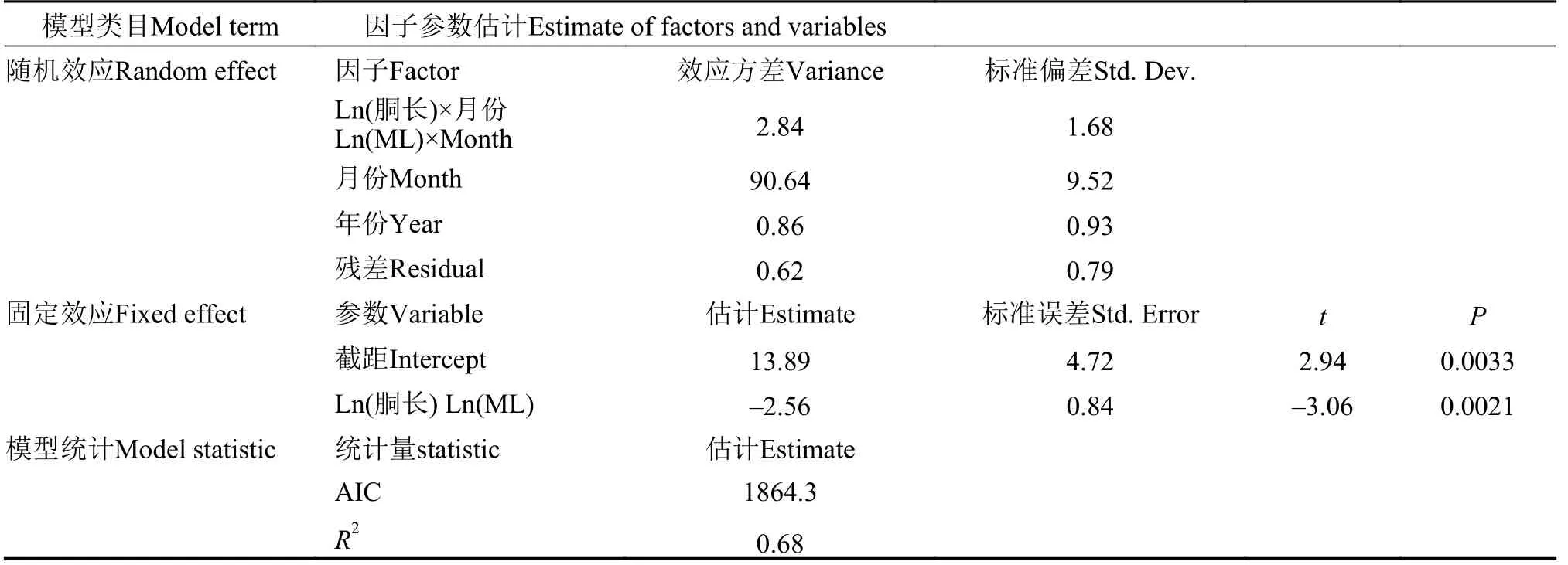
表4 阿根廷滑柔鱼雄性个体体征与胴长的广义线性混合效应模型结果Tab. 4 Results of generalized linear mixed-effects model of body condition regression on mantle length for male Illex argentinus
3 讨论
3.1 个体组成
大洋性头足类为典型的“机会主义者”, 具有生长速度快、生命周期短等生活史特点, 并且在雌雄比例上存在属种特殊性[1,2]。本研究发现, 阿根廷滑柔鱼2012—2014年样本的总体雌雄比例为1.25∶1, 并且每个采样年份的样本中亦以雌性个体数量为多, 且2013年1—3月样本和2014年4—6月样本的雌雄比例与1∶1假设存在显著性差异。结果与柔鱼科其他种类雌性个体数量占优的现象相一致[25,26],表明雌性个体数量占优可能是柔鱼科种类维持种群数量的生活史策略之一。同时研究发现, 2012年1—3月和2013年1—3月阿根廷滑柔鱼样本中雌性
个体数量均随着月份推移逐渐减少且显著, 而2014年4—6月样本中各月份均以雌性个体数量占优且在6月份时雌雄比例达到最大值(1.89∶1), 说明阿根廷滑柔鱼的雌雄比例具有时间特属性。有研究表明[1,3,17], 阿根廷滑柔鱼在其栖息海域里可见不同产卵季节的产卵群体, 且因产卵季节不同而存在向岸“短距离”洄游产卵和北向巴西外海“长距离”洄游产卵的繁殖习性。向岸“短距离”洄游产卵多发生在南半球春季和夏季, 雄性性腺先行发育并在索饵场完成与雌性个体的交配活动[1,3,17]; 北向巴西外海“长距离”洄游产卵则多发生在南半球秋冬季节, 性腺发育成熟的雄性个体先行北向洄游离开索饵场[1,3,17]。因此, 阿根廷滑柔鱼雌雄比例的时间特性可能与其不同产卵季节的产卵洄游、雄性性腺先行发育等繁殖习性相关。
通常, 阿根廷滑柔鱼可根据其成熟胴长和产卵季节划分为夏季产卵种群、南巴塔哥尼亚种群、布宜诺斯艾利斯-巴塔哥尼亚种群和南巴西种群等4个群体[27,28]。其中, 夏季产卵种群体型最小, 成熟胴长一般在140—250 mm, 为南半球夏季产卵[29];后三者的体型较大, 成熟胴长一般在180—400 mm,产卵季节分别在南半球秋季、冬季和春季[28—30]。本研究显示, 不同年份采集的阿根廷滑柔鱼样本的体型大小存在显著性差异, 以2014年5—6月采集的样本体型最大, 雌性和雄性胴长分别为214—334和205—289 mm; 2012年1—3月和2013年1—3月采集样本体型较小, 前者雌性和雄性胴长分别为142—313和144—330 mm, 后者雌性和雄性胴长分别为158—300和140—248 mm。同时, 每个年份不同月份之间的平均胴长均存在显著性差异(图1)。其中,2012年样本雌性和雄性个体的胴长均随着月份推移增加显著; 2013年样本雌性个体在3月份时胴长最大, 雄性个体在2月和3月之间体型差异不显著;2014年样本雌性个体随着月份推移显著增大, 雄性个体则在5月和6月之间增加不显著。然而, 胴长频率分布分析显示, 每个年份样本的胴长均呈单峰值区间分布(图2)。这些结果说明2012年1—3月和2013年1—3月的样本可能以夏季产卵群体为主, 并且可能存在南巴塔哥尼亚种群补充个体; 2014年4—6月的样本则可能以南巴塔哥尼亚种群为主, 布宜诺斯艾利斯-巴塔哥尼亚种群补充个体共存。然而, 具体的种群归属仍需要今后综合耳石和角质颚等硬组织微结构的年龄生长及其产卵季节推算等加以确定。
3.2 体质量和胴长生长
通常, 水生动物的体质量-胴长幂函数关系式的b值可用于表征生物个体的生长速率和身体形态发育等生长情况, 当b=3 时个体为匀速生长,b>3 时为正异速生长, 当b<3时为负异速生长[31]。本研究发现, 每个年份采集的阿根廷滑柔鱼体质量与胴长呈显著的幂函数关系, 并且雌性个体体质量-胴长幂函数关系式的b值均大于3, 为正异速生长, 即体质量增长速率高于胴长生长速率[26,32], 结果与王尧耕等[33]的结论相同。然而, 在雄性个体中2012年1—3月和2013年1—3月样本体质量-胴长幂函数关系b值均显著小于匀速生长b=3的假设, 2014年4—6月样本的体质量-胴长幂函数关系b值则与匀速生长假设b=3没有显著性差异, 说明2012年和2013年雄性个体均为负异速生长, 而2014年雄性个体为匀速生长。宣思鹏等[34]也曾报道2013年度采集的阿根廷滑柔鱼雄性个体的体质量-胴长幂函数关系式的b值<3。此外, Arkhipkin等[30]基于耳石日龄发现150—300d的阿根廷滑柔鱼雌性相对生长率要高于雄性, 与本研究中b值所示结果相似。这种体质量-胴长生长的雌雄差异性可能是在相同生命周期内雌性个体具有更快的生长速率以获得较大的成熟体型[27]所导致, 因为体型越大的个体其潜在繁殖力越大且具有较高的生殖能量投入以实现繁殖潜能最大化[1,18]。
体质量-体长幂函数关系式的a作为条件因子,常用作个体健康指数和肥满度等的参考指标[35—37], 并与生活季节和栖息环境食物丰度等密切相关[36,37—39]。本研究发现, 2012—2014年各年份的阿根廷滑柔鱼体质量-胴长幂函数关系式的a值均以雄性个体的为大, 表明雄性个体具有较好的健康指数和肥满度。这可能与阿根廷滑柔鱼雌性和雄性个体的生殖投入方式不同相关, 前者的生殖投入较大且在生长发育过程中会转化部分肌肉组织能量供给性腺发育, 后者的生殖投入较少, 性腺发育能量直接来源于发育过程中的食物能量摄入[40]。同时, 阿根廷滑柔鱼体质量-胴长幂函数关系式a值存在年份差异性, 雌性和雄性个体均以2013年份的较大, 而且雄性个体中2012年和2013年的a值均大于2014年,则可能与采样季节及其海域生产力的年间差异性密切相关。这是因为2012年和2013年的采样月份正值南半球夏季, 2014年的则为秋季和初冬季节,前者的环境适宜度较好且饵料丰度也相对较佳[41,42]。
3.3 体征生长特性
西南大西洋阿根廷外海具有丰富的上升流系统, 且受到北上福克兰寒流和南下巴西暖流的影响,营养盐和浮游生物丰富, 是天然的海洋生物索饵育肥场[41,42]。阿根廷滑柔鱼对海洋环境波动变化敏感性高, 其生长发育与海表温度、叶绿素浓度和海平面高度等环境因子关系密切[43—46]。本研究结果显示, 阿根廷滑柔鱼雌性和雄性个体的体征指标存在显著的年间差异性, 且均以2014年最佳, 2013年最差。根据美国NOAA海洋遥感观测数据(https://oceanwatch.pifsc.noaa.gov/), 2013年1—3月3个月的合计月平均海表温最高, 为12.92℃(1月12.59℃,2月13.08℃, 3月13.08℃); 次之为2012年1—3月3个月的合计月平均海表温, 为12.77℃(1月11.83℃, 2月13.64℃, 3月12.83℃); 2014年4—6月3个月的合计月平均海表温最低, 为11.75℃(4月13.07℃, 5月11.57℃, 6月10.62℃)。阿根廷滑柔鱼体征与组织能量积累密切相关, 肌肉组织是最大的能量积累器官[18], 在海表温度超过9℃时其能量积累效率呈下降趋势[47]。因此, 不同年份之间的体征差异可能是年间季节的水温变化引起的组织能量积累差异所致。此外, 海洋生物个体的体征一定地影响其资源补充量大小[13,14], 因而侯庆联等[48]发现2012—2015年间阿根廷滑柔鱼资源丰度以2014年的为最好, 也从侧面反映了该年份阿根廷滑柔鱼个体具有较佳的体征。
同时, 每个年份阿根廷滑柔鱼雌性和雄性个体(除2012年雌性个体外)的体征存在显著的月份间差异, 并且2012年雌性个体和2013年雌性和雄性个体的体征均在2月时最差, 2014年雌性和雄性个体在6月时最差。通常, 阿根廷滑柔鱼在生长发育前期处于体型快速生长期, 营养物质在肌肉组织迅速积累[49]; 生长发育后期肌肉组织的部分能量转化供给性腺发育及配子发生成熟, 致使个体生长速度下降,体征变差[50,51]。既有研究表明, 南半球1—3月为阿根廷滑柔鱼的夏季产卵季节, 产卵峰期为2月;4—6月则为秋冬季产卵群的性腺成熟和繁殖产卵期, 6月为产卵峰期[27—29]。在性腺成熟和繁殖产卵期间, 个体摄食强度下降显著[1,17], 而生殖能量需求增大[18,47,50—51]。因而, 阿根廷滑柔鱼个体体征的月份差异性可能是其生长发育过程中的能量积累变化及随后的繁殖产卵活动所致, 具体原因仍需后续深入开展组织能量积累的季节性变化分析加以佐证。
此外, 阿根廷滑柔鱼雌性和雄性个体的体征指标与其胴长密切相关, 胴长×月份作用对不同月份雌性和雄性个体体征的影响效应具有一致性, 即个体越大, 体征越差, 表明其体征随着体型增大而呈下降趋势。该结果与林东明等[18]报道的肌肉组织能量占比随着性腺发育显著下降的结论相近。一方面, 该结果可能说明了体型较大的阿根廷滑柔鱼个体具有较大的生殖投入, 从而导致有限的摄入能量对肌肉组织的投入分配有所降低。这种情况与东太平洋赤道海域茎柔鱼的体征生长情况[32]相一致。另一方面, 则可能是体型较大的个体具有较高的新陈代谢率[52], 进而导致体型较大的个体在有限能量摄入情况下转化肌肉组织能量。Segawa等[53]曾报道了玛雅蛸(Octopus maya)和福氏枪乌贼(Loligo forbesi)等的新陈代谢率随着个体体型增加而增大, 随之较大量地转化肌肉组织中的蛋白质成分。然而, 阿根廷滑柔鱼体征随着体型增大而下降的原因仍需后续的深入研究, 需要综合考虑个体的生长、新陈代谢率、生殖投入策略、摄食行为及饵料生物丰度等。
综上所述, 本研究通过分析个体组成的时间变化及体质量-胴长关系, 结合残差指标分析法和广义线性混合效应模型, 进一步了解了阿根廷滑柔鱼的生长及其体征变化特性。阿根廷滑柔鱼雌性和雄性个体均表现为异速生长; 体征的年间差异显著, 并且同一年份不同月份之间的个体体征变化亦显著; 体征与体型大小密切相关, 胴长×月份作用对不同月份个体体征的影响效应具有一致性, 体型越大体征较差。这些结果进一步丰富认知了阿根廷滑柔鱼的生长发育过程, 为深入开展该种类的生殖投入并为可持续开发利用提供了基础。同时, 本研究方法也为开展其他大洋性柔鱼类的生长发育及体征变化提供了一定的方法基础, 以深入掌握这些种类的生活史过程。

