鲈鲤早期鱼苗的耳石标记研究
杨 坤 刘小帅 李天才 向成权 赵宇航 饶 强 宋昭彬,
(1. 西华师范大学生态研究院, 南充 637002; 2. 四川大学生命科学学院四川省濒危野生动物保护生物学重点实验室,成都 610065; 3. 雅砻江流域水电开发有限公司, 成都 610051; 4. 四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065)
鲈鲤(Percocypris pingi)隶属鲤形目、鲤科、鲈鲤属, 俗称花鲤、江鲤等, 在岷江、雅砻江和金沙江下段等水系均有分布, 是产区的重要经济鱼类[1]。由于受水利水电工程修建和过度捕捞等影响, 鲈鲤的野生资源明显衰退[2], 已被列为四川省重点保护鱼类及《中国生物多样性红色名录——脊椎动物卷》濒危物种[3]。为保护和恢复野外的鲈鲤资源, 在大渡河、雅砻江及金沙江等水域陆续开展了人工增殖放流。选用合适的方法标记放流鱼类,是评价放流效果、监测人工增殖放流是否达到预期效果的重要途径之一, 但国内相关研究较为薄弱[4], 对于鲈鲤放流更是如此。因而, 迫切需要寻找合适的方法标记放流的鲈鲤。
我国鲈鲤人工增殖放流主要由分布各地的鱼类增殖放流站采用当年繁殖、当年或次年放流的方式实施, 放流鱼苗规格小(以全长4—10 cm为主),放流规模较大(万尾以上)。切鳍、T型标志、CWT金属线码标志、PIT电子标志及DNA分子标记等鱼类标记/标志方法, 由于要求鱼体规格大、损伤鱼体、价格较高或技术复杂等诸多因素, 均不适宜当前鲈鲤的人工增殖放流方式。耳石(Otolith)是真骨鱼类内耳中以碳酸钙为主要组分的矿化结构, 其结构和组成非常稳定, 在整个生活史中不会被破坏或重吸收, 对鱼类经历的某些生理和环境条件(特别是水温)变化较为敏感且具有一定的规律性, 因此可以作为一种良好的标记载体[5—7]。热标记(Thermal marking)和荧光标记(Fluorescent marking)是标记鱼类耳石的常用方法, 已经被广泛应用于大规模标记早期生长阶段的鱼类[8,9]。一些学者研究了短须裂腹鱼(Schizothorax wangchiachii)[10]、长薄鳅(Leptobotia elongata)[11]、重口裂腹鱼(Schizothorax davidi)[12]和胭脂鱼(Myxocyprinus asiaticus)[13]等鱼类耳石标记, 表现出很好的应用前景。本研究基于鲈鲤人工增殖放流的现实需求, 探讨鲈鲤早期鱼苗(仔鱼期和稚鱼期)耳石热标记和荧光标记的可行性, 并尝试将这2种标记方法结合使用, 以期为鲈鲤大规模标记、人工放流群体跟踪及放流效果评估提供参考。
1 材料与方法
1.1 鱼苗来源与管理
鲈鲤仔鱼由雅砻江锦屏·官地水电站鱼类增殖放流站人工繁育, 本研究的实验亦在该站完成。为确保日龄和规格基本一致, 仔鱼为一对雌雄亲鱼的受精卵孵化。仔鱼暂养在直径为1 m的圆柱形不透明玻璃缸中, 保持不间断微流水和增氧。每天8:00、12:00、16:00和20:00各投喂浮性微颗粒饲料1次; 每天吸取污物1次, 换水约1/3; 每2天彻底换水1次并清洗水槽; 每天8:00、14:00和20:00测量水温并记录。
1.2 耳石热标记
水温控制使用一个自制的水温控制系统控制热标记所需的水温。该系统每个标记单元由1个室内水泥鱼池、2个钢化塑料水箱(水箱a规格长100 cm×宽80 cm×高80 cm、水箱b规格长50 cm×宽40 cm×高40 cm)和2个恒温电加热棒(电气参数:控温20—34℃, 50—60 Hz, 220—240 V, 300 W)组成。加热棒分别置于2个水箱中, 设置相同的温度。鱼池高于地面约1 m, 用于沉淀水中的泥沙, 提供“低温水”。水源来自附近一条长年不断流的小溪, 溪水在鲈鲤繁殖季节(每年4—5月份)的温度7—9℃, 鱼池水温可维持在9—10℃。水箱a用于提供“高温水”, 水箱b用于盛装待标记的鱼苗。在热标记实验中, 当需要高温水时, 直接开启水箱b中的加热棒(设置温度21℃)。当需要低温水时, 先关闭水箱b中的加热棒, 然后放掉大约70%的高温水, 再缓慢(约30min)加入鱼池中的低温水。在高温水饲养期间, 使用一个100 W白炽灯提供光照; 每隔6h投喂1次标记中的鱼苗; 投喂结束1h后, 清除残饵及粪便, 并使用水箱a中的高温水换掉水箱b中约70%的水。在低温水饲养期间, 不提供光照, 不投喂。实验通过高低温交替, 模拟昼夜交替。实验期间保持不间断增氧(溶氧7—8 mg/L)。
热标记方案随机选取20日龄鲈鲤1200尾,平均分成4组, 使用上述水温控制系统实施热标记,将鱼苗在高温水和低温水中循环饲养, 高温期水温(20.8±0.3)℃, 低温期(10.8±1.2)℃, 水温波动周期方案见表1。在实验结束时, 每组随机挑选50尾鱼苗,保存在99.7%的乙醇中, 以待摘取耳石。
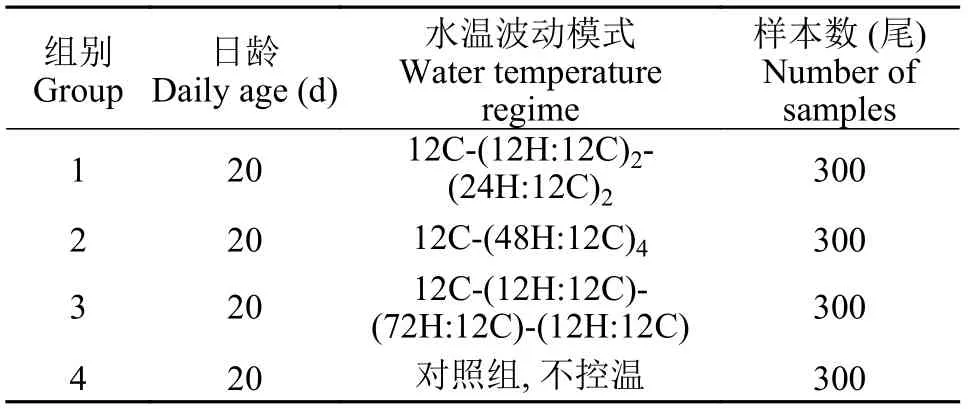
表1 鲈鲤仔鱼耳石热标记方案Tab. 1 Experimental design of otolith thermal marking for larval P. pingi
1.3 耳石荧光标记
荧光染料使用的荧光染料为茜素络合物(Alizarin complexone, AC)和茜素红(Alizarin red S,ARS), 均为分析纯粉剂, 由德国Ruibio生产, 合肥博美生物科技有限责任公司分装。根据实验方案, 用澄清48h以上的溪水配制成相应浓度的荧光染料溶液。
标记方案当完成耳石热标记后的鲈鲤仔鱼生长至35日龄时[全长(21.30±0.45) mm], 从热标记组1中随机选取80尾, 从热标记组2中随机选取100尾。暂养24h后, 使用AC溶液或ARS溶液浸泡鱼体,浸泡时间为24h。45日龄时[全长(28.56±1.03) mm],使用相同条件重复标记1次。具体标记方案见表2。在实验期间, 鱼苗饲养在21.5 cm(长)×13.5 cm(宽)×6.5 cm(高)的白色塑料水槽中, 贮水(或荧光染料溶液)1 L; 每天8:00、12:00和16:00, 各投喂1次浮性微颗粒饲料(荧光染料溶液浸泡时不投喂); 每天吸取污物1次并换水约1/3, 每2天彻底换水1次并清洗水槽; 保持不间断增氧; 水温19.5—21℃。每次荧光染料浸泡结束后, 将水槽清洗干净并换上清洁的水, 24h后统计死亡率。第二次标记结束10d后,将鱼体全部保存在99.7%的乙醇中。
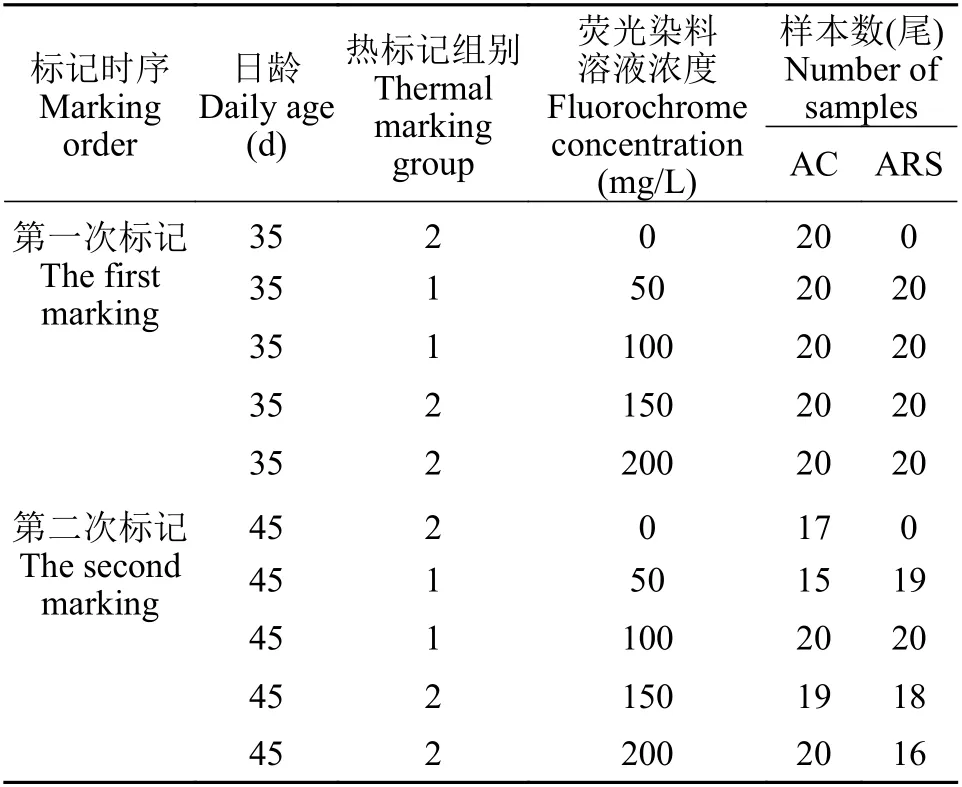
表2 鲈鲤耳石荧光标记方案Tab. 2 Experimental design of otolith fluorescent immersion marking for P. pingi
1.4 耳石的摘取与标记检测
耳石摘取在解剖镜下, 用解剖针剖开鲈鲤头骨, 取出3对耳石(微耳石、矢耳石和星耳石), 依次用清水、无水酒精清洗、晾干, 再用中性树胶封于载玻片上, 于无尘干燥处晾干, 最后贴上标签。
耳石热标记检测使用Olympus BX53显微镜和Q-Imaging Retiga 4000R组成的照相系统, 在可见光下检测耳石的热标记轮纹并拍照。采用宋昭彬[14]的方法测量微耳石轮纹宽度。
耳石荧光标记检测在Olympus BX40荧光显微镜下, 使用10×物镜, 分别在可见光和绿光(WG)两种激发光下检测耳石的荧光标记。根据Yang等[11]的方法将荧光标记质量分为6个等级:0. 荧光下不能看到标记; 1. 荧光下能看到微弱的标记;2. 荧光下能较容易地看到标记; 3. 荧光下能看到非常明显甚至耀眼的标记; 4. 荧光下能看到明显的标记, 普通可见光下也能看到标记; 5. 荧光下能看到明显的标记, 普通可见光下也能看到非常明显的标记。当标记质量 ≥ 3时, 被称之为优质标记。优质标记的荧光颜色橘红色或鲜红色, 色泽饱满光亮,能够被快速的读取到。检测分2次独立进行, 当2次结果出现不一致时, 再进行第3次检测, 以确定一个唯一的检测结果。使用显微镜连接的Q-Imaging MicroPublisher 5.0 RTV CCD拍照。
1.5 数据分析
实验数据使用Excel 2016初步整理后, 再使用SPSS 19.0对热标记轮纹宽度进行单因素方差分析(事后检验采用S-N-K), 对荧光标记质量进行多因素方差分析(事后检验采用LSD)。
2 结果
2.1 耳石热标记
鲈鲤微耳石形态规则, 轮纹最为明显, 矢耳石和星耳石轮纹则不易辨别; 在高温水饲养期间, 微耳石上沉积宽而透明的明带, 低温期间形成窄而暗的暗带; 在不同的水温波动模式之间, 微耳石轮纹增长的宽度和数量存在差异(图1)。高温期持续时间不同, 微耳石轮纹的宽度差异极显著(One-way-ANOVA: S-N-K,P<0.01; 表3), 轮纹宽度(Increment width of lapilli,IW)与高温水饲养持续时间(T)呈显著线性关系, 回归方程是IW=0.16462+0.24762T(n=450,R2=0.91865,P<0.01)。
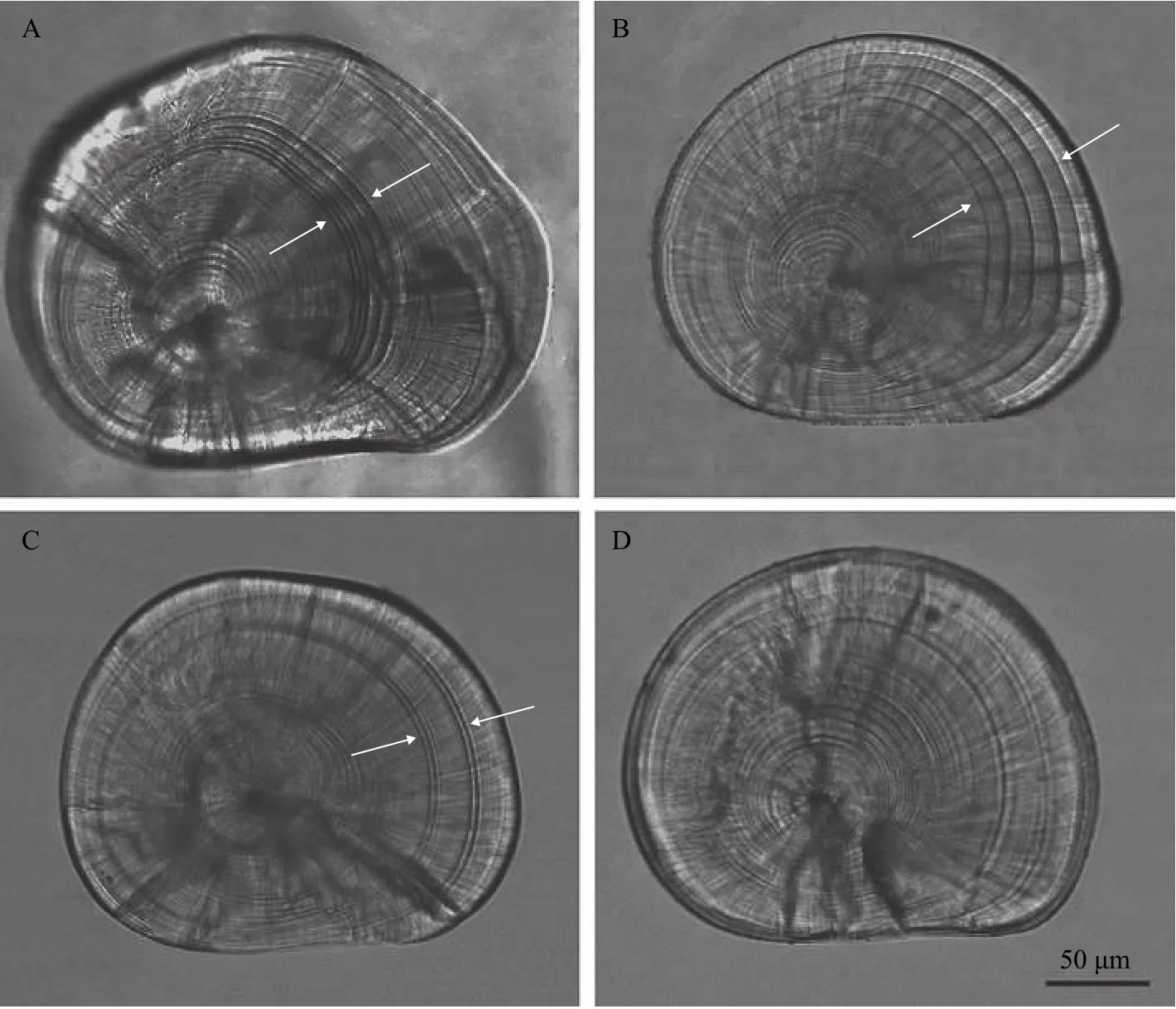
图1 鲈鲤微耳石上的热标记Fig. 1 Lapillus of P. pingi larvae, showing the thermal marks
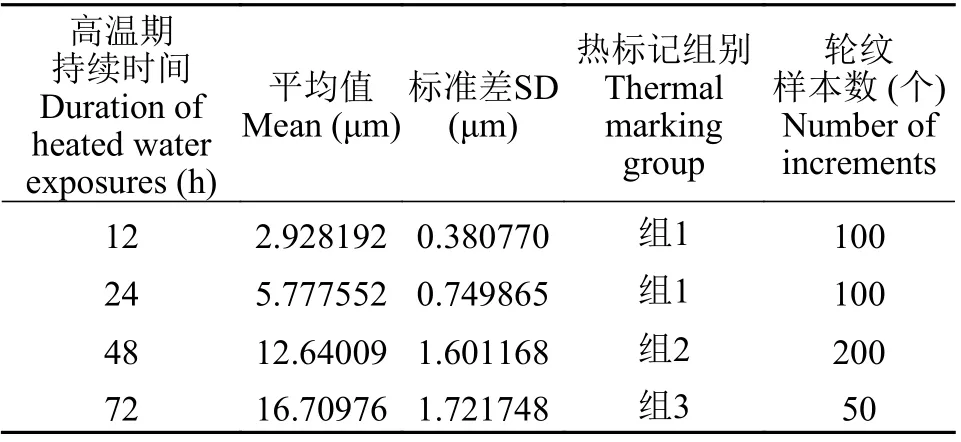
表3 鲈鲤仔鱼微耳石热标记轮的宽度Tab. 3 Increment widths of thermal marks on lapilli of P. pingi
2.2 AC荧光标记
在绿光下, AC重复标记的耳石均能观察到2个橘红色的标记环(图2); 在同样的标记条件下, 微耳石的标记质量最高, 矢耳石次之, 星耳石标记质量较低且不稳定(图3); 在可见光下, 能观察到微耳石上的热标记特征轮纹(图2)。方差分析(Three-way-ANOVA: 只考虑主效应, 事后检验LSD)显示, 标记质量受AC浓度影响显著(P<0.05), 微耳石、矢耳石和星耳石间的标记质量差异显著(P<0.05), 不过, 标记质量受鲈鲤全长的影响不显著(P=0.217; 表4)。在首次标记时, 与对照组相比, AC标记的鲈鲤死亡率极低。再次标记时, 则没有出现死亡(表5)。
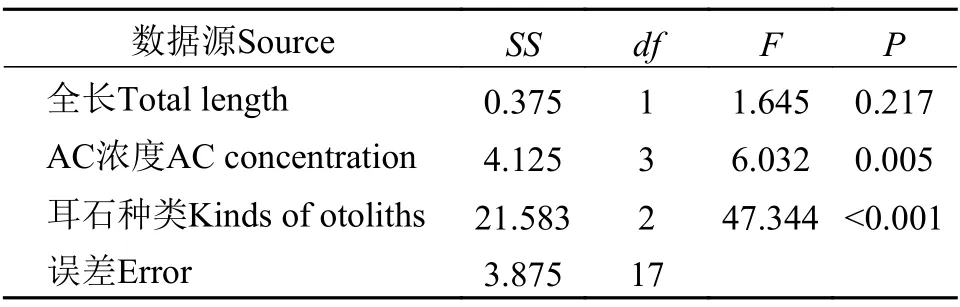
表4 AC标记鲈鲤的标记质量方差分析Tab. 4 The results of ANOVA test on mark quality of P. pingi marked by AC
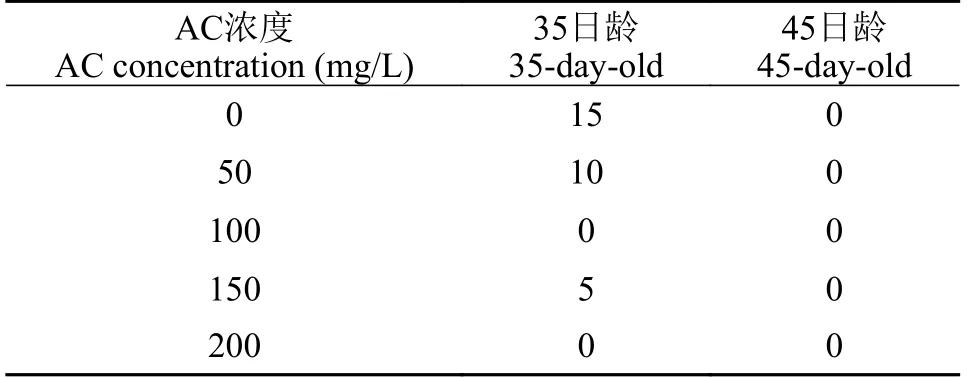
表5 AC标记鲈鲤的死亡率Tab. 5 Mortality of P. pingi marked by AC (%)
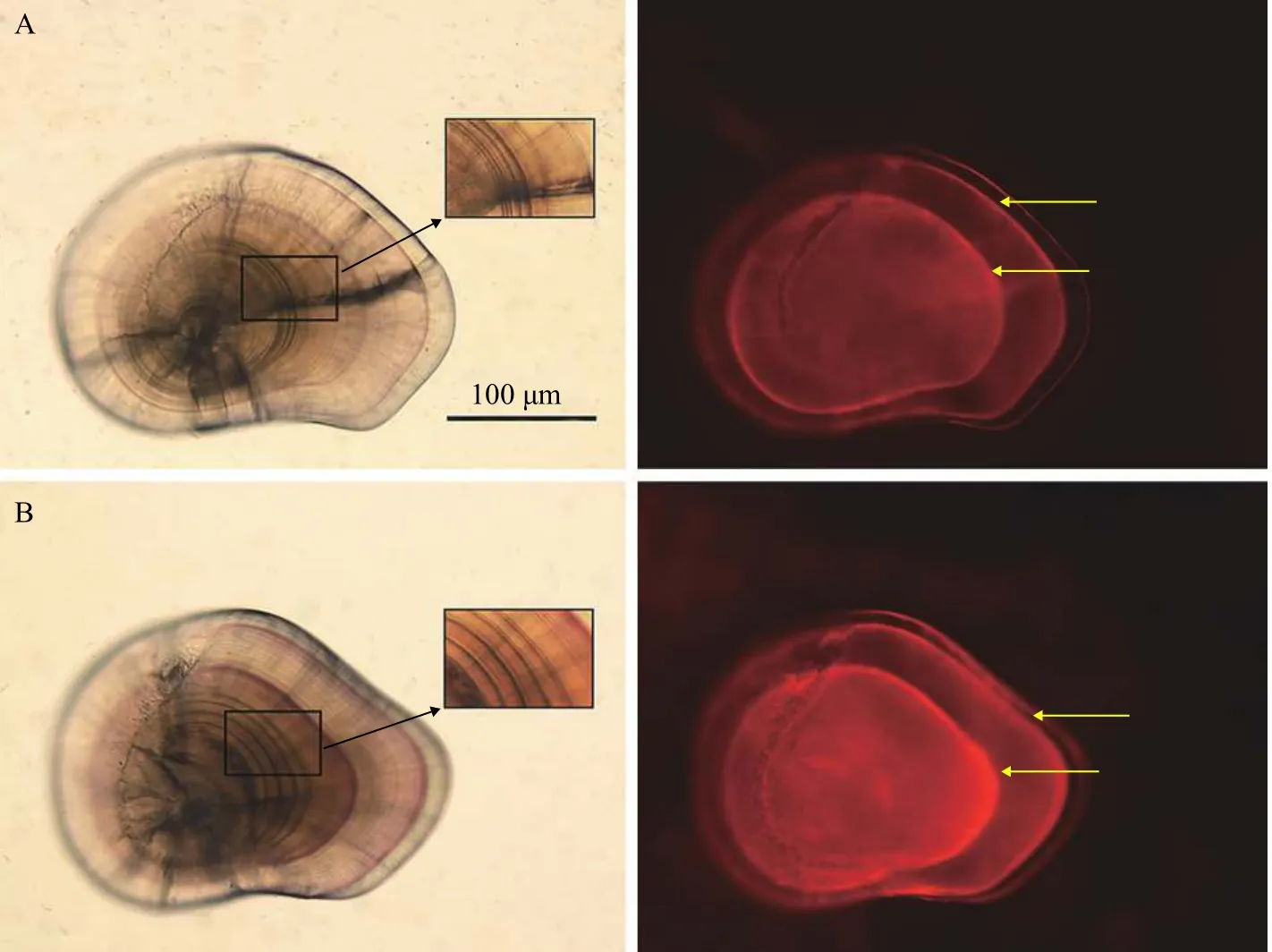
图2 AC标记的鲈鲤微耳石Fig. 2 Lapillus of P. pingi marked by AC
2.3 ARS荧光标记
在绿光下, ARS重复标记的耳石均能观察到两个橘红色标记环(图4); 在同样的标记条件下, 微耳石、矢耳石和星耳石的标记质量都很高, 均≥4(图3);在可见光下, 能观察到微耳石上的热标记特征轮纹(图4)。方差分析(Three-way-ANOVA: 只考虑主效应, 事后检验LSD)结果显示, 标记质量受全长和ARS浓度影响不显著(P>0.05), 微耳石、矢耳石和星耳石间的标记质量差异显著(P<0.05; 表6)。
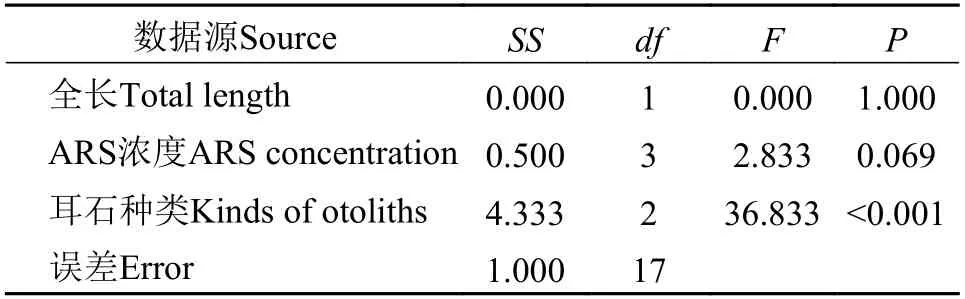
表6 ARS标记鲈鲤的标记质量方差分析Tab. 6 The results of ANOVA test on mark quality of P. pingi marked by ARS
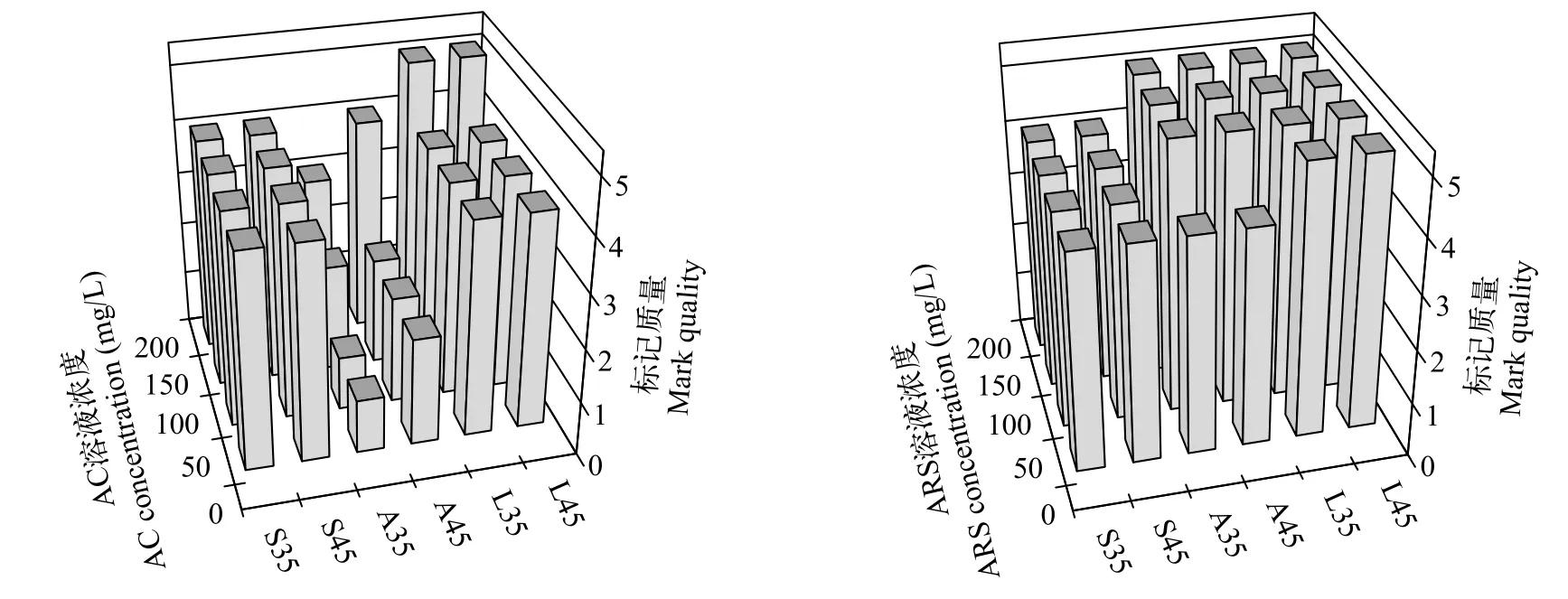
图3 AC和ARS标记鲈鲤的标记质量Fig. 3 Mark quality of P. pingi marked by AC and ARS
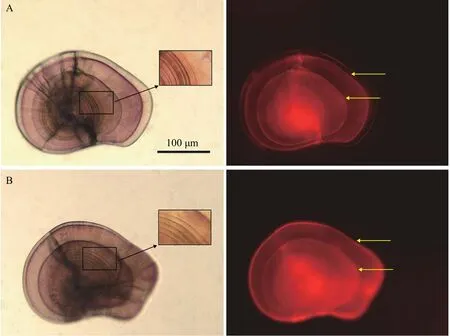
图4 ARS标记的鲈鲤微耳石Fig. 4 Photographs of lapullus of P. pingi marked by ARS
在首次标记时, 与对照组相比, ARS标记的鲈鲤死亡率极低。重复标记时, 使用200 mg/L浓度的组出现了高达75%的死亡率, 其他浓度组则没有出现死亡(表7)。
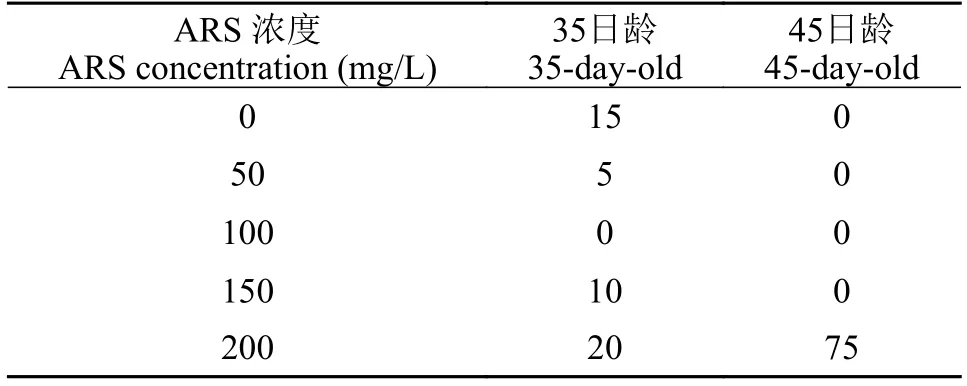
表7 ARS标记鲈鲤的死亡率Tab. 7 Motalities of P. pingi marked by ARS (%)
3 讨论
3.1 鲈鲤耳石标记的合适条件
鱼类耳石标记的安全性是人们非常关注的问题。热标记通过人为调控胚胎或仔鱼饲养水体在“高温”和“低温”之间周期性地交替来实现[15]。“高温”和“低温”不仅要在鱼类正常承受范围之内, 而且其差值及处理时间也要合适[15,16]。在一般情况下, 高低温之差不低于2℃, 处理时间4h以上, 耳石上就能形成较为明显的轮纹[15]。在自然水域中, 由于早期生活史阶段往往经历着水温昼夜剧烈变化等恶劣的水文条件, 鱼类自身应已经具备相应的抵御能力[17]。在本研究中, 标记的高低温之差达10℃,鱼苗游动、摄食等活动正常, 也没有死亡发生, 微耳石上形成的轮纹非常规律且清晰。不过, 仅仅形成清晰的轮纹还不够, 热标记轮纹还必须与自然形成的轮纹区别明显。在实际观察中发现, 高温期12h形成的轮纹, 容易与自然水温波动形成的轮纹混淆, 24h以上的高温期处理形成的轮纹更宽则不易混淆, 也更容易在显微镜下快速识别。但高温处理时间越长, 则越容易因温度异常波动形成非目的轮纹, 不利于标记识别。根据本研究的结果, 热标记鲈鲤的高温期处理时长以24—72h为宜。
人们对耳石标记技术的担忧主要源于荧光标记。研究表明, 荧光染料对鱼体有一定毒性,在浸泡过程中鱼体会出现应激反应, 造成机体损伤, 甚至死亡[18—20]。荧光染料对鱼体造成的机体损伤(尤其是死亡率), 受荧光染料的种类、浓度、浸泡时间、鱼类种类和鱼体规格等多种因素的影响, 但标记质量也同时受到这些因素的影响[9]。在一般情况下, 标记造成的死亡率和标记质量随着荧光染料溶液浓度的增加和浸泡时间的延长而上升, 随着鱼体规格的增长而降低[11]。本研究结果也基本与此相符。因而, 荧光标记在早期生长阶段标记质量最佳,但此时鱼体也最为脆弱, 需谨慎地选择标记条件,以减少鱼体损伤。
在本研究中, 用AC和ARS首次标记鲈鲤时, 均出现不同程度死亡, 意外的是对照组死亡率也很高。检查死亡鱼体发现了大量斜管虫, 寄生虫会造成鱼体抵抗力下降, 这可能是各组死亡率异常升高的真正原因。因此, 本研究认为溶液浓度不高于200 mg/L、浸泡时间不高于24h时, AC和ARS对鲈鲤早期鱼苗影响较小, 标记质量也很高。在稀有鲫(Gobiocypris rarus)[21]、胭脂鱼[13]、滇池金线鲃(Sinocyclocheilus grahami)[22]和唐鱼(Tanichthys albonubes)[23]等鱼类的标记研究中, 较为安全的标记浓度多为50—150 mg/L。霍来江[20]在研究ARS标记中华倒刺鲃幼鱼时发现, 低浓度的ARS会激活机体抗氧化防御系统, 对鱼体造成的损伤能够得到很快恢复, 浓度过高则发生抑制作用且很难恢复。在本研究中, 使用相同的条件于10d后再次标记鲈鲤时(鱼体已更为健壮), ARS溶液浓度200 mg/L的组出现了极高的死亡率。检查死亡鱼体并没有发现寄生虫或其他明显外部损伤。因此, 本研究认为,200 mg/L的ARS溶液对鲈鲤早期鱼苗造成的损伤需要较长时间恢复, 实际应用时不应高于这个浓度。由于大规模应用时, 鱼体规格和健康程度不可能完全一致, 标记条件适用性必须更为广泛。结合短须裂腹鱼等鱼类的大规模标记经验[10], 本研究推荐AC或ARS标记鲈鲤早期鱼苗的合适条件为: 溶液浓度50—100 mg/L, 浸泡时间24h。这样既可以保证标记效果, 又不会对鱼体造成明显负面影响。
3.2 ARS和AC在耳石荧光标记中的应用前景分析
在本研究中, 使用AC和ARS溶液第一次标记鲈鲤时, 各处理组死亡率都较低(ARS组略高于AC组), 但10d之后再次标记时, AC组均没有出现死亡, ARS 溶液200 mg/L这组却出现了75%的死亡率。这表明AC对鲈鲤早期鱼苗毒性比ARS低一些。Beckman和Schulz[24]标记白胭脂鱼(Catostomus commersoni)和另外2种鲤科鱼类(Campostoma anomalum和Phoxinus erythrogaster)也有着相似的结果。赵亚鹏等[22]对滇池金线鲃的研究却显示,ARS组的死亡率明显低于AC组。ARS和AC在不同鱼类中表现出的毒性差异, 可能是物种等因素造成的[9]。不过, 这2种荧光染料在合适的条件下均是相对低毒的。本研究还发现, 在相同的条件下, 3种耳石的标记质量存在较大差异, 这可能是ARS和AC两种荧光物质被鲈鲤吸收并沉积在耳石上的速率不同造成的。总体上看, ARS标记质量明显比AC高, 均为优质标记。市场上AC价格较贵, 而ARS则便宜得多, 并且ARS也更易溶解于水中。因此, 使用低浓度的ARS浸泡鲈鲤早期鱼苗是更经济和更具应用前景的标记方式[9]。
3.3 耳石热标记和荧光标记的结合应用
耳石热标记在鲑鱼增殖放流中已有二十多年的大规模应用历史, 发展出了如莫尔斯码[25]、条形码[26]和“RBr”编码[27]等多种热标记模式管理方法,实际可用的热标记模式大约有100种[28]。丰富的标记模式不仅可以满足区分不同放流时间、不同放流地点或者不同鱼类增殖站等研究需求, 也有助于系统化的鱼类标记放流管理。不过, 识别热标记时需要将耳石精确打磨成薄片。处理大小不一和形态多样的耳石不仅非常费时费力, 耳石在打磨时也很容易损坏, 而且识别热标记时还有着很高的错误率[29,30]。Volk等[15]将耳石热标记识别错误分为2个类型, 一是把没有热标记的个体识别为有标记, 二是把热标记模式错误归类, 但却未给出很好的解决办法。
荧光标记的实施操作简单, 标记识别容易, 甚至不需要打磨耳石[10,31]。但是, 荧光标记可供选择的标记模式很少, 一般只能简单地增加标记次数[8]。不过, 标记次数增加非常有限且存在毒性累积风险。一些学者曾将荧光标记用于研究鱼类耳石增长[32]和日轮确证[33]。从另一个角度看, 这实际上是将荧光标记和热标记结合了起来。在本研究中, 先后使用热标记和荧光标记2种方法标记鲈鲤早期鱼苗, 2种标记在耳石上均能清晰识别。2种标记方法共同使用, 识别标记时, 就可以先将3对耳石中的1—2颗用于检测是否存在荧光标记。当发现有荧光标记时, 再将其他耳石按热标记识别的方式处理。这样不仅有助于减少打磨耳石的工时耗费, 提高工作效率, 还有助于避免把无热标记个体识别为有标记, 同时还解决了荧光标记模式较少的问题,从而在一定程度上弥补单独使用一种标记方法的不足。

