哲罗鲑性别特异性标记筛选
佟广香 唐国盘 徐 伟 张永泉 尹家胜 匡友谊
(1. 中国水产科学研究院黑龙江水产研究所, 黑龙江省冷水性鱼类种质资源及增养殖重点开放实验室, 哈尔滨 150070;2. 河南牧业经济学院动物科技学院, 郑州 450046)
哲罗鲑Hucho taimen(Pallas)隶属鲑形目(Salmoniformes)、鲑科(Salmonidae)、哲罗鱼属(Hucho),是我国珍稀名贵冷水性鱼类之一, 肉质细嫩, 味道鲜美[1]。1998年哲罗鲑被列入中国濒危动物红皮书[2,3]。近年来哲罗鲑的资源量不断下降, 已经很难见到野生群体[4—8], 2004年被列入中国物种红色名录。
哲罗鲑是鲑科鱼类中个体最大的鱼类, 生长迅速, 抗病力强, 营养价值高, 养殖条件与虹鳟类似, 是优秀的养殖对象[5,9]。在养殖条件下, 哲罗鲑需要4—5年才能初次性成熟, 性成熟前, 无法通过外形来判断其性别; 在性成熟后, 由于生活环境不同, 婚姻色存在差异, 也很难通过婚姻色鉴定雌、雄[1,10,11]。哲罗鲑雌鱼怀卵量大, 鱼卵可用于加工鱼子酱, 因此单性养殖和性别控制育种具有较高的应用价值。怎样快速、准确并在幼鱼期鉴定哲罗鲑遗传性别, 指导养殖过程中雌、雄比例,有目的的养殖, 节约养殖成本, 成为制约哲罗鲑产业发展的重要因素之一。本研究根据虹鳟Y染色体特异性序列, 从哲罗鲑基因组草图中筛选出性别特异性标记, 并建立准确的性别鉴定方法, 为哲罗鲑的性别分化研究、性别控制育种和单性养殖等奠定基础。
1 材料与方法
1.1 样本采集及DNA提取
本研究材料来源于中国水产科学研究院黑龙江水产研究所渤海冷水性鱼试验站。繁殖时鉴定雌、雄, 采集雌、雄鱼各48尾鳍条贴在滤纸上阴干。取0.2—0.4 cm2的鳍条样本, 用100 μL裂解液[裂解液成分: 蛋白酶K 0.5 mg/mL、1 mol/L Tris(pH8.0)10 mmol/L、KCl 50 mmol/L、0.3%Tween 20、0.3% NP 40]在PCR板内裂解样本, 裂解程序为55℃ 2—4h, 98℃ 10min。样本裂解后采用Vortex仪混匀, 混匀后1000—2000 r/min离心1—2min, 取上清液作为PCR扩增模板。
1.2 序列分析及引物设计
从NCBI下载虹鳟Y染色体序列(EU081756.1),采用BLAT程序在哲罗鲑基因组草图中搜索出同源序列。用Primer 3在同源序列上设计性别特异性引物, 并在哲罗鲑线粒体12S rRNA序列上设计参照引物。参照引物用于消除非特异性扩增、样本降解及加样失误等因素的影响。引物序列及退火温度见表1。
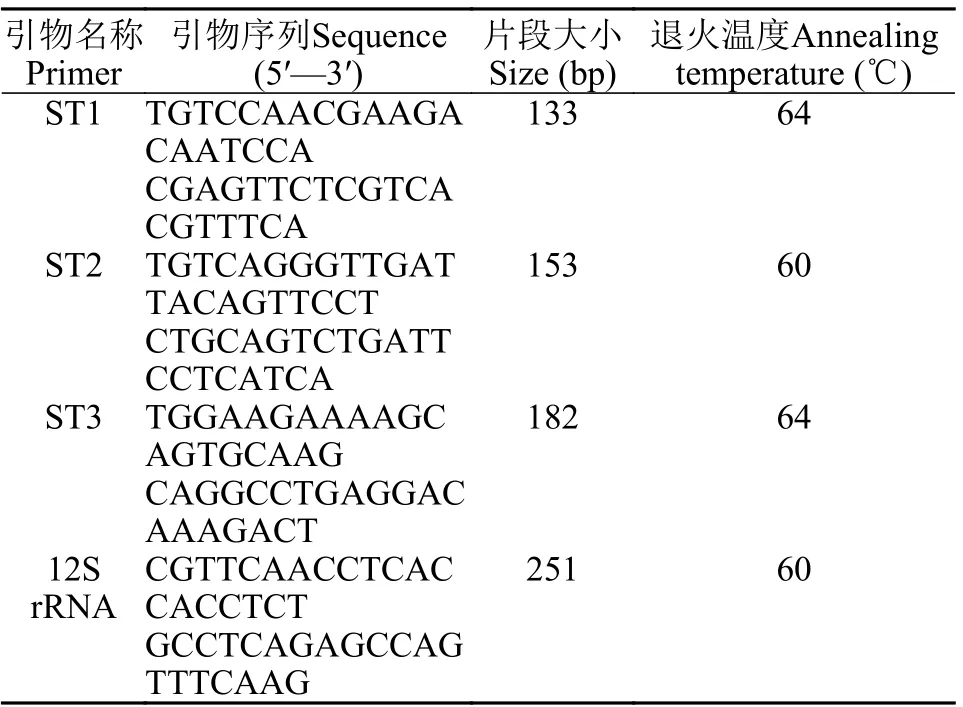
表1 引物列表Tab. 1 Primer list
1.3 PCR扩增
PCR扩增反应体系为: 2×PCR Dream Taq master mix(Thermo Fisher, USA)10 μL, 样本DNA裂解上清液2 μL, 10 μmol/L的上下游引物各0.1—1 μL,超纯水补足20 μL。PCR程序设置为95℃变性3min;30个循环, 每个循环设置为95℃ 30s, 退火(退火温度见表1)30s, 72℃ 30s; 最后72℃延伸5min。PCR产物分别用2%琼脂糖凝胶电泳和8%的非变性聚丙烯酰胺电泳检测。将特异性引物的PCR扩增产物纯化、回收, 克隆至pMD18-T载体, 处理后, 转入大肠杆菌感受态中, 筛选含有阳性插入片段的菌落进行测序。
1.4 引物浓度优化
本研究利用哲罗鲑基因组中与虹鳟Y染色体同源的序列设计性别鉴定引物, 在理想情况下, 雌性样本中无扩增条带, 而实际检测过程中样本DNA降解、加样失误、PCR扩增失败等原因也会导致无扩增条带。为消除此类问题的影响, 本研究引入了线粒体12S rRNA作为参照, 将性别特异性引物和12S rRNA引物在同一个PCR反应体系内扩增, 在参照引物有条带的前提下, 用特异性引物有无条带鉴定雌、雄。由于不同引物扩增效率存在差异, 因此需要对性别特异性引物和12S rRNA引物浓度比例进行优化。优化时设置4个浓度梯度, 在20 μL扩增体系内10 μmol/L的性别特异性引物上下游各1 μL,而10 μmol/L的12S rRNA参照引物上下游体积分别为1、0.5、0.25和0.1 μL。
2 结果
2.1 引物筛选
用雌、雄鱼各3尾样本初步筛选3对性别特异性引物和12S rRNA参照引物。由图1可知, 在性别特异性引物中, 引物ST1在雌、雄鱼样本中均能扩增出133 bp条带; 引物ST2在雌鱼样本中无扩增条带, 在雄鱼样本中能扩增出153 bp条带; 引物ST3在雌、雄鱼样本均能扩增出182 bp条带。12S rRNA参照引物在雌、雄鱼中均能扩增出251 bp条带。此结果表明, 引物ST2可能是哲罗鲑雄鱼特异性标记。
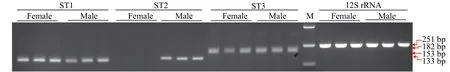
图1 4对引物PCR产物琼脂糖凝胶电泳图谱Fig. 1 Electrophoresis of PCR products using four pairs of primers
2.2 PCR引物浓度优化
为提高检测的准确率, 节约检测成本和时间,本研究采用双重PCR进行性别鉴定。由于不同引物的扩增效率存在差异, 因此需要对性别特异性引物和12S rRNA参照引物的浓度比例进行优化。在20 μL扩增体系内10 μmol/L的引物ST2固定为1 μL,而10 μmol/L的12S rRNA参照引物体积分别为1(图2A)、0.5(图2B)、0.25(图2C)和0.1 μL(图2D)。由图2可知, 引物ST2和12S rRNA的4组比例均能扩增出条带, 且随着12S rRNA引物浓度的降低, 12S rRNA扩增条带亮度呈下降趋势, 引物ST2扩增条带亮度呈现递增趋势。当引物ST2为1 μL, 12S rRNA为0.25 μL时(图2C), 二者条带亮度达到平衡, 条带均比较清晰。因此在哲罗鲑性别鉴定中引物ST2和12S rRNA引物浓度比例设置为1∶0.25。
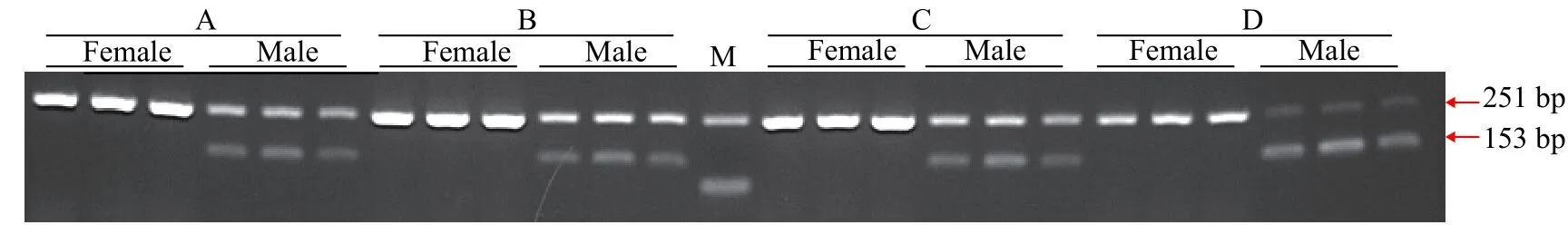
图2 引物ST2和12S rRNA双重PCR扩增琼脂糖电泳图谱Fig. 2 Electrophoresis of duplex PCR products using ST2 and 12S rRNA primers
2.3 性别特异性标记鉴定
为验证引物ST2的有效性, 进一步用雌、雄鱼各48尾样本评估引物ST2的准确性。48尾雌、雄鱼样本扩增产物琼脂糖凝胶电泳图谱见图3, 聚丙烯凝胶电泳图谱见图4。引物ST2在雌鱼中均无扩增条带, 在雄鱼中均能够扩增出153 bp的单一条带;12S rRNA参照引物在雌、雄样本中均能扩增出251 bp条带。12S rRNA参照引物能够扩增出条带表明雌鱼样本条带缺失并不是由于PCR扩增失败、加样失误和DNA降解等原因造成的, 而是由雌、雄样本间基因组DNA差异造成的。鉴于以上结果, 引物ST2可以作为哲罗鲑雄性特异性标记, 用于性别鉴定。引物ST2在检测的48尾雌、雄鱼样本中, 性别鉴定准确率可达100%。
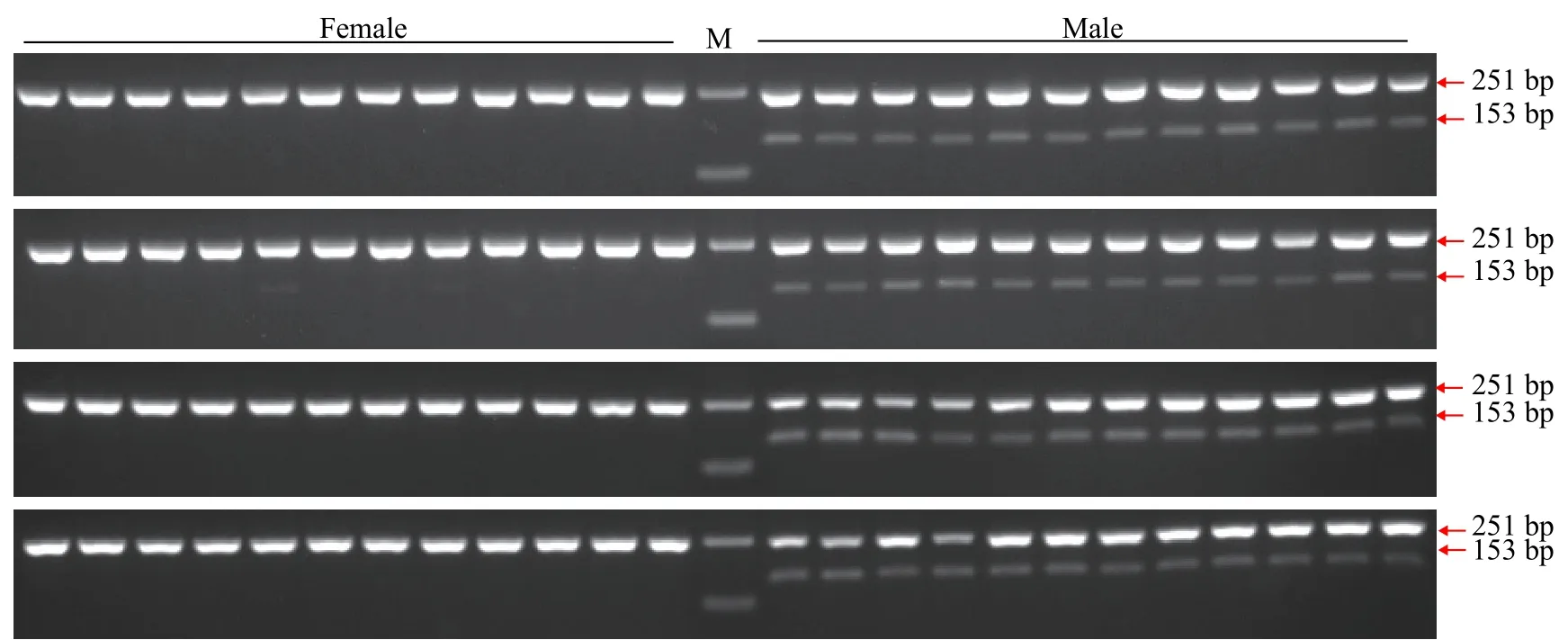
图3 引物ST2和12S rRNA1组合雌、雄样本的琼脂糖电泳图谱Fig. 3 Electrophoresis of duplex PCR products using ST2 and 12S rRNA primers in female and male samples
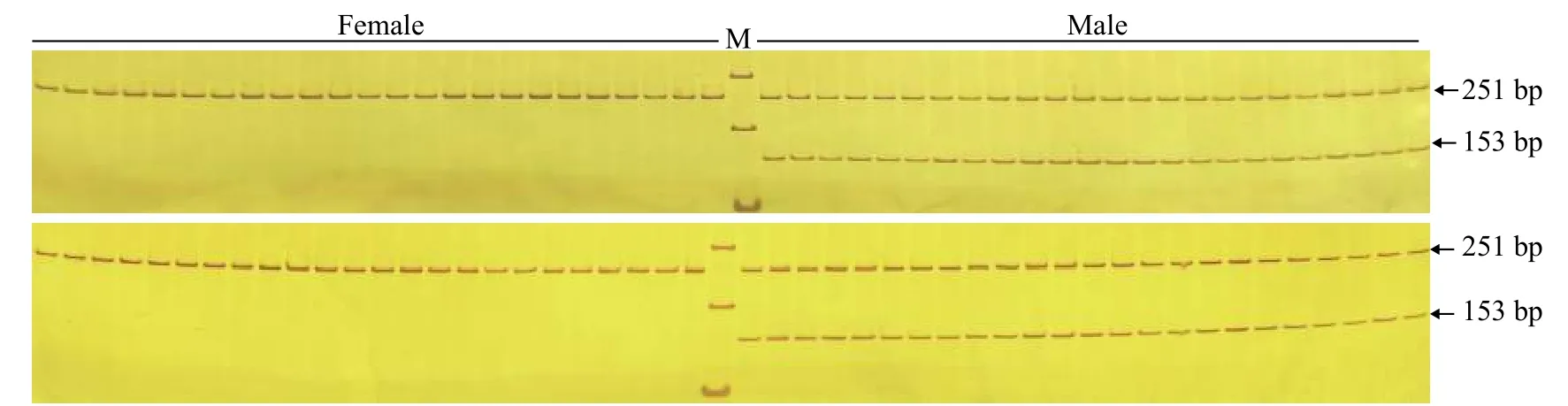
图4 引物ST2和12S rRNA1组合雌、雄样本的聚丙烯酰胺凝胶电泳图谱Fig. 4 Non-denaturing PAGE electrophoresis of duplex PCR products using ST2 and 12S rRNA primers in female and male samples
2.4 雄性特异性基因筛选
将引物ST2的PCR扩增产物纯化、回收, 克隆至pMD18-T载体, 处理后转入大肠杆菌感受态中,筛选含有阳性插入片段的菌落进行测序。测序获得153 bp序列(5′-TGTCAGGGTTGATTACAGTTCC TAAGGCATTTGCATTTTATCTCATGGTAGTGGTTG TGTCCTGCAGCCTCCCAACAGCCTTGTCGTT CTGTGGAGTTCATGTGGGATGTATATCAATCA TGGCTGGAGGTGTGATGAGGAATCAGACTG CAG-3′)。将该序列与哲罗鲑基因组(未发表)对比发现, 此序列与sdY基因位于同一Scaffold上, 并与sdY基因相邻。除此之外, 还将该序列与哲罗鲑的近源物种多瑙河哲罗鲑(Hucho hucho)基因组进行了对比, 结果显示此序列在多瑙河哲罗鲑基因组中存在2个拷贝, 分别位于QNTS01001159.1的ENSH HUG00000033926(lrp4-1)基因内和QNTS01000029.1的ENSHHUG00000034142(lrp4-2)内, 并与这2个基因7号外显子匹配90 bp。
3 讨论
鱼类是低等脊椎动物, 进化相对原始, 由于大多数鱼类的性染色体还处于未分化或者分化的早期阶段, 因此很难通过性染色体的形态来辨别雌、雄。另外, 鱼类胚胎发育过程中易受环境(特别是温度)影响, 常导致鱼类的表型性别(卵巢或精巢)和遗传性别(基因型)不一致[12—16], 因此需要一种准确、快捷的方法来鉴定鱼类的遗传性别。分子标记是一种可以在DNA水平上直接反映基因组差异的方法, 与形态学标记[17,19]、细胞学标记和生物化学标记相比[20—23], 具有准确、快捷及数量丰富等优越性。目前多种鲑科鱼类已经筛选出了性别相关的分子标记。如: Devlin等[24]筛选出大马哈鱼Y染色体上特异的DNA片段, 该片段可用来鉴定大马哈鱼遗传性别; Yano等[25]发现了一种免疫相关基因进化成为虹鳟主要性别决定基因; Felip等[26]通过扩增片段长度多态性(Amplified fragment length polymorphism, AFLP)方法, 获得了一些虹鳟性别特异分子标记。哲罗鲑也是鲑科鱼类, 但性别相关的分子标记尚未见报道。本研究成功获得了哲罗鲑雄性特异性的分子标记, 可以100%区分哲罗鲑的遗传性别, 且仅用琼脂糖凝胶电泳检测就能获得结果,方法简单, 易于操作。
在鲑科鱼类中, 基因sdY[25,27]是虹鳟、大西洋鲑和多瑙河哲罗鲑等15个不同物种的性别决定基因。本研究获得的153 bp序列与sdY基因在哲罗鲑基因组草图中位于同一Scaffold上, 与sdY基因相邻。将这153 bp序列与多瑙河哲罗鲑基因组对比,发现此序列属于lrp4基因的部分序列。lrp4基因是低密度脂蛋白受体4, 其主要功能是调节体内胆固醇平衡, 是胆固醇运输的主要载体, 也有报道表明lrp4基因在小鼠胚胎发育E13和E14时期的睾丸中显著高表达[28],lrp4是否为哲罗鲑Hucho taimen的性别决定基因, 还需要进一步实验验证。
哲罗鲑属大型鱼类, 商品鱼养殖2—3年可上市,但需要4—5年才能初次性成熟。哲罗鲑在养殖过程中雌、雄鱼生长差异不大, 但在人工繁殖过程中1尾雄鱼的精液可以配多尾雌鱼, 因此雌、雄鱼的比例为2∶1就可以满足繁殖需求, 养殖过多的雄性亲鱼造成不必要的浪费。同时哲罗鲑雌鱼怀卵量大, 可用来生产鱼籽酱, 单性别养殖具有重大意义。本研究建立的哲罗鲑遗传性别鉴定方法, 能够很好地解决生产需求, 可在养殖场简易的实验条件下, 幼鱼期采集少量鳍条进行无损伤的早期性别鉴定, 实现有计划有目的养殖, 使养殖者获得最大的效益。本方法在哲罗鲑育种方面也具有很大的应用价值, 通过此方法可实现哲罗鲑的单性养殖及性别控制育种, 为哲罗鲑的全雌或全雄育种奠定基础。

