Cd2+对三角褐指藻生长及尿苷二磷酸葡萄糖焦磷酸化酶基因表达调控的影响
吴明晗 朱葆华 张瑞豪 王路路 孙畅泽 潘克厚,
(1. 中国海洋大学海水养殖教育部重点实验室, 青岛 266003; 2. 青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室, 青岛 266237)
目前, 有关硅藻的研究受到广泛关注。一方面,硅藻作为海洋生态系统重要的初级生产者, 对物质循环和能量流动起着不可替代的作用;另一方面,大量研究证实开发利用硅藻中高附加值物质的可行性[1]。三角褐指藻(Phaeodactylum tricornutum)因其具有适应性强、繁殖周期短、光合效率高、遗传转化体系成熟和完成了全基因组测序等特性, 是实验室常用的模式硅藻, 是岩藻黄素、二十碳五烯酸(EPA)和金藻昆布多糖等生物活性物质的潜在生产者[2]。
金藻昆布多糖是三角褐指藻的主要储存性多糖, 由葡萄糖通过β-1,3糖苷键主链和少量的β-1,6糖苷键支链连接而成[3], 是天然抗氧化物的一种, 具有很强的清除自由基活性且对人体无副作用[4,5], 因其可以抑制癌细胞增殖、有明显的抗肿瘤活性和增强机体免疫力等[6,7]而逐步受到国内外研究者的广泛关注。在其合成过程中, 尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase, UGPase)是关键的限速酶, 抑制UGP基因表达会使金藻昆布多糖的合成减少, 光合作用固定的碳更多转向脂质的合成[8]。研究表明, 多种环境因素可影响UGP基因的表达。Ciereszko等[9]报道, 拟南芥(Arabidopsis thaliana)在磷限制情况下, UGP基因的表达水平显著上调, UGPase活性显著提高, 而石红萍[10]在三角褐指藻中的研究却得到了相反的结果。可见, 相同的环境因子对UGP基因表达的影响, 不同的研究者在不同物种中可能会得出不同的结论。此外, 温度、光照、盐度和Cd2+等也对UGP基因表达产生不同程度的影响[10—13]。
Cd2+作为主要金属工业污染物之一, 其浓度超过一定范围具有抑制生长发育、影响营养物质的吸收与分配、扰乱新陈代谢的毒性。但已有研究表明, 一些高等植物和微藻可以耐受一定浓度的Cd2+, 将其转化为无毒的形态, 作为Cd2+污染的指示生物。目前, 我国国家海水水质标准(GB 3097-1997)中第四类水质标准的Cd2+含量≤0.01 mg/L(约为0.09 μmol/L)。三角褐指藻对Cd2+具有很强的耐受性, 0.027 mmol/L以上浓度Cd2+会显著抑制该藻生长, 半最大效应浓度(EC50)可达0.12 mmol/L[14], 是探究Cd2+对植物生长及特定酶基因表达影响的优质材料。另外, Repetto等[11]发现, 高等植物豌豆(Pisum sativum)根经0.89 mmol/L Cd2+处理后, UGPase蛋白含量增加。Chen等[15]报道, 在Cd2+胁迫下海滨雀稗(Paspalum vaginatum)UGP基因克隆通过外源表达提高了酵母对Cd2+的耐受性。然而, 关于UGPase如何提高植物对Cd2+的耐受性及该酶基因受Cd2+调控的表达模式还知之甚少, 需要进一步研究。
综上, 本文旨在通过研究不同浓度Cd2+对三角褐指藻生长、最大光能转化效率(Fv/Fm)、实际光能转化效率(Yield)、UGP基因转录水平、UGPase活性和金藻昆布多糖含量的影响, 确定该藻UGP基因在不同浓度Cd2+处理下的表达模式, 为研究Cd2+影响植物生长及UGP基因表达和金藻昆布多糖合成提供理论依据。
1 材料与方法
1.1 藻种及培养
藻种: 三角揭指藻由中国海洋大学微藻种质库提供, 编号PT1。
以氯化铬(CdCl2)作为镉源, 不加 CdCl2作为对照组, 预实验后设置实验组浓度为0.1、0.5、1、2和5 μmol/L CdCl2。在接种时, 不同处理组藻细胞密度相同, 将初始OD750设置为0.1, 每个浓度3个平行, 在光照强度75 μmolphotons/(m2·s), 光照周期12L∶12D, 温度(20±1)℃的条件下培养, 每天摇瓶3次, 培养至指数生长期。
1.2 生长曲线绘制及生物量测定
在培养过程中, 每隔24h定时取样, 通过紫外分光光度计(Hitachi, U-3310)检测藻液在波长为750 nm处的吸光度[16](A750), 以反映生长状况并绘制生长曲线。
培养至指数生长末期时, 离心(6000×g, 5min)收集藻液, 通过真空冷冻干燥机(Christ, ALPHA 1-4LD)冷冻干燥, 称量藻粉质量, 计算生物量。
1.3 叶绿素荧光参数测定
使用Water-PAM水样叶绿索荧光仪(Germany,Walz)进行测定。取2 mL藻液进行15min暗处理,用 0.01 μmol/(m2·s) 弱测量光测得F0(基础荧光),4000 μmol/(m2·s)饱和脉冲持续 0.8s激发测得Fm(最大荧光)。光系统Ⅱ(PSⅡ)最大光能转化效率(Fv/Fm)、实际光能转化效率(Yield)等可直接读出。
1.4 UGP基因转录水平测定
收集培养至指数生长期的藻细胞, 灭菌双蒸水洗涤后, 使用OMEGA的Total RNA Kit Ⅰ试剂盒, 提取RNA, 反转录成cDNA。以编码组蛋白的H4基因(Histone H4)为内参基因[17], 使用Roche Applied Science的LightCycler 480 Real-Time PCR System进行实时荧光定量PCR, 检测UGP基因的表达情况。结果分析时以对照组UGP基因相对转录水平作为参照定为1。
1.5 UGPase活性测定
离心收集80 mL指数生长后期的藻细胞, 使用GENMEDBradford蛋白浓度定量试剂盒(Genmed Scientifics Inc., Shanghai, China)进行清洗和裂解,加入蛋白酶抑制剂, 立即用SCIENTZ超声波细胞粉碎机破碎10min, 离心收集上清, 通过多功能酶标仪(Synergy HT, Bio Tek, USA)监测波长340 nm处的吸光值, 结合蛋白质浓度标准曲线, 计算得出样品实际蛋白浓度。
UGPase活性测定使用GENMED植物尿苷二磷酸葡萄糖焦磷酸化酶活性光谱法定量检测试剂盒(Genmed Scientifics Inc., Shanghai, China)。通过多功能酶标仪(Synergy HT, Bio Tek, USA)监测37℃下0与30min时波长340 nm处的吸光度。UGPase酶活力单位定义为: 在37℃, pH=7.5条件下, 每分钟还原1 μmol NADP+所需的酶量。
1.6 金藻昆布多糖含量测定
金藻昆布多糖的萃取[18]: 准确称取5 mg冻干藻粉, 加入5 mL 0.05 mol/L H2SO4, 涡旋混匀, 60℃水浴60min, 离心后收集上清, 藻渣经蒸馏水洗涤2次,上清合并定容于25 mL容量瓶中, 即为萃取液。
苯酚-硫酸法测定金藻昆布多糖含量[2]: 吸取1 mL萃取液, 加入1 mL 6%的液化苯酚和5 mL浓H2SO4,快速涡旋混匀, 室温下静置30min, 检测490 nm处的吸光度。结合葡萄糖标准曲线, 计算出每毫克冻干藻粉中金藻昆布多糖的含量。
1.7 数据处理及分析
本实验采用Excel 2016和Origin 8.5软件进行图表绘制和数据分析, 以P<0.05作为差异显著性水平(以*表示P<0.05, **表示P<0.01)。
2 结果
2.1 生长情况分析
如图1所示, 在6种不同浓度Cd2+的培养基中,藻细胞密度均逐渐增加。0.1 μmol/L Cd2+组在培养结束时的细胞密度最大, 显著高于对照组, 0.5 μmol/L Cd2+组与对照组无显著差别, 1、2和5 μmol/L Cd2+处理组明显低于对照组, 说明低浓度Cd2+促进藻细胞生长, 较高浓度Cd2+则抑制细胞生长, 但未出现明显白化死亡的现象。

图1 三角褐指藻生长曲线Fig. 1 Growth curves of P. tricornutum
2.2 叶绿素荧光参数分析
叶绿素荧光参数可以灵敏地反映微藻的生理状态。不同浓度Cd2+处理后三角褐指藻的最大光能转化效率(Fv/Fm)和PSⅡ的实际光能转化效率(Yield)如图2所示。在培养周期内, 与对照组相比,0.1 μmol/L Cd2+组光系统Ⅱ的Fv/Fm和Yield明显升高(P<0.05)。随着Cd2+浓度增加, 藻细胞的光合作用能力逐渐降低, 0.5和1 μmol/L Cd2+的Fv/Fm和Yield与对照组差别不显著(P>0.05), 较高浓度(2和5 μmol/L) Cd2+组的Fv/Fm和Yield显著降低(P<0.05)。这与藻细胞的生长趋势是一致的, 表明低浓度Cd2+促进了藻细胞光合作用, 较高浓度Cd2+抑制藻细胞的光合作用能力。
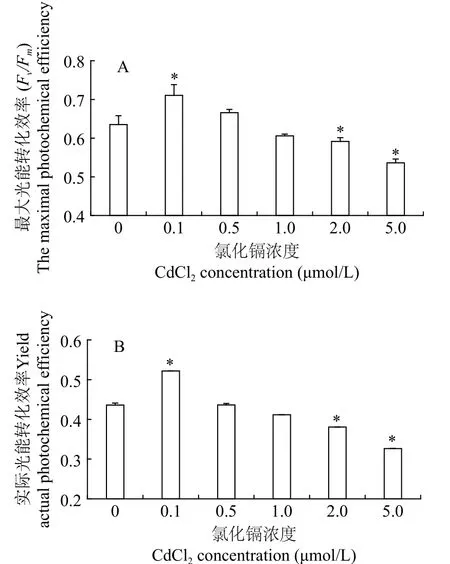
图2 三角褐指藻的叶绿素荧光参数Fig. 2 Chlorophyll fluorescence parameters of P. tricornutum
2.3 UGP基因转录水平、UGPase活性和金藻昆布多糖含量分析
如图3所示, UGP基因相对表达量、UGPase酶活及金藻昆布多糖合成量表现出相同的变化趋势。作为影响UGP基因表达的环境因子, 低浓度Cd2+(0.1 μmol/L)上调UGP基因的转录水平, 提高UGPase酶活, 促进金藻昆布多糖合成, 与对照组相比, 分别提高了100.65%、11.99%和9.77%, 显著高于其他处理组, 这说明UGPase的活性与UGP基因的转录水平和金藻昆布多糖的合成呈正相关, 与之前的研究结果一致[19]。随着Cd2+浓度逐渐升高, 这3项指标均逐渐降低, 在本研究Cd2+浓度的范围内,Cd2+浓度越大, 3项指标降低的幅度越大, 0.5 μmol/L Cd2+组与对照组无显著差异(P>0.05), 2和5 μmol/L Cd2+组较对照组极显著(P<0.01)降低, UGP基因转录水平, UGPase活性和金藻昆布多糖含量分别比对照组降低了50.31%和60.47%, 56.27%和66.72%,42.41%和47.30%, 进一步表明UGPase的活性与UGP基因的转录水平和金藻昆布多糖的合成之间具有显著的相关性。
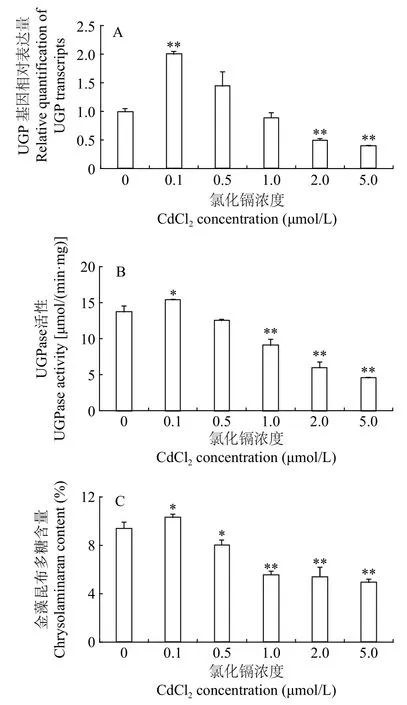
图3 不同浓度CdCl2对三角褐指藻UGP基因相对表达量、UGPase活性和金藻昆布多糖含量的影响Fig. 3 Effects of different CdCl2 concentrations on relative quantification of UGP transcripts, UGPase activity and chrysolaminaran content of P. tricornutum
3 讨论
3.1 Cd2+对三角褐指藻生长的影响
藻细胞生长是检验Cd2+毒性作用的良好指示。藻类对Cd2+有一定的耐受性, 不同藻类对Cd2+的耐受性不同。葸玉琴等[20]发现, Cd2+的浓度低于30 μmol/L会促进普通小球藻(Chlorella vulgari)生长, 随着浓度增加则对小球藻的生长产生抑制作用。贺新宇等[21]也报道, 在培养基中添加1.78 μmol/L的Cd2+培养拟柱孢藻(Cylindrospermopsis raciborskii), 比生长速率显著高于对照组。在本研究中, 低浓度Cd2+(0.1 μmol/L)促进藻细胞生长,较高浓度Cd2+(1、2和5 μmol/L)则抑制藻细胞生长,与之前的研究结论0.027 mmol/L或更高浓度Cd2+会显著抑制三角褐指藻的生长[14]有很大差别, 这可能与不同藻株、不同实验条件和处理时间等有很大关系。
Cd2+通常被认为不具有特定的生物学功能。但在硅藻中, Cd2+作为镉碳酸酐酶(CDCA)催化的金属原子, 在Zn2+消耗的海洋中, 在建立Cd2+和碳的全球循环中发挥了关键作用[22]。同时Zn2+是磷酸酶的重要组分, Cd2+部分替代Zn2+在磷的代谢中也发挥重要作用。Lane等[23]报道, 海洋硅藻威氏海链藻(Thalassiosira weissflogii)在Zn2+限制, 特别是低浓度CO2条件下, 可以表达Cd2+特异性碳酸酐酶, 在碳浓缩机制中发挥重要作用, 从而促进藻细胞生长。另外, 在Cd2+的刺激下, 藻细胞会诱导表达与重金属结合更有效的、由多个亚基构成的长链金属硫蛋白(Metallothioneins), 结合Cd2+形成无毒的金属络合物, 结合的Cd2+越多, 细胞对Cd2+的耐受性越强[14]。在杜氏藻(Dunaliella tertiolecta)中也有类似报道,该藻在Zn2+和Cd2+的诱导下, 均可以合成植物螯合肽, 从而降低重金属对藻细胞的毒性[24]。
在本研究中, 较高浓度Cd2+抑制三角褐指藻的生长, 可能是由于Cd2+浓度超过了藻细胞产生的金属硫蛋白的结合能力, 细胞中存在游离状态的Cd2+,致使细胞膜脂过氧化和膜电位去极化, 容易破坏细胞质膜的完整性, 甚至损伤细胞结构, 进而干扰代谢过程和生长[25]。另外, UGPase是植物生长过程中的重要限速酶, UGPase活性降低也会抑制生长。Woo等[26]的研究表明, 水稻中的UGPase基因通过RNA干扰抑制基因表达, 导致花粉不育, 结实率降低。同样的, Park等[27]报道, 拟南芥UGPase基因的T-DNA插入突变体会使生长受阻。较高浓度Cd2+使UGP基因表达下调从而影响藻细胞生长。
3.2 Cd2+对三角褐指藻叶绿素荧光参数的影响
叶绿素荧光参数是研究植物光合作用能力的良好探针, 反映植物所受胁迫程度和生理状态, 是检测快速灵敏、对生物体无损伤的新型活体诊断技术[28,29]。通过分析各项叶绿素荧光参数, 可以清晰地反映植物受到环境胁迫时光合作用能力的变化。在本研究中, 低浓度Cd2+(0.1 μmol/L)处理的三角褐指藻光合作用能力增强, 光系统Ⅱ最大光能转化效率(Fv/Fm)和实际光能转化效率(Yield)较对照组均显著升高(图2)。叶绿素a是植物光合作用的主要色素, 可能是Cd2+刺激了叶绿素a的合成, 导致光合作用能力随之增强。向蓓等[30]报道, 0.1 mmol/L的Cd2+刺激盐藻(Dunaliella salina)叶绿素a含量显著升高, 但具体的机制需要进一步研究。
在本研究中, 较高浓度Cd2+(2和5 μmol/L)抑制藻细胞的光合作用能力,Fv/Fm和Yield均显著低于对照组(图2)。Stobart等[31]的研究, 金属Cd2+抑制叶绿素酸酯还原酶活性, 减少氨基-γ-戊酮酸的合成,这两种物质分别是叶绿素合成所必需的酶和前体,从而削弱细胞的光合作用能力。罗丽娟等[32]也报道, 烟草叶片在Cd2+胁迫下光系统Ⅱ供体侧和受体侧遭到破坏, 光合电子传递受阻, 高浓度Cd2+可能破坏叶绿体的完整结构, 导致类囊体膜解体, 细胞内叶绿素流失[33,34]。在本研究Cd2+浓度下, 藻细胞结构完整, 未出现明显白化死亡的现象, 说明该藻对Cd2+具有较强的耐受性。
3.3 Cd2+对三角褐指藻UGP基因转录水平、UGPase活性和金藻昆布多糖含量的影响
如图3所示, 低浓度Cd2+(0.1 μmol/L)上调UGP基因转录水平, 提高UGPase酶活, 促进金藻昆布多糖合成, 据我们所知, 这是有关Cd2+调控三角褐指藻UGP基因表达的首次报道。
金藻昆布多糖是硅藻的储存性多糖, 作为一类水溶性多糖, 可以调节细胞渗透压, 稳定细胞结构,提高细胞对逆境的抵抗能力[35]。葸玉琴等[20]报道,普通小球藻在Cd2+浓度为5—30 μmol/L时, 藻细胞多糖含量随Cd2+浓度升高逐渐增加。高敏等[36]报道, 菌藻共生系统在含17.79 μmol/L Cd2+的污水刺激下, 藻类分泌多聚糖的含量显著增加, 多聚糖的羟基官能团直接结合水中的Cd2+达到明显的去除效果。另外, Chen等[15]对盐生植物海滨雀稗(Paspalum vaginatum)的研究表明, UGP编码基因是一种Cd2+耐受基因, UGPase参与的糖代谢可以提高植物对Cd2+的耐受性。因此, 当受到低浓度Cd2+刺激时, 三角褐指藻中的UGP基因表达被上调, 调节参与的糖代谢, 增加作为渗透性保护物质的金藻昆布多糖含量, 以提高藻细胞对逆境的抵抗能力。
此外, Rivera-Becerril等[37]发现, Cd2+会减少豌豆对磷的吸收, 导致磷缺乏, 从而上调UGP基因的表达水平, 增加UGPase含量[11]。但是, 蒋丽[38]的研究却得出了相反的结论, Cd2+降低一种海洋细菌(Pseudoalteromonassp. SCSE709-6)对磷的吸收, 导致肌醇磷酸代谢和磷酸戊糖途径多种酶基因下调表达。而在本研究中, 较高浓度Cd2+(2、5 μmol/L)导致UGP基因转录水平较对照组显著下降, UGPase酶活降低, 金藻昆布多糖含量减少。我们之前的研究表明, 磷对三角褐指藻UGP基因的表达起正调控作用[10], 由此推测, 该藻中可能也存在类似的磷镉相互作用机制, 较高浓度Cd2+诱导产生磷缺乏, 进而下调UGP基因表达, 但具体的分子机制还需要进一步研究。
4 结论
综上所述, 低浓度Cd2+促进三角褐指藻生长,增强藻细胞的光合作用能力, 上调UGP基因转录水平, 提高UGPase活性和金藻昆布多糖含量。本文首次探讨了Cd2+对三角褐指藻UGP基因表达调控和金藻昆布多糖合成的影响, 为研究Cd2+调控UGP基因的表达及金藻昆布多糖的合成提供理论依据,但Cd2+调控UGP基因的具体分子机制及Cd2+是否作为活性因子参与了金藻昆布多糖的代谢调控还需要进一步研究。

