电针联合重复经颅磁刺激对D-半乳糖诱导的阿尔茨海默病样模型大鼠学习记忆能力及神经炎症的影响
陈虹茹 何川 黄重生 王颖 孔立红
1湖北中药大学针灸骨伤学院(武汉430061);2武汉市中心医院(武汉430015)
随着老龄化的逐年剧增,老年性痴呆患者数量大幅度上升,严重影响个人及其家人的心理健康及生活质量,并增加患者家庭和社会经济负担[1]。阿尔兹海默病(Alzheimer′s disease,AD)又称作老年性痴呆,是一种脑组织慢性退行性损伤引起的神经性疾病,以认知和生活行为功能障碍为突出表现[2]。
大量研究证明AD 患者脑组织随着年龄增长持续增强的炎症反应在疾病的病理过程中起着关键作用[3]。目前临床上治疗AD 的西药主要以胆碱酶抑制剂和氨基酸受体拮抗剂。然而这些药物有一定的局限性,长期服用费用高、患者依从性差,并且具有严重的不良反应[4]。因此,积极寻求安全有效的非药物治疗方法尤为重要。已有大量研究运用电针来防治AD,并证明其可抑制脑组织毒性炎症反应,可以有效提高学习记忆功能[5]。近几年出现的新型神经电生理技术-重复经颅磁刺激(repetitive transcranial magnetic stimulation,rTMS),在神经系统疾病领域备受关注[6]。它通过将电流持续重复作用于大脑远隔皮层,影响皮层支配区域神经递质与突触传递,改变神经元兴奋性,促进神经元突触修复和功能重组[7]。但国内将电针联合rTMS 防治AD 的研究尚在摸索阶段,因此本研究利用行为学等检测方法来进一步深入探讨EA联合rTMS 对改善AD 样模型大鼠认知功能障碍的可能机制和疗效。
1 材料与方法
1.1 实验材料
1.1.1 实验动物分组4个月龄SD雄性大鼠,体质量370 ~390 g,由湖北省实验动物研究中心提供,许可证号:SCXK(鄂)2018-0018。饲养环境通风,光照均匀,自由饮食。大鼠适应性饲养1 周后,采取随机数字表法将大鼠分成正常组(Normal)、模型组(Model)、电针组(EA)、重复经颅磁组(rTMS)和电针+经颅磁组(EA+rTMS),每组8 只。
1.1.2 主要实验仪器和试剂HANS-200A 韩式电针仪(南京济生医疗科技有限公司),一次性无菌毫针(北京中研太和医疗器械有限公司),Morris 水迷宫(成都泰盟),石蜡切片机(广州三元科技有限公司),电泳仪(北京市六一仪器厂,型号:DYY-6C),HT7700 透射电镜(日本日立公司),重复经颅磁刺激仪(YRD CCY-1 型,武汉依瑞德公司)。Iba-1 一抗、山羊抗兔IgG H&L(Cy3®)、预吸附二抗(英国Abcam),TNF-α、IL-6、IL-1β抗体(北京博奥森生物技术有限公司)。
1.2 方法
1.2.1 动物模型制备及干预方法除正常组外,其他组均采用D-半乳糖[120 mg/(kg·d)]腹腔连续注射8 周制备AD 样模型大鼠[8]。造模结束后进行干预,方法如下:(1)EA 组:根据余曙光《实验针灸学》[9]取动物针灸常用“百会”和两侧“肾俞”穴。0.25 mm × 15 mm 毫针向前15°角平刺“百会”3 ~4 mm,“肾俞”向脊柱方向斜刺3 ~4 mm,一组导线分别接“百会”和“肾俞”,左右“肾俞”穴隔日交替使用。予连续波,频率50 Hz,电流1 mA,以针刺局部颤动即可。(2)rTMS 组:采用YRD CCY-1型电磁刺激仪,固定大鼠头部,将“8”字线圈垂直紧贴大鼠颅部左侧前额叶,刺激频率为5 Hz,最大输出强度为90%,重复脉冲磁刺激10 串,每串10 次。(3)EA+rTMS 组:电针治疗之后进行重复经颅磁刺激,方法及刺激参数同EA 组和rTMS 组,以上干预1 次/日,共2 周。
1.2.2 Morris 水迷宫实验水池直径120 cm,高60 cm。平台置于第4 象限,池中装水直至水面高出平台2 cm,水温保持在(23.0±0.5)℃。兑入奶粉搅拌,使整个背景与大鼠头部涂有黄色苦味酸的毛发形成反差,在水池每个象限边缘中点贴上标签作为入水点。定位航行试验:实验前将大鼠放入水池自由游泳2 min 以适应水池环境。将大鼠面向池壁从4 个入水点依次放入水中,记录其在120 s 内找到平台的时间(即逃避潜伏期)和游泳路径。若大鼠在120 s 内未能找到平台则牵引至平台停留10 s,记录其逃避潜伏期为120 s,连续实验5 d。空间探索实验:第6 天移去平台,将大鼠从原平台的对侧象限入水点投放水中,自由游泳120 s,记录各组大鼠在原平台象限探索时间。
1.2.3 透射电镜观察大鼠海马区突触后致密带厚度行为学测试结束后每组选4 只大鼠,称重按量,腹腔注射水合氯醛进行麻醉,置冰上快速剥离出新鲜海马组织,迅速转入现配的电镜固定液中,4 ℃固定2~3 h。3 d 后0.01 MPBS 漂洗组织,1%锇酸固定1 h,漂洗后在不同浓度乙醇里进行梯度脱水,随后丙酮液中浸透,环氧树脂包埋剂中35 ℃过夜,最后聚合、切片和染色,透射电镜观察及拍片,用Image-pro plus 6.0 软件来计算突触后致密带厚度。
1.2.4 免疫组织化学染色法检测大鼠海马区活化的小胶质细胞数量每组取4 只大鼠将其麻醉,心脏灌注固定后断头取脑,置固定液中24 h。随后滴蜡包埋、切片。组织常规脱腊清洗,柠檬酸缓冲液进行抗原修复,冷却后PBS 清洗3 次,H2O2室温孵育以灭活内源性过氧化物酶。PBS 冲洗,滴加山羊血清封闭,再滴加Iba-1 一抗(1∶100),湿盒内4 ℃过夜,PBS 清洗3 次;滴山羊抗兔IgG H&L(Cy3®)预吸附二抗,湿盒避光孵育1 h,PBS 冲洗3次;然后滴辣根酶室温孵育,加入现配DAB 显色液,染至棕黄色,PBS 冲洗后滴加苏木素染色60 s,随后1%HCL 分化10 s,脱水,风干,封片。显微镜下观察统计激活的小胶质细胞数。
1.2.5 Western blot 法检测大鼠海马组织TNF-α、IL-6、IL-1β蛋白表达水平大鼠快速断头,解剖分离出海马,配置凝胶加入样品蛋白,进行组织样品蛋白提取;现配RIPA 裂解液,PBS 漂洗,加裂解液进行高速离心匀浆;取上清液测定蛋白浓度,根据PAGE 凝胶电泳分离出目标条带,采用湿转法进行转膜,在TBST 中封闭滴加一抗,4 ℃孵育过夜清洗再滴二抗,室温避光孵育2 h,经ECL 化学发光法检测蛋白条带。收集图像,使用AlPhaEaseFC软件对样品条带的吸光度值进行数字化分析,以β-actin 为参照蛋白,目的蛋白与β-actin 的比值则为其相对表达量。
1.3 统计学方法采用GraPhPad Prism.8 软件进行统计分析。计量资料以均数±标准差表示,对符合正态分布的数据,组间比较用方差分析,组间多重比较方差齐时采用t检验,方差不齐时采用秩和检验(Kruskal-Wallis)。P<0.05 为差异有统计学意义。
2 结果
2.1 Morris 水迷宫实验在定位航行实验第1 天各组间逃避潜伏期无差异;第2 天模型组与正常组与EA+rTMS 组比,逃避潜伏期延长(P<0.01);此后3 d 各干预组逃避潜伏期随着训练的延长比模型组明显缩短(P<0.01),表明各组大鼠在持续学习训练中已逐渐通过学习记忆找到平台。空间探索实验中模型组比其余组在目标象限探索时间明显缩短(P<0.01);EA + rTMS 组比EA 组和rTMS 组在目标象限探索时间又显著延长(P<0.01)。说明EA 和rTMS 刺激干预都能改善大鼠空间学习记忆能力,EA 联合rTMS 刺激治疗比单独使用EA 或rTMS 刺激疗效更显著。见图1、2。

图1 各组大鼠逃避潜伏期比较Fig.1 Comparison of escape latency of rats ineachgroup
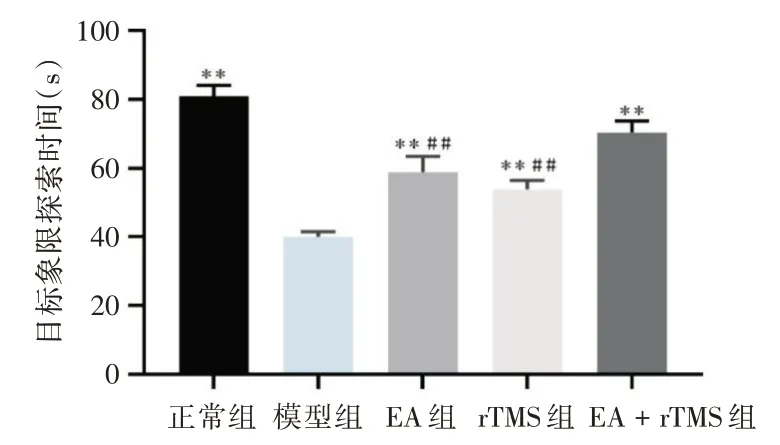
图2 各组大鼠在目标象限探索时间比较Fig.2 Comparison of exploration time in the target quadrant of rats in each group
2.2 各组大鼠海马区突触后致密带厚度比较与正常组比较,模型组大鼠海马区突触后致密带稀薄(P<0.01),前后膜界限不清;与模型组比较,各干预组大鼠突触后致密带厚度增大(P<0.01);与EA+rTMS 组比,EA 组和rTMS 组大鼠突触后致密带厚度更显著变薄(P<0.01)。见图3。

图3 各组大鼠海马区突触后致密带厚度比较Fig.3 Comparison of the thickness of the postsynaptic dense zone in the hippocampus of rats in each group
2.3 各组大鼠海马区活化的小胶质细胞数比较与正常组比较,模型组小胶质细胞胞核增大,伪足增长,数量增多(P<0.01);与模型组比较,各干预组活化的小胶质细胞数明显下降(P<0.01);与EA + rTMS 组比较,EA 组和rTMS 组活化的小胶质细胞数增加(P<0.05)。见图4。
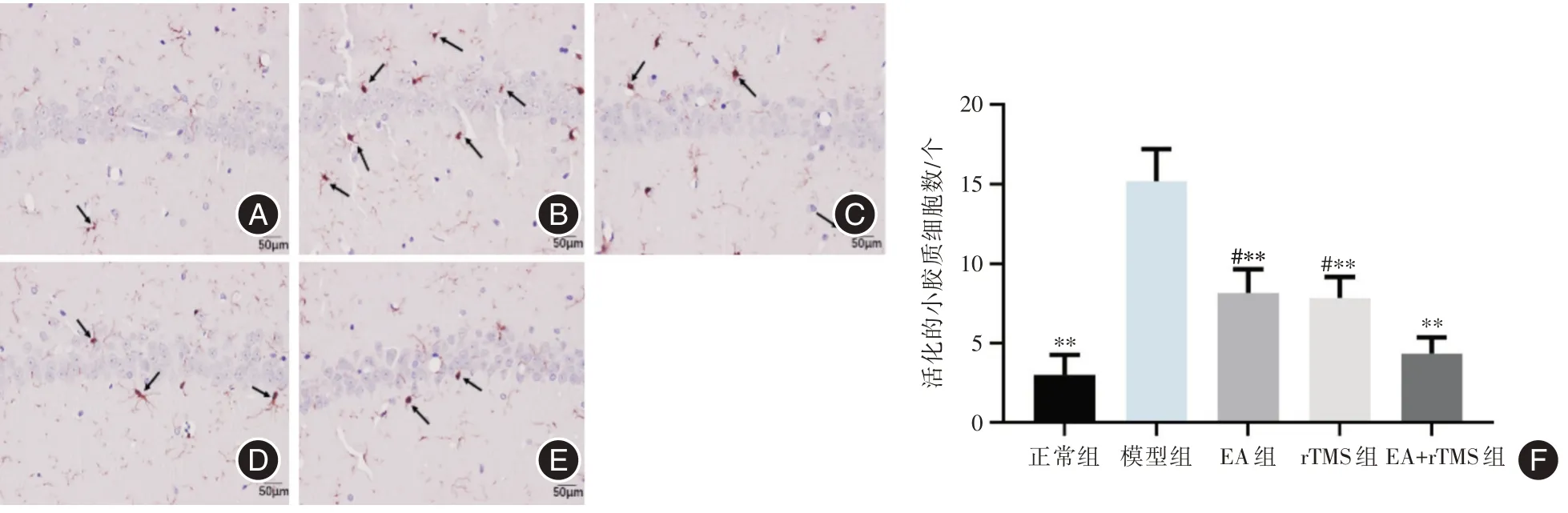
图4 各组大鼠海马区活化的小胶质细胞数比较Fig.4 Comparison of the number of the activatedmicrogliacells in hippocampus of rats in each group
2.4 各组大鼠海马区TNF-α、IL-6、IL-1β蛋白表达比较与正常组比较,模型组大鼠海马区TNF-α、IL-6、IL-1β的表达增强,与模型组比较,各干预组蛋白表达差异均有统计学意义(P<0.01);与EA+rTMS 组比较,EA 组和rTMS 组海马区各蛋白表达均上升(P<0.01)。见图5。
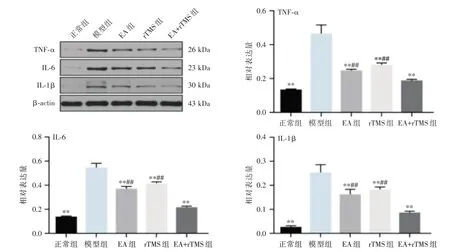
图5 各组大鼠海马区炎症相关蛋白表达量比较Fig.5 Comparison of the expression levels of inflammation-related proteins in hippocampus of rats in each group
3 讨论
AD 的病理发展过程复杂多变,至今认为脑组织中大量神经元损伤和突触丢失是AD 的典型病理特征[10]。人类大脑主要由神经元和胶质细胞两类细胞组成。神经元是神经回路形成的基本单位,它由轴突、树突以及突触构成。神经突触是神经元之间信息传递形成回路的核心部件,也是产生认知记忆的基本[11]。突触由突触前膜、突触间隙和突触后膜构成,PSD 是突触后膜内侧胞质面一层致密物质,它参与突触后膜信息的重组与编辑,影响突触结构的可塑性,对学习记忆功能有重要作用[12]。胶质细胞中小胶质细胞(microgia,MG)介导的神经炎症反应是导致神经元损伤和突触丢失的关键[13]。MG 是中枢神经系统主要的防御细胞,但在AD 进程中持续激活的MG 对突触过度吞噬清除,造成突触丧失及认知功能下降[14]。有研究结果显示电针和rTMS 可改变动物MG 的激活,提高突触重组和传递效能,保护神经元[15-16]。本研究也显示EA 和rTMS 有保护神经元的作用,但EA 与rTMS 联合比单一的治疗方法更加有效地抑制MG 的激活,增大PSD 厚度,使神经突触之间紧密连接,极大地提高了AD 样模型大鼠逃避潜伏期和在目标象限探索时间,是控制大鼠学习记忆能力损害的可行手段。
同时持续激活的MG 释放大量的促炎因子如TNF-α、IL-6、IL-1β[17-18]等,促进APP 形成和Aβ沉积,诱导Aβ斑块周围的神经元丢失及凋亡,加重炎症反应[19]。本研究显示EA 结合rTMS 比单独的EA 组和rTMS 组显著地减少炎症因子TNF-α、IL-6、IL-1β的释放。
综上所述,EA 结合rTMS 或许是通过抑制AD样模型大鼠脑内神经炎症反应,降低对突触的损害从而提升大鼠空间学习记忆和认知能力。但是本研究中对大鼠突触的改变是激活的MG 引起的还是炎症因子引起的,还是两者皆有,有待进一步研究。

