药用植物根际微生物对其品质形成的影响及其作用机制的研究进展
祝 蕾,严 辉,刘 培,张振宇,张 森,郭 盛,江 曙,段金廒
药用植物根际微生物对其品质形成的影响及其作用机制的研究进展
祝 蕾,严 辉*,刘 培,张振宇,张 森,郭 盛,江 曙,段金廒*
南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心,江苏省中药资源产业化过程协同创新中心,国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023
根际是植物-土壤-微生物信息和物质交换的重要场所,是影响植物生长和抗逆性的重要因素。植物根系和根际微生物之间的相互作用对于植物的生长和品质形成至关重要。植物根系通过分泌有机酸、糖类、次生代谢物等物质特异性的促进有益微生物的生长,也能通过自身免疫系统和分泌抗生素抑制病原菌的增殖。根际微生物可以通过多种方式参与药用植物的生长发育、代谢过程以及活性成分的积累,对于药用植物的养分吸收和利用、土传病害防治、非生物胁迫应激等方面具有至关重要的作用。主要对根际微生物对药用植物品质形成的影响及其作用机制的研究进展进行综述,以期为深入了解根际微生物与药用植物间的互作关系提供参考。
根际;土壤;微生物;药用植物;品质形成;作用机制
中医药在我国已经有几千年的发展历史,历史上曾为抗击疾病做出过重要贡献,当前中医药又在新型冠状病毒肺炎防控中发挥了独特作用,在国际上引起了广泛关注。中药资源是我国重要的战略性资源,普遍应用于药物、保健品、食品、其他卫生产品以及出口贸易[1]。中药材的品质受到药用植物品种、土壤、气候因子、农艺措施、采收加工贮藏方式等因素的影响[2]。根际是指受根系活动紧密影响的,物理、生物和化学特性上与周围大块土壤不同的靠近植物根系的土壤微域[3]。根际微生物被誉为植物的第2套基因组,对植物的养分循环、生长发育、产量提升、病虫害防御等起着关键作用[4]。近年来,有关根际微生物影响药用植物生长与健康的研究多集中于药用植物产量提升、活性成分积累、连作障碍缓解、生防微生物筛选等方面。本文主要对根际微生物对药用植物品质形成的影响及其作用机制的研究进展进行综述,以期为深入了解根际微生物与药用植物间的互作关系提供参考。
1 药用植物根际微生物多样性
根际是地球上物质和能量循环、信息交换最活跃的界面之一,也是植物-微生物-土壤三者相互作用密切的一个复杂的生态系统。细菌中变形菌(尤其是假单胞菌科(Pseudomonadaceae)和伯克氏菌科(Burkholderiaceae)是药用植物根际中最为丰富的优势菌群[5]。部分真菌如镰刀菌属sp.和丝核菌属sp.是药用植物重要的病原微生物,而白粉寄生菌属sp.、盾壳霉属sp.及木霉属sp.等则是根际促生真菌,是生防微生物筛选的重要菌种来源[5]。放线菌(尤其是链霉菌sp.)能产生多种具有生物活性的代谢物,对于一些土传病虫害有较好的拮抗作用[6]。如Mojicevic等[7]从3种民族药用植物虞美人L.、母菊L.和异株荨麻L.的根际土壤中分离了103株产孢菌,鉴定属于链霉菌属,其中有43个链霉菌菌株具有产生抗真菌化合物的能力。
2 根际微生物对药用植物品质形成的影响
根际微生物可以通过直接或间接的方式影响植物的生长和抗逆性。对植物生长有益的土壤微生物通常被称为植物根际促生菌,主要包括根瘤菌属、假单胞菌属、芽孢杆菌属、菌根真菌、木霉菌属等。
2.1 根际微生物增强药用植物的抗病虫害能力
我国中药材种类繁多、药用部位多样、产区跨度大、生物学特征差异明显,从而导致病虫害种类多样性高且危害严重[8]。多年生中药材(如人参、西洋参、三七等)地下病虫害尤其普遍,常见的主要有根腐病、黑斑病、根结线虫病、白粉病、圆斑病等[9]。Zohair等[10]从3种药用植物根际分离出的2株真菌MG772677和盖姆斯木霉KX685665,对4种病原菌(包括腐皮镰孢菌、立枯丝核菌、齐整小核菌和大丽轮枝菌)的平均抑制率分别为77.90%、77.98%。Nakaew等[11]研究发现从姜黄根际土壤中分离到的链霉菌sp. TM32对植物病原菌具有较强的抗菌活性。Kim等[12]研究发现从人参根际分离出的解淀粉芽孢杆菌AK-0能够抑制由人参锈腐病菌引起的根腐病。Li等[13]研究发现灰黄青霉菌CF3能够显著抑制附子中土传根病原菌尖孢镰刀菌和齐整小核菌的生长。
2.2 根际微生物增强药用植物的抗逆能力
低温、高温、干旱、盐碱、水涝、重金属等不利因子会扰乱植物的生理生化状态,影响植物的生长发育,严重的会导致植株死亡。研究表明,根际微生物通过调控植物体内与胁迫相关基因的表达,增强植物在胁迫条件下的养分吸收,提高植物的应急耐受性[14]。Egamberdieva等[15]研究发现共接种中慢生根瘤菌sp. NWXJ19或NWXJ31和极端东方化假单胞菌TSAU20显著缓解了甘草植株的盐胁迫,使甘草的产量和根瘤数增加。Yousefi等[16]研究发现接种产脂固氮螺菌或圆褐固氮菌能显著提高车桑子种子的耐盐度,使种子的发芽率以及根、茎的长度和生物量增加。菌根真菌提高了干旱条件下小茴香的渗透调节能力,使小茴香挥发油产量、叶片和果实的养分含量增加[17]。菌根真菌还能显著提高铅胁迫下龙葵的根际微生物多样性和对氨基酸、糖类、脂肪酸等的代谢活性[18]。此外,研究表明重金属如Co、Cd和Zn的存在会促进根际微生物分泌铁载体。如Zn2+胁迫下,人参根际真菌哈茨木霉、圆红冬孢酵母、尖孢镰刀菌会增加铁载体的分泌,以应对环境的威胁[19]。
2.3 根际微生物促进药用植物的生长和药用部位发育
根际有益微生物可以促进植物对氮、磷、钾以及铁等矿质元素的吸收直接促进植物的生长。具有固氮作用的根际微生物主要包括根瘤菌属、缓生根瘤菌属、固氮螺菌属、菌根真菌等,芽孢杆菌、假单胞杆菌、沙雷氏菌、青霉菌、链霉菌、菌根真菌等被具有解磷作用[20]。张海珠等[21]研究发现,菌根真菌提高了滇重楼根际土壤中氮、磷、钾等营养元素的含量,使滇重楼药材对Mg、Na、Zn、Ni的富集能力增加,有利于其生长和品质形成。韩丽珍等[22]从茶树根际分离了2株溶磷细菌贝莱斯芽孢杆菌和坚强芽孢杆菌,通过产生有机酸来溶解磷元素,显著促进花生的生长。部分根际微生物还能产生具有促生作用的植物激素。王琦琦等[23]、Chandra等[24]和费诗萱等[25]分别从木碱蓬、甜叶菊、红枣根际中分离得到具有产吲哚-3-乙酸活性的根际细菌,具有增强植株的根系生长,提高株高以及根和茎生物量等作用。此外,根际有益微生物还可以通过诱导宿主的系统抗性达到拮抗病原菌和促进植株生长的目的。Berendsen等[26]研究发现拟南芥根际的微杆菌sp.、寡养单胞菌sp.和黄单胞菌sp.共同参与了诱导拟南芥对霜霉病的系统抗性。
2.4 根际微生物促进药用植物有效成分的合成
植物的次生代谢在信息交换、环境适应和协同进化中起着重要的作用,并且能吸引传粉者和传种者,防御天敌和病原体,还能参与植物之间的协同和竞争作用,有助于植物对物理化学环境改变的适应等[27]。植物的次生代谢产物不仅是植物长期适应进化的结果,还常常作为一种药物植的有效成分而存在。
根际微生物通过调控药用植物中与次生代谢产物合成相关基因的表达,合成转化植物活性成分前体的关键酶等机制促进药用植物有效成分的积累[28-29]。Zeng等[30]研究发现板蓝根际显著富集的伯克霍尔德菌sp.参与板蓝功效物质靛蓝的合成。Zhai等[31]研究发现棘孢木霉ACCC30536通过上调青蒿素生物合成关键酶基因等的表达,提高了黄花蒿叶片中青蒿素浓度。接种混合的根际促生菌增加了栝楼中药用成分多糖和天花粉蛋白的积累[32]。短小芽孢杆菌通过增加关键酶的表达来提高甘草酸的含量[33]。圆褐固氮菌和巴西固氮螺菌共接种能使唇萼薄荷中脱落酸、可溶性糖、蛋白质、酚类、黄酮类以及含氧单萜的含量提高[34]。假单胞菌和泛菌sp.可能通过产生植物激素和多糖参与丹参次生代谢产物的合成,对丹参中酚类物质迷迭香酸、丹酚酸B的积累有显著促进[35]。
2.5 根际微生物缓解药用植物连作障碍
我国中药材栽培历史悠久,本草中记载有关药用植物栽培的方法可追溯至2600多年以前[36]。目前已经实现了300多种药用植物的人工种植,大约有70%的根及根茎类药材受到连作障碍的困扰[37]。连作障碍的形成是土壤养分缺乏和理化性质改变、根系分泌物和根残留物引起的化感自毒作用、土壤传染性病虫害加剧等多种因子相互作用的结果[38]。研究表明尖孢镰刀菌能刺激植株内酚酸物质的积累,导致植株程序性死亡[39]。酚酸类物质能差异性地调节根际土壤微生物群落,促进致病菌的增殖同时使有益菌衰减[40]。酚酸与土壤致病菌的正相互作用,可能是连作障碍形成的主要机制。
目前解决连作障碍的措施主要包括选育抗连作障碍的药用植物品种、建立合理的耕作制度、施用有机肥和微生物菌肥[41]。在农业生产中,间套作和轮作制度是一种传统有效的减轻或避免连作障碍的种植模式[42]。施用添加木霉的有机肥使黄瓜连作土壤更接近初始土壤,影响了其根际微生物的组成,提高了真菌的多样性,使植株生长状态提升[43]。根际微生物能够改善土壤微环境,增加根际微生物的生物量和土壤酶活性,降低土壤中真菌/细菌的比例,缓解连作障碍。如施用有益微生物复合菌剂能够缓解太子参[44]、三七[45]、广藿香[46]、滇重楼[47]等中药材的连作障碍。Zhao等[48]研究发现三七-玉米体系中土壤微生物酶活性显著高于三七单作体系,细菌和真菌数量增多,但真菌-细菌的比例减小,在属水平上镰刀菌和不动杆菌sp的相对丰度显著减少,而芽孢杆菌相对丰度显著增加。Tian等[49]从人参根际分离到1株解淀粉芽孢杆菌TB6,接种后通过降低根际真菌的丰富度和多样性,提高多酚氧化酶、磷酸酶、脲酶和过氧化氢酶的活性,促进人参根系的生长。
3 药用植物调控根际微生物组成的分子机制
植物在塑造根际微生物群落方面起着至关重要的作用。植物根系分泌物、根系代谢、根系角质层成分和植物免疫系统是植物调控根际微生物的组成的主要途径[50],见图1。
3.1 药用植物的根系分泌物调控根际微生物
植物在其生长过程中不断的向根际分泌包括糖类、氨基酸、有机酸、脂肪酸、酚酸、甾醇、蛋白质以及生长因子在内的各种物质[53]。根系分泌物能够调控根际微生物与根际趋化、信号响应、次生代谢、生物膜形成等基因的表达,促进微生物在根际的定殖和生长。研究表明,根际细菌优先利用植物分泌的芳香有机酸如烟碱、莽草酸、水杨酸、肉桂酸和吲哚-3-乙酸[54]。如水杨酸可以调节特定的细菌类群在根际的定殖[55],拟南芥中三萜生物合成基因簇的代谢产物能调节拟南芥根际中特定细菌类群的生长[56]。根系分泌物中的信号分子是调节根际微生物在根际定殖的关键因子。根瘤菌和丛枝菌根真菌是植物与根际微生物共生的2种主要形式。类黄酮是根瘤菌与豆科植物形成共生固氮的信号分子,通过激活根瘤菌基因的表达,诱导根瘤形成[57]。菌根真菌可与80%以上的高等植物根系形成共生菌根,植物根系释放的独脚金内酯作为信号分子,诱导菌根真菌菌丝分枝并侵染植物形成菌根[58]。除了这2种共生形式,兰科植物天麻在人工栽培过程中需要小菇属萌发菌石斛小菇Fan et Guo、紫萁小菇Lange、开唇兰小菇Fan et Guo、兰小菇Fan et Guo等才能完成种子的萌发[59]。Carvalhais等[60]研究发现植物合成独脚金内酯的能力对根际真菌群落有明显的影响,野生型拟南芥与独脚金内酯合成受损的突变体相比根际真菌群落的β-多样性存在显著差异,黑附球菌、青霉菌sp.、和等对独脚金内酯有趋化作用。
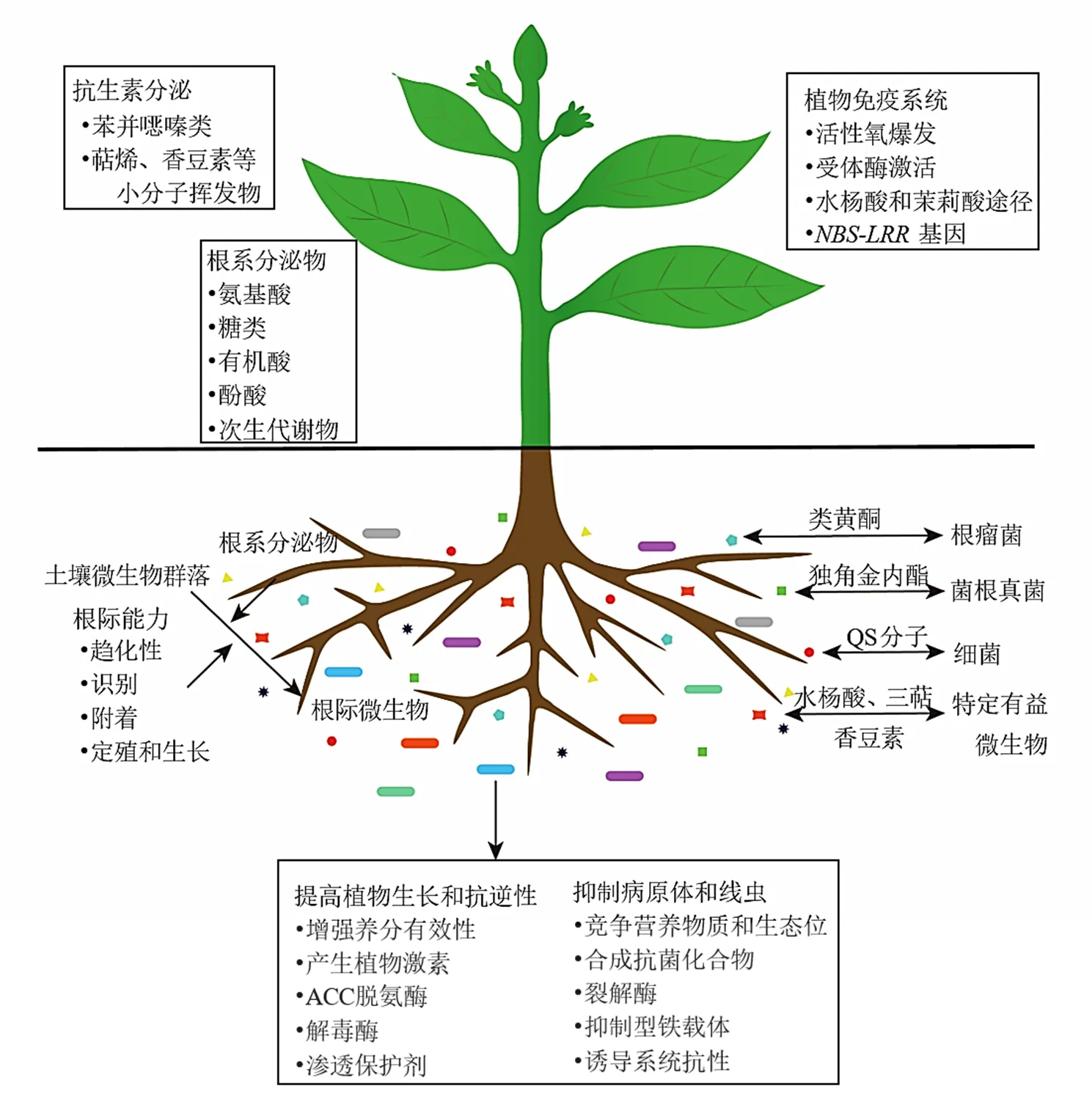
该图在Trivedi等[51]和Huang等[52]绘制基础上修改而来。不同颜色的矩形代表不同的根际微生物类群。三角形、正方形、五边形、圆形和星形代表植物根系释放的不同种类的化合物
3.2 药用植物分泌抗生素
3.3 药用植物的自身免疫
植物自身的免疫系统也可以调节根际微生物的定殖。植物的免疫系统主要由病原相关分子模式触发的免疫反应(PAMP-triggered immunity,PTI)和效应因子触发的免疫反应(effector-triggered immunity,ETI)组成。PTI能够识别病原体的鞭毛蛋白、脂多糖、几丁质和延伸因子Tu等,通过活性氧爆发、丝裂原活化蛋白激酶的激活以及水杨酸和茉莉酸信号途径的诱导产生防御应答[51]。ETI则可以识别微生物分泌的效应蛋白,诱导过敏反应,使被侵染部位的植物细胞死亡,阻止病原体的进一步扩散。当植物受到病原体侵害时,会启动自身免疫防御反应,间接对根际微生物的组成产生影响[53]。植物免疫激素会因不同病原菌而产生响应,进而相应的调控植物防御信号的产生。水杨酸途径主要介导由病原微生物引起的非特异性的系统获得性抗性[67],而茉莉酸和乙烯则介导由特定的根定殖根际细菌引起的诱导性系统抗性[68]。水杨酸处理可以增强水稻和二穗短柄草(L.) P. Beauv对土传真菌纹枯病菌的抗性,而水杨酸水平降低的转基因水稻植株则更容易被纹枯病菌感染[69]。乙烯响应因子(ethylene response factors,)基因缺失的突变体与野生型番茄相比,根系分泌物组成发生了显著变化,基因的敲除导致根系分泌物对南方根结线虫和马铃薯白线虫的趋化性增强[70]。
4 根际微生物增强药用植物生长和适应性的分子机制
根际微生物可以通过直接或间接的方式影响植物的生长和抗逆性[71]。一方面,根际微生物可以增强植物对养分的吸收利用,产生促进植物生长的化合物如植物激素;另一方面还可以通过直接竞争效应和产生抑菌物质帮助植物抵御各种生物和非生物胁迫(图1)。
4.1 根际微生物增强药用植物的养分有效性
根际微生物影响药用植物营养状况的机制主要包括向植物提供养分、增强养分的生物利用度以及增强植物对养分的获取能力[72]。根瘤菌可以与豆科植物形成共生固氮体,在非豆科植物桔梗[73]、甘草[74]、缬草[75]等中也发现了根瘤菌的存在。菌根真菌可与大多数陆生高等植物形成共生菌根,通过根部的菌丝网络增大与土壤的接触面积,增强药用植物对氮、磷的吸收[58]。有些根际微生物如根瘤菌、假单胞菌、木霉菌分泌的铁载体可以有效地与铁结合释放出铁离子被药用植物吸收[76]。在牡丹根际发现的黑曲霉具有溶解含钙、铁、锌、铝等的难溶磷酸盐的能力[77]。Hussein等[19]从人参根际分离得到具有高效产铁载体能力的青霉菌sp. JJHO。此外,根际微生物还可以通过产生植物激素(如生长素、细胞分裂素、赤霉素、脱落酸、乙烯、油菜素甾醇、独脚金内酯等)促进根的增殖,使根的总表面积增加,有利于药用植物对土壤中水和养分的吸收,对药用植物的生长和活性成分的积累有促进作用。大多数根际促生菌中都发现有生长素的产生,如桔梗[73]根际的根瘤菌,甜叶菊[24]、人参[78]和红枣[25]的根际促生菌均能产生生长素。此外赤霉菌具有产生赤霉素的能力。研究表明,伯克氏菌可参与板蓝根中功效物质靛蓝的合成[30],木霉菌通过上调黄花蒿中青蒿素生物合成关键酶的表达促进了青蒿素的合成[31],菌根真菌通过上调类黄酮生物合成基因的表达增加了金线莲中类黄酮的含量[79]。
4.2 根际微生物增强药用植物的抗性
在干旱、高盐度、水涝、重金属污染、低温、高温等非生物胁迫下,根际微生物产生1-氨基环丙烷-1-羧酸(1-amino-cyclopropanecarboxylic acid,ACC)脱氨酶调节乙烯合成前体ACC的浓度,降低乙烯的产量,缓解乙烯介导的植物生长抑制对各种胁迫的响应。如芽孢杆菌通过调节ACC的积累、ACC-氧化酶和ACC-合酶的活性,改善了盐胁迫下玉米植株的生长[80]。酶或非酶抗氧化剂活性的增强是根际微生物应对各种胁迫的主要机制之一。印度梨形孢和圆褐固氮菌共接种降低了黄花蒿植株丙二醛和H2O2的浓度,增强了抗氧化酶(超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶)和非酶抗氧化剂(总黄酮、酚类和类胡萝卜素)的活性,并使青蒿素、脯氨酸的含量显著提高[81]。共接种混合的根际促生菌提高了姜黄对1,1-二苯基-2-三硝基苯肼自由基和2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基的清除能力以及酚类和总黄酮的含量[82]。接种根际促生菌还对曼陀罗叶和根中的氨基酸代谢有显著影响[83]。Amanifar等[84]发现菌根真菌能增加甘草中磷钾的浓度,促进脯氨酸的积累,调节植株中Na+/K+的稳态以增强甘草对盐的耐受。此外,根际微生物还能够上调植物相关抗性基因的表达,如枯草芽孢杆菌的应用增强了拟南芥中抗干旱和耐盐相关基因的表达[85]。根际微生物还能通过对重金属进行吸附、沉淀或者产生金属螯合物,减少植物对重金属的吸收利用缓解重金属胁迫[86]。芽孢杆菌和根瘤菌共接种能降低紫花苜蓿植株中铜的积累,增加土壤脲酶、蔗糖酶和β-葡萄糖苷酶活性[87]。
4.3 根际微生物拮抗药用植物病原微生物
根际微生物对病原菌的拮抗主要通过抗生作用、对生态位和营养元素的竞争、干扰群效应、重寄生作用和诱导植物抗病性等机制[4]。有些根际微生物如青霉菌、链霉菌、放线菌通过产生抑菌物质抑制病原体的生长。人参根际的解淀粉芽孢杆菌对人参灰霉病菌Pers.[88]、人参锈腐病菌[12]具有显著的抑制活性,其中人参根际的解淀粉芽孢杆菌AK-0以及姜黄[11]根际的链霉菌sp. TM32通过合成抗菌素抑制多种植物病原菌的生长。还有一些根际微生物如假单胞菌、芽孢杆菌能产生挥发性有机化合物,研究表明醛类化合物是发挥抑菌作用的关键物质[89]。从根际土壤中分离的枯草芽孢杆菌通过产生苯甲醛、壬醛、苯并噻唑和苯乙酮等挥发性有机化合物抑制马铃薯环腐病菌ssp.的生长[90]。铁元素是根际微生物与病原菌争夺激烈的稀缺资源,某些微生物产生的抑制型铁载体不能被病原菌识别,在根际铁元素竞争中处于优势,从而抑制病原菌生长[91]。Sheng等[92]从半夏根际土壤中分离的产铁载体短短芽孢杆菌GZDF3对白色念珠菌有显著拮抗活性。40%~50%细菌通过群体感应调节微生物-微生物相互作用。根际微生物通过产生裂解酶(如内酯酶、酰胺酶、还原酶、氧化酶等)破坏细菌群体感应系统,对病原体生物膜的形成、毒力因子的合成和分泌等行为产生干扰[93]。芽孢杆菌和贪噬菌通过降解丁香假单胞菌pv.产生的群体感应信号分子-十四烷酰基高丝氨酸内酯和-己酰基高丝氨酸内酯缓解番茄植株的过敏反应[94]。此外,微生物的分泌系统、鞭毛和菌毛等细胞结构,以及效应蛋白等蛋白质通过激发植物的诱导性系统抗性,间接促进植物防御[51]。如芽孢杆菌属的植物促生根瘤菌通过激活水杨酸、茉莉酸或乙烯信号通路,触发拟南芥、烟草、番茄等植物的诱导性系统抗性[95]。
5 结语与展望
植物与根际微生物之间存在着复杂的相互作用关系。根际具有极其丰富的微生物多样性,这些微生物可以直接或间接的影响药用植物的生长发育和品质形成。根际微生物能够影响植物的光合作用、呼吸代谢等生理过程,进而对药用植物的生长发育及根系功能产生影响,还可以通过改变药用植物根系分泌物的组成,改善土壤理化性质,缓解药用植物连作障碍;一些根际微生物被报道能够参与药用成分的合成。某些根际微生物自身可以产生抗菌代谢物,如2,4-二乙酰间苯三酚、吩嗪、脂肽以及挥发性有机化合物等。因此,有效的利用根际微生物的促生机制以及对植物病虫害的生物防治作用,对提高植物的产量和品质具有重要的意义。公认的道地性形成的理论主要包括环境生态论、品种延续与产地变迁论、品质生态学理论、逆境效应理论、本草基因组学理论。此外,何冬梅等[29]提出了中药微生态与中药道地性的理论,从中药微生态的角度阐释了中药道地性的形成原因。目前药用植物根际微生物研究的重点领域是药用植物连作障碍,已经在三七、地黄、人参、西洋参等中药材中取得了重要突破。其次是对于中药材道地性的研究,多集中于根际微生物对道地药材形成的物质基础即次生代谢产物的影响,但对于作用机制的研究还比较少。
随着各种新兴技术如现代分子生物技术、人工智能技术、信息科学技术以及各种观测技术的发展和完善,未来对根际微生物与药用植物互作机制的研究会不断的深入。今后药用植物根际微生物的研究重点应该包括以下几个方面:(1)加强对根际促生菌促生机制的研究,加快生防菌剂的开发。多年生药用植物地下病虫害普遍且危害严重,导致中药材品质的下降和对环境的污染,微生物菌剂具有高效、安全、无公害等优点,能够改善土壤环境,对于提升药用植物的产量和质量具有关键作用;(2)加强对药用植物连作障碍机制的研究。中药材需要一定的种植年限才能达到药用标准,长期在同一土地上连代种植导致连作障碍普遍存在。关于连作障碍形成的具体机制还不清楚。阐明药用植物连作障碍的内在机制,为药用植物的种植提供理论指导,对于中药材品质提升和中药资源可持续发展具有重要的意义;(3)加强对根际微生态介导的中药材道地性形成机制的研究。特定的生态地理环境造就了道地药材优良的品质和临床疗效,研究根际微生态与道地药材品质间的关联,将微观的药用植物代谢产物变化,根际微生物组成和宏观上土壤理化性质,植物生长特性统一结合、系统研究,有助于全面地阐释药用植物的生长调控机制,从而阐明道地药材的形成机制。
利益冲突 所有作者均声明不存在利益冲突
[1] 马晓晶, 郭娟, 唐金富, 等. 论中药资源可持续发展的现状与未来 [J]. 中国中药杂志, 2015, 40(10): 1887-1892.
[2] 杨毅, 田侃, 倪新兴, 等. 中药材品质影响因素实证研究 [J]. 中药材, 2016, 39(6): 1251-1256.
[3] Garcia J, Kao-Kniffin J. Microbial group dynamics in plant rhizospheres and their implications on nutrient cycling [J]., 2018, 9: 1516.
[4] Mendes R, Garbeva P, Raaijmakers J M. The rhizosphere microbiome: Significance of plant beneficial, plant pathogenic, and human pathogenic microorganisms [J]., 2013, 37(5): 634-663.
[5] Schlaeppi K, Bulgarelli D. The plant microbiome at work [J]., 2015, 28(3): 212-217.
[6] 肖艳红, 李菁, 刘祝祥, 等. 药用植物根际微生物研究进展 [J]. 中草药, 2013, 44(4): 497-504.
[7] Mojicevic M, D'Agostino P M, Nikodinovic-Runic J,. Antifungal potential of bacterial rhizosphere isolates associated with three ethno-medicinal plants (poppy, chamomile, and nettle) [J]., 2019, 22(3): 343-353.
[8] 沈亮, 徐江, 陈士林, 等. 无公害中药材病虫害防治技术探讨 [J]. 中国现代中药, 2018, 20(9): 1039-1048.
[9] 王瑞, 董林林, 徐江, 等. 农田栽参模式中人参根腐病原菌鉴定与防治 [J]. 中国中药杂志, 2016, 41(10): 1787-1791.
[10] Zohair M M, El-Beih A A, Sadik M W,. Promising biocontrol agents isolated from medicinal plants rhizosphere against root-rot fungi [J]., 2018, 15: 11-18.
[11] Nakaew N, Lumyong S, Sloan W T,. Bioactivities and genome insights of a thermotolerant antibiotics-producing Streptomyces sp. TM32 reveal its potentials for novel drug discovery [J]., 2019, 8(11): e842.
[12] Kim Y S, Balaraju K, Jeon Y H. Biological characteristics ofAK-0 and suppression of ginseng root rot caused by[J]., 2017, 122(1): 166-179.
[13] Li Y, Guo Q, Wei X,. Biocontrol effects ofagainst monkshood (Debx.) root diseases caused byandspp [J]., 2019, 127(5): 1532-1545.
[14] 王希付, 张雪, 赵荣华, 等. 丛枝菌根真菌在药用植物中的作用及机制研究进展 [J]. 中国实验方剂学杂志, 2020, 26(11): 217-226.
[15] Egamberdieva D, Li L, Lindström K,. A synergistic interaction between salt-tolerantandstrains improves growth and symbiotic performance of liquorice (Fish.) under salt stress [J]., 2016, 100(6): 2829-2841.
[16] Yousefi S, Kartoolinejad D, Bahmani M,. Effect ofandon germination and early growth of hopbush shrub (L.) under salinity stress [J]., 2017, 36(2): 107-120.
[17] Zardak S G, Dehnavi M M, Salehi A,. Effects of using arbuscular mycorrhizal fungi to alleviate drought stress on the physiological traits and essential oil yield of fennel [J]., 2018, 6: 31-38.
[18] 韩娟, 张向前, 赵金莉. 铅胁迫下接种AM真菌对龙葵根际土壤微生物群落代谢特征的影响 [J]. 中国生态农业学报: 中英文, 2019, 27(4): 545-553.
[19] Hussein K A, Joo J H. Zinc ions affect siderophore production by fungi isolated from therhizosphere [J]., 2019, 29(1): 105-113.
[20] 童琳, 唐旭利, 张静, 等. 菌根形成对不同成熟度的森林优势树种磷吸收的影响 [J]. 生态科学, 2015, 34(4): 93-98.
[21] 张海珠, 李杨, 张彦如, 等. 菌根真菌处理下滇重楼对营养元素的吸收和积累 [J]. 环境化学, 2019, 38(3): 615-625.
[22] 韩丽珍, 周静, 王欢. 两株对花生促生的芽孢杆菌的鉴定及溶磷特性研究 [J]. 基因组学与应用生物学, 2019, 38(9): 4066-4076.
[23] 王琦琦, 冯丽, 李杨, 等. 新疆木碱蓬()根际耐盐促生细菌的筛选及鉴定 [J]. 微生物学通报, 2019, 46(10): 2569-2578.
[24] Chandra S, Askari K, Kumari M. Optimization of indole acetic acid production by isolated bacteria fromrhizosphere and its effects on plant growth [J]., 2018, 16(2): 581-586.
[25] 费诗萱, 张敏, 王迎, 等. 具有ACC脱氨酶活性的红枣根际促生菌株的分离筛选及其促生效果研究 [J]. 西北林学院学报, 2019, 34(6): 140-146.
[26] Berendsen R L, Vismans G, Yu K,. Disease-induced assemblage of a plant-beneficial bacterial consortium [J]., 2018, 12(6): 1496-1507.
[27] 陈晓亚, 王凌健, 毛颖波, 等. 植物萜类生物合成与抗虫反应 [J]. 生命科学, 2015, 27(7): 813-818.
[28] Zhai X, Jia M, Chen L,. The regulatory mechanism of fungal elicitor-induced secondary metabolite biosynthesis in medical plants [J]., 2017, 43(2): 238-261.
[29] 何冬梅, 王海, 陈金龙, 等. 中药微生态与中药道地性 [J]. 中国中药杂志, 2020, 45(2): 290-302.
[30] Zeng M J, Zhong Y J, Cai S J,. Deciphering the bacterial composition in the rhizosphere of(NeeS) Bremek [J]., 2018, 8(1): 15831.
[31] Zhai T T, Wang Y F, Liu C L,.ACCC30536 inoculation improves soil nutrition and leaf artemisinin production in[J]., 2019, 41(4): 46.
[32] Jiang C H, Xie P, Li K,. Evaluation of root-knot nematode disease control and plant growth promotion potential of biofertilizer Ning shield onin the field [J]., 2018, 49(2): 232-239.
[33] Xie Z C, Chu Y K, Zhang W J,.alleviates drought stress and increases metabolite accumulation inFisch [J]., 2019, 158: 99-106.
[34] Asghari B, Khademian R, Sedaghati B. Plant growth promoting rhizobacteria (PGPR) confer drought resistance and stimulate biosynthesis of secondary metabolites in pennyroyal (L.) under water shortage condition [J]., 2020, 263: 109132.
[35] You H, Yang S J, Zhang L,. Promotion of phenolic compounds production inhairy roots by six strains of rhizosphere bacteria [J]., 2018, 18(3): 160-168.
[36] 郭巧生, 王长林. 我国药用植物栽培历史概况与展望 [J]. 中国中药杂志, 2015, 40(17): 3391-3394.
[37] 张重义, 林文雄. 药用植物的化感自毒作用与连作障碍 [J]. 中国生态农业学报, 2009, 17(1): 189-196.
[38] Alemán F. Common bean response to tillage intensity and weed control strategies [J]., 2001, 93(3): 556-563.
[39] Qin X J, Wu H M, Chen J,. Transcriptome analysis ofin response to the infection of pathogenic[J]., 2017, 17(1): 155.
[40] Wu H M, Xu J J, Wang J Y,. Insights into the mechanism of proliferation on the special microbes mediated by phenolic acids in therhizosphere under continuous monoculture regimes [J]., 2017, 8: 659.
[41] 周芳, 曹国璠, 李金玲, 等. 药用植物连作障碍机制及其缓解措施研究进展 [J]. 山地农业生物学报, 2019, 38(3): 67-72.
[42] 王素娜. 轮作缓解甜瓜连作障碍的机理研究 [D]. 沈阳: 沈阳农业大学, 2017.
[43] Cai F, Pang G, Li R X,. Bioorganic fertilizer maintains a more stable soil microbiome than chemical fertilizer for monocropping [J]., 2017, 53(8): 861-872.
[44] 吴林坤, 吴红淼, 朱铨, 等. 不同改良措施对太子参根际土壤酚酸含量及特异菌群的影响 [J]. 应用生态学报, 2016, 27(11): 3623-3630.
[45] 赵涵予, 位小丫, 林煜, 等. 两种菌剂处理对连作三七根际土壤的修复效果分析 [J]. 福建农业学报, 2018, 33(11): 1181-1189.
[46] 郑扬波, 李明, 张梓豪, 等. EM菌对连作广藿香扦插苗生长特性及土壤微生态的影响 [J]. 华南农业大学学报, 2019, 40(2): 60-64.
[47] 欧洪, 郭冬琴, 林俊杰, 等. AM真菌对滇重楼根际土壤微生物数量及酶活性的影响 [J]. 中药材, 2016, 39(5): 948-955.
[48] Zhao J, Li Y L, Wang B Y,. Comparative soil microbial communities and activities in adjacent Sanqi ginseng monoculture and maize-Sanqi ginseng systems [J]., 2017, 120: 89-96.
[49] Tian L, Shi S H, Ji L,. Effect of the biocontrol bacteriumon the rhizosphere in ginseng plantings [J]., 2018, 21(3): 153-162.
[50] 葛艺, 徐绍辉, 徐艳. 根际微生物组构建的影响因素研究进展 [J]. 浙江农业学报, 2019, 31(12): 2120-2130.
[51] Trivedi P, Leach J E, Tringe S G,. Plant-microbiome interactions: From community assembly to plant health [J]., 2020, 18(11): 607-621.
[52] Huang X F, Chaparro J M, Reardon K F,. Rhizosphere interactions: Root exudates, microbes, and microbial communities [J]., 2014, 92(4): 267-275.
[53] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望 [J]. 植物生态学报, 2014, 38(3): 298-310.
[54] Zhalnina K, Louie K B, Hao Z,. Dynamic root exudate chemistry and microbial substrate preferences drive patterns in rhizosphere microbial community assembly [J]., 2018, 3(4): 470-480.
[55] Lebeis S L, Paredes S H, Lundberg D S,. PLANT MICROBIOME. Salicylic acid modulates colonization of the root microbiome by specific bacterial taxa [J]., 2015, 349(6250): 860-864.
[56] Huang A C, Jiang T, Liu Y X,. A specialized metabolic network selectively modulatesroot microbiota [J]., 2019, 364(6440): eaau6389.
[57] Broughton W J, Perret X. Genealogy of legume-symbioses [J]., 1999, 2(4): 305-311.
[58] Davison J, Moora M, Öpik M,. FUNGAL SYMBIONTS. Global assessment of arbuscular mycorrhizal fungus diversity reveals very low endemism [J]., 2015, 349(6251): 970-973.
[59] 王彩云, 侯俊, 王永, 等. 天麻种子萌发菌研究进展 [J]. 北方园艺, 2017(12): 198-202.
[60] Carvalhais L C, Rincon-Florez V A, Brewer P B,. The ability of plants to produce strigolactones affects rhizosphere community composition of fungi but not bacteria [J]., 2019, 9: 18-26.
[61] Bednarek P, Osbourn A. Plant-microbe interactions: Chemical diversity in plant defense [J]., 2009, 324(5928): 746-748.
[62] Hu L F, Robert C A M, Cadot S,. Root exudate metabolites drive plant-soil feedbacks on growth and defense by shaping the rhizosphere microbiota [J]., 2018, 9(1): 2738.
[63] 张贺, 何依依, 吴家庆, 等. 玉米根系分泌物中关键抑菌物质对大豆疫霉的抑菌活性 [J]. 植物保护, 2019, 45(6): 124-130.
[64] 王菲, 孙文帅, 张秀婷, 等. 间作大葱对桔梗根系分泌物的影响 [J]. 山东农业科学, 2019, 51(11): 68-73.
[65] Lv H, Cao H S, Nawaz M A,. Wheat intercropping enhances the resistance of watermelon towilt [J]., 2018, 9: 696.
[66] Li X G, de Boer W, Zhang Y N,. Suppression of soil-bornepathogens of peanut by intercropping with the medicinal herb[J]., 2018, 116: 120-130.
[67] Fu Z Q, Dong X N. Systemic acquired resistance: Turning local infection into global defense [J]., 2013, 64: 839-863.
[68] Pieterse C M J, van der Does D, Zamioudis C,. Hormonal modulation of plant immunity [J]., 2012, 28: 489-521.
[69] Kouzai Y, Kimura M, Watanabe M,. Salicylic acid-dependent immunity contributes to resistance against, a necrotrophic fungal agent of sheath blight, in rice and[J]., 2018, 217(2): 771-783.
[70] Dyer S, Weir R, Cox D,. Ethylene Response Factor () genes modulate plant root exudate composition and the attraction of plant parasitic nematodes [J]., 2019, 49(13/14): 999-1003.
[71] Mantelin S, Touraine B. Plant growth-promoting bacteria and nitrate availability: Impacts on root development and nitrate uptake [J]., 2004, 55(394): 27-34.
[72] Müller D B, Vogel C, Bai Y,. The plant microbiota: Systems-level insights and perspectives [J]., 2016, 50: 211-234.
[73] Huang C M, Chen W C, Lin S H,. Exploration of root-associated bacteria from the medicinal plant[J]., 2019, 34(4): 413-420.
[74] He C, Wang W, Hou J. Characterization of dark septate endophytic fungi and improve the performance of liquorice under organic residue treatment [J]., 2019, 10: 1364.
[75] Ghodsalavi B, Ahmadzadeh M, Soleimani M,. Isolation and characterization of rhizobacteria and their effects on root extracts of[J]., 2013, 7(3): 338-344.
[76] David S R, Ihiawakrim D, Regis R,. Iron removal from raw asbestos by siderophores-producing[J]., 2020, 385: 121563.
[77] 薛冬, 黄向东, 宋根娣, 等. 牡丹根际溶磷真菌的筛选及其促生效应 [J]. 生态环境学报, 2018, 27(9): 1639-1645.
[78] Ji W X, Leng X, Jin Z X,. Plant growth promoting bacteria increases biomass, effective constituent, and modifies rhizosphere bacterial communities of[J]., 2019, 69(2): 135-146.
[79] Zhang Y, Li Y Y, Guo S X. Effects of the mycorrhizal fungussp. AR2 on growth and flavonoid accumulation in[J]., 2020, 8: e8346.
[80] Misra S, Chauhan P S. ACC deaminase-producing rhizosphere competentspp. mitigate salt stress and promotegrowth by modulating ethylene metabolism [J]., 2020, 10(3): 119.
[81] Arora M, Saxena P, Abdin M Z,. Interaction between Piriformospora indica anddiminish the effect of salt stress inL. by enhancing enzymatic and non-enzymatic antioxidants [J]., 2020, 80(1): 61-73.
[82] Dutta S C, Neog B. Accumulation of secondary metabolites in response to antioxidant activity of turmeric rhizomes co-inoculated with native arbuscular mycorrhizal fungi and plant growth promoting rhizobacteria [J]., 2016, 204: 179-184.
[83] Rahmoune B, Zerrouk I Z, Bouzaa S,. Amino acids profiling inand study of their variations after inoculation with plant growth promoting Rhizobacteria [J]., 2019, 74(10): 1373-1383.
[84] Amanifar S, Khodabandeloo M, Mohseni Fard E,. Alleviation of salt stress and changes in glycyrrhizin accumulation by arbuscular mycorrhiza in liquorice () grown under salinity stress [J]., 2019, 160: 25-34.
[85] Woo O G, Kim H, Kim J S,.strain GOT9 confers enhanced tolerance to drought and salt stresses inand[J]., 2020, 148: 359-367.
[86] 瞿攀, 伏毅, 刘绵学, 等. 植物-微生物联合修复镍污染土壤研究进展 [J]. 土壤, 2019, 51(1): 11-18.
[87] Ju W L, Jin X L, Liu L,. Rhizobacteria inoculation benefits nutrient availability for phytostabilization in copper contaminated soil: Drivers from bacterial community structures in rhizosphere [J]., 2020, 150: 103450.
[88] Sun Z, Yang L M, Han M,. Biological control ginseng grey mold and plant colonization by antagonistic bacteria isolated from rhizospheric soil ofMeyer [J]., 2019, 138: 104048.
[89] 张鹏鹏. 几株植物根际促生细菌释放的挥发性物质对拟南芥及病原菌的影响 [D]. 泰安: 山东农业大学, 2013.
[90] Rajer F U, Wu H J, Xie Y L,. Volatile organic compounds produced by a soil-isolate,FA26 induce adverse ultra-structural changes to the cells ofssp., the causal agent of bacterial ring rot of potato [J]., 2017, 163(4): 523-530.
[91] Gu S H, Wei Z, Shao Z Y,. Competition for iron drives phytopathogen control by natural rhizosphere microbiomes [J]., 2020, 5(8): 1002-1010.
[92] Sheng M M, Jia H K, Zhang G Y,. Siderophore production by rhizosphere biological control bacteriaGZDF3 ofand its antifungal effects on[J]., 2020, 30(5): 689-699.
[93] 郭冰怡, 董燕红. 细菌群体感应抑制剂研究进展 [J]. 农药学学报, 2018, 20(4): 408-424.
[94] Jose P A, Krishnamoorthy R, Kwon S W,. Interference in quorum sensing and virulence of the phytopathogenpv.byandspecies [J]., 2019, 64(4): 423-433.
[95] Wu L M, Huang Z Y, Li X,. Stomatal closure and SA-, JA/ET-signaling pathways are essential forFZB42 to restrict leaf disease caused byin[J]., 2018, 9: 847.
Research progress on effects of rhizosphere microorganisms on quality formation of medicinal plants and their interaction mechanisms
ZHU Lei, YAN Hui, LIU Pei, ZHANG Zhen-yu, ZHANG Sen, GUO Sheng, JIANG Shu, DUAN Jin-ao
State Administration of Traditional Chinese Medicine Key Laboratory of Chinese Medicinal Resources Recycling Utilization, Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China
The rhizosphere plays important roles in the exchange of information and material among plant-soil-microbes, and is also the major factor effecting on plant growth and stress resistance. The interaction between plant roots and rhizosphere microorganisms is critical for plant growth and quality formation. Plant roots can specifically promote the growth of beneficial microorganisms by secreting organic acids, sugars, and secondary metabolites, etc., and inhibit the proliferation of plant pathogens through its autoimmune systems and the secretion of antibiotics. Rhizosphere microbes can participate in the growth, development, metabolic processes, and active components accumulation of medicinal plants in both direct and indirect ways, and have important contributions on the nutrient absorption, utilization, soil-borne disease control, and abiotic stress responses of medicinal plants. Research progress on effects of rhizosphere microorganisms on quality formation of medicinal plants and their interaction mechanisms are reviewed in this paper, in order to provide reference for further understanding the interaction between rhizosphere microorganisms and medicinal plants.
rhizosphere; soil; microorganisms; medicinal plants; quality formation; mechanism
R282.2
A
0253 - 2670(2021)13 - 4064 - 10
10.7501/j.issn.0253-2670.2021.13.030
2020-11-10
国家自然基金面上项目(81773848);国家中药标准化项目(ZYBZH-C-JS-34);财政部和农业农村部: 现代农业产业技术体系建设专项(CARS-21);名贵中药资源可持续利用能力建设项目(2060302)
祝 蕾(1997—),女,硕士研究生,研究方向为中药资源与鉴定。Tel: 13222030367 E-mail: zhulei0402@163.com
严 辉(1980—),男,博士,副教授,研究方向为中药资源与资源化学。E-mail: glory-yan@163.com
段金廒(1956—),男,教授,主要从事中药资源化学与资源循环利用研究。Tel: (025)85811291 E-mail: dja@njucm.edu.cn
[责任编辑 崔艳丽]