氮添加和干旱对亚热带两个树种生长、光合及挥发性有机碳释放的影响
张 羽, 孙浩钊, 刘燕飞, 汤行昊, 方 熊
(1.福建农林大学资源与环境学院/土壤环境健康与调控福建省重点实验室, 福建 福州 350002; 2.福建省林业科学研究院,福建 福州350012)
当前全球氮沉降日益加剧[1],研究表明[2-4],我国华南地区每年氮沉降量已经达到32~49 kg·hm-2,预计我国亚热带地区未来几十年氮沉降量仍将不断增加.同时,全球降水格局的改变将增加未来极端气候事件发生的频率及强度[5],而我国华南地区也将面临干旱气候的威胁[4].我国亚热带森林具有重要的生态系统服务功能[6],然而氮添加和干旱交互作用将如何影响亚热带森林植物的生长和生理过程并不十分清楚.因此,研究氮沉降增加背景下干旱对我国亚热带地区森林植物生长和生理的影响具有重要生态学意义.
氮作为植物生长重要营养元素,外源氮输入可通过增加植物体内氮素含量影响植物体内碳分配格局,从而影响各器官生物量分配[7,8].一般认为氮添加能促进植物地上部生长,抑制地下部生长[9],从而改变植物根冠比和非结构性碳水化合物(non-structural carbohydrate, NSC)分配[10].水分生理相关研究表明,干旱会限制植物生长发育各个阶段,影响植物光合与呼吸作用从而影响植物体内物质合成和运输等一系列生理过程[11,12].长期干旱会降低植物光合作用[13],从而引起碳饥饿[14],最终导致植物无法维持正常新陈代谢并加速植物死亡.NSC含量代表着植物碳收支以及应对环境胁迫适应能力,可以调控植物死亡速度,氮添加能够改变植物NSC含量,调控植物面对干旱风险时的应对能力[15].研究表明[16],NSC含量高的树种在干旱胁迫下具有较高水势,因而死亡速率比NSC含量低的树种慢.而氮添加对碳同化产物的积累也会被长期干旱所消耗.长期干旱还会引起植物木质部栓塞,抑制植物生长,并且影响植物根冠比[17].许多研究结果表明,氮添加和干旱会影响作为植物光合碳分配重要形式的植物源挥发性有机碳(biogenic volatile organic compounds-carbon, BVOC-C)释放[18,19].目前,干旱胁迫下植物氮代谢响应机制还存在争议.有研究表明干旱会引起冬小麦早衰,加重氮损耗情况[20],而适度干旱反而会提高植物叶片中氮元素运输效率[21];氮添加情况下的植物生长对干旱敏感性增加[22],而钟小莉等[8]研究表明,适量氮添加对干旱胁迫下胡杨幼苗的生长存在补偿效应.因此,有必要进一步研究植物生长和生理过程对氮添加和干旱交互作用的响应.
基于此,本研究以亚热带乡土优势树种木荷(SchimasuperbaGardn. Et Champ.)及典型人工林树种杉木[Cunninghamialanceolata(Lamb.) Hook.]为研究对象,研究氮添加、干旱及二者交互作用对两种植物生长和生理的影响.结果可为全球氮水格局变化背景下亚热带森林植物生理生态响应的相关研究提供依据.
1 材料与方法
1.1 试验设计
于2017年12月,选择亚热带典型树种木荷和杉木1年苗种于容量为15 L塑料花盆中,随机摆放在温室并定期对幼苗进行挪盆换位.土壤为自然黄壤表层森林土的混匀土,每盆土壤干重6 kg.为保证幼苗不受水分胁迫影响,定期进行补水保持土壤水分充足.
于2018年7月,分别选择长势一致的木荷和杉木盆栽各16盆开始进行试验处理.处理分别为对照(CK)、干旱(D)、施氮(N)、施氮和干旱(ND)4个处理,每种处理设置4个重复.干旱处理将土壤含水量设置为约田间最大持水量的40%,非干旱处理保持土壤含水量约田间最大持水量的60%;施氮组氮加量为10 g·m-2·a-1(本试验施用硝酸铵,用去离子水溶解稀释后每月1次定量施入盆栽土壤)[4].试验开始后,对所有幼苗进行称重法控水,定期进行称重补水.试验处理1年后于2019年7月,测量幼苗胸径、树高、光合参数并采集植物BVOCs,采用全收割法收取植物,并采用水冲法获得植物完整根系.
1.2 植物根茎叶采集及生物量测定
分别采集两种幼苗的根、茎、叶,并将根系按照直径>2 mm、1~2 mm及<1 mm划分为3个等级装在信封袋内.60 ℃烘干72 h至恒重,取出称重.根据各器官干重计算每株幼苗总生物量以及根冠比(地下部分干重/地上部分干重).
1.3 植物叶绿素、淀粉、可溶性糖及非结构性碳水化合物含量测定
叶片样品烘干前测定植物叶绿素,烘干后测定植物淀粉、可溶性糖及非结构性碳水化合物(non-structural carbohydrate, NSC)含量.植物叶绿素采用比色法[23]测定:随机取鲜叶剪成碎片并混匀,精密称取0.5 g,充分研磨并经过80%丙酮充分提取,过滤所得溶液于紫外分光光度计中以663 nm及645 nm波长测定吸光度,计算得到叶绿素a及叶绿素b含量.将叶绿素a和叶绿素b含量相加得到总叶绿素含量.公式:D663 nm=82.04Ca+9.27Cb;D645 nm=16.75Ca+45.60Cb.公式中Ca为叶绿素a的浓度,Cb为叶绿素b的浓度.
植物叶片和根系的淀粉、可溶性糖及NSC含量采用硫酸蒽酮法[24]测定:分别将烘干后叶片及<1 mm细根样品用球磨仪磨成粉末,过80目筛,通过80%酒精提取上清液,活性炭脱色过滤后测定可溶性糖含量;沉淀通过高氯酸提取后使用硫酸蒽酮法,溶液于紫外分光光度计测得淀粉含量.NSC含量由可溶性糖和淀粉含量相加所得.
1.4 光合指标及植物挥发性有机碳分配总量
光合参数使用便携式光合仪(LiCor-6400, LI-COR Biosciences, USA)测定.在天气晴朗的上午9点至11点,设定LED红蓝光源且光强为1 000 PAR.每棵植物随机挑选4~5片成熟叶,夹紧叶片等待数据稳定后计数.记录植物净光合速率、气孔导度、胞间二氧化碳浓度等各项光合参数.
采用动态顶空套袋法测定植物BVOCs[25].在晴天上午9至11时,采用Teflon材质采样袋包裹随机挑选的植物枝条,使用进气泵(10L-D,大连德霖气体包装有限公司)将空气鼓入填满硅胶、碘化钾、活性炭等吸附材料的吸附柱,将经过吸附柱的干洁空气通入采样袋内,采样袋通气30 min充分稳定后于出气端使用针筒采集1 000 mL气体至Tedlar袋中.采样过程中采样袋内悬挂放置温湿度计(RC-4HC,中国精创Elitech)用于监测记录采样袋内温湿度,每5 min使用光合有效辐射仪(Model MQ-500, Apogee instruments, The USA)监测并记录采样点光强.选在植物采样附近位置采集空白对照.迅速将收集的气体样品通过预浓缩—气质联用法(Agilent, Entech 7200-7890B-5977A)进行分析.采用手持式叶面积仪(CI-203, CID Bio-Science, The USA)拉取采气所选枝条的叶面积,结果用于换算单位面积气体释放通量.化合物释放速率计算公式如下:
公式中:F为植物BVOC通量,单位分别为pmol·m-2·s-1;C0和C1分别为空白动态箱和样品动态箱中BVOC的目标物浓度(10-9);f为进气流量,单位为L·s-1;A为Teflon袋所包裹的枝条叶面积,单位为m2;Vm为标准状况下的气体摩尔体积,为22.4 L·mol-1;T为采样时间段内所检测的大气平均温度,单位为℃.根据不同种类BVOCs含碳比例计算两种幼苗BVOC-C释放量,试验共分析了57种臭氧前提物即PAMS标样化合物含量、6种单萜烯含量以及乙醛、丙醛、丙酮等醛酮类化合物含量.
1.5 数据分析
使用SPSS 17.0的单因素方差分析对植物生理指标、光合参数、挥发性有机碳通量进行处理间差异显著性检验,Duncan法进行组间比较,所有结果P<0.05即显著.采用SigmaPlot 12.5作图.
2 结果与分析
2.1 氮添加与干旱对木荷和杉木生物量的影响
总体而言,氮添加增加木荷和杉木生物量,干旱则降低木荷和杉木生物量,而氮添加和干旱交互处理对木荷和杉木生物量无显著影响(图1).氮添加显著增加(P<0.05)木荷茎和叶生物量,而对两种植物细根生物量无显著影响;干旱显著降低(P<0.05)木荷粗根和叶片生物量,对两种植物根和茎生物量无显著影响.氮添加和干旱交互处理除显著降低(P<0.05)杉木叶片生物量外,对木荷和杉木其他各器官生物量均无显著影响.
木荷和杉木胸径及树高在施氮处理后显著高于(P<0.05)对照组,在干旱处理后两种幼苗胸径和树高显著降低(P<0.05),氮添加和干旱交互处理对杉木胸径和两种幼苗树高无显著影响,但降低(P<0.05)木荷胸径.相比于对照组,氮添加分别使木荷和杉木根冠比降低28.8%和10.9%,而在干旱处理后木荷和杉木根冠比则分别增加22.5%和43.5%(表1),氮添加和干旱交互处理对两种植物幼苗根冠比无显著影响.
不同字母表示相同指标在不同处理组差异显著(P<0.05).CK:对照;D:干旱;N:施氮;ND:施氮干旱.图A:木荷;图B:杉木.图1 不同处理对木荷与杉木两种树种各器官和总生物量的影响Fig.1 Effects of different treatments on organs and total biomass of S.superba and C.lanceolata
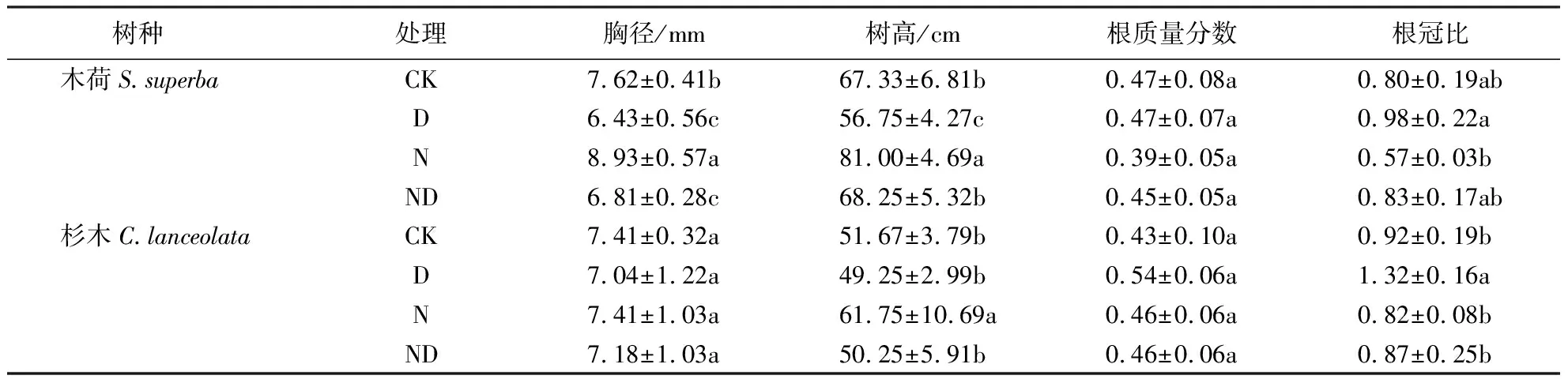
表1 不同处理对木荷与杉木胸径、树高和生物量分配的影响1)Table 1 Effects of different treatments on basal diameter, height and biomass distribution of S.superba and C.lanceolata
2.2 氮添加与干旱对叶绿素含量和净光合速率的影响
氮添加、干旱以及二者交互处理均显著增加(P<0.05)两种幼苗叶片叶绿素含量(图2).氮添加显著提高(P<0.05)木荷净光合速率,氮添加能使木荷净光合速率达到对照水平的3倍,氮添加对杉木净光合速率无显著影响(表2);干旱对两种植物幼苗净光合速率均无影响;氮添加和干旱交互处理后木荷和杉木净光合速率都有增加趋势,且杉木在氮添加和干旱交互处理后净光合速率显著增加(P<0.05).
2.3 氮添加和干旱对细根与叶片非结构性碳水化合物的影响
氮添加使木荷叶片的可溶性糖含量显著增加(P<0.05),但细根(<1 mm)的可溶性糖含量显著下降(P<0.05);氮添加对两种植物幼苗叶片和细根的淀粉、NSC含量及杉木的可溶性糖含量均无显著影响(图3).干旱处理显著降低(P<0.05)杉木叶片的可溶性糖含量,但对两种植物细根和木荷叶片的可溶性糖含量无影响.木荷和杉木叶片的淀粉含量在干旱处理后分别下降37.1%和11.8%,细根的淀粉含量则分别上升8.3%和19.7%.干旱处理使杉木叶片的NSC显著降低(P<0.05),对两种幼苗细根的NSC和木荷叶片的NSC含量无影响.

不同字母表示相同指标在不同处理下差异显著(P<0.05).CK:对照;D:干旱;N:施氮;ND:施氮干旱. 图A表示木荷叶绿素含量;图B表示杉木叶绿素含量.图2 不同处理对木荷和杉木总叶绿素含量的影响Fig.2 Effects of different treatments on total chlorophyll content of S.superba and C.lanceolata
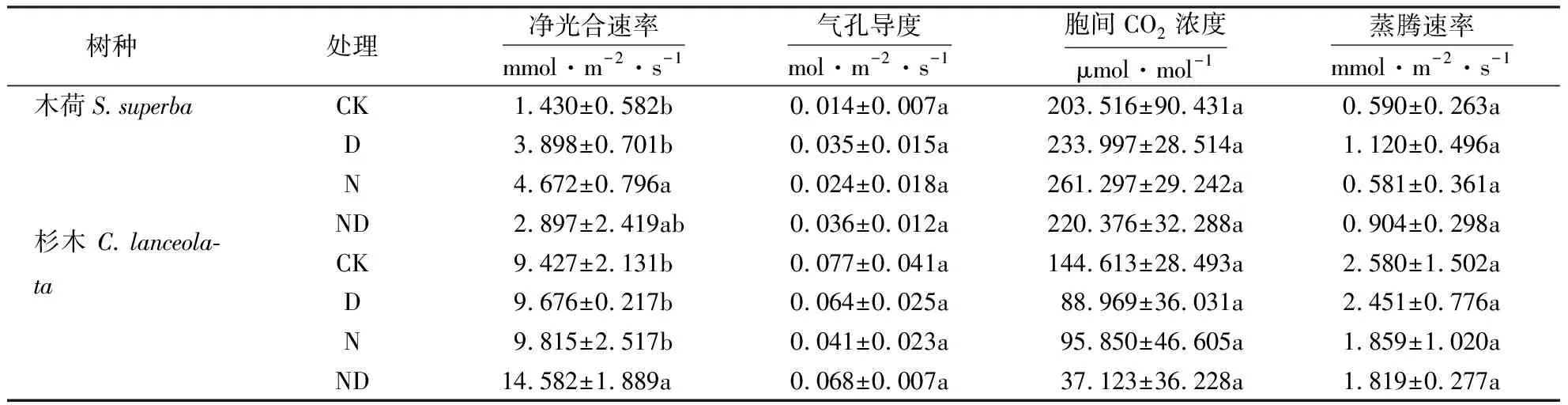
表2 不同处理对木荷与杉木光合作用的影响1)Tabel 2 Effects of different treatments on photosynthesis of S.superba and C.lanceolata
不同字母表示相同指标在不同处理下差异显著(P<0.05).图3 不同处理对细根与叶片可溶性糖、淀粉、非结构性碳水化合物含量的影响Fig.3 Effects of different treatments on the contents of soluble sugar, starch and unstructured carbohydrates in fine roots and leaves
氮添加和干旱交互处理下杉木叶片和木荷细根可溶性糖含量显著降低(P<0.05),但杉木细根和木荷叶片可溶性糖含量无显著变化.氮添加和干旱交互处理显著降低(P<0.05)木荷叶片淀粉含量,并使木荷和杉木叶片的NSC含量分别降低40.6%和19.9%.
2.4 氮添加与干旱对木荷和杉木挥发性有机碳释放的影响
干旱以及氮添加处理对两种植物幼苗BVOC-C释放量都有增加趋势.氮添加和干旱单一处理对木荷BVOC-C释放影响不大,但是氮添加和干旱交互处理促进木荷BVOC-C释放,并显著高于(P<0.05)对照处理.而在氮添加处理后的杉木BVOC-C释放量达对照组的7.4倍,在干旱处理后达对照组的4.5倍,但是氮添加和干旱交互处理下,BVOC-C释放总量与对照组无显著差异(图4).

不同字母表示相同指标在不同处理下差异显著(P<0.05).CK:对照;D:干旱;N:施氮;ND:施氮干旱.A:木荷;B:杉木.图4 不同处理对木荷与杉木挥发性有机碳释放的影响Fig.4 Effects of different treatments on volatile organic compounds-carbon emissions of S.superba and C.lanceolata
3 讨论
3.1 氮添加和干旱对两种植物生长的影响
氮是植物生长的主要营养限制因素,对植物生长发育有着重要的促进作用[7].如Tiiva et al[26]对苏格兰松幼苗氮添加的试验结果表明,氮添加能显著提高苏格兰松幼苗的生物量,这与本研究结果基本一致.本研究结果也表明氮添加显著增加木荷茎和叶生物量.但是氮添加未显著增加杉木生物量累积,这表明杉木对氮添加响应策略与木荷不同.
一般认为干旱将导致植物总生物量及其各器官生物量显著减少[27],并促进植物根冠比增加[28,29].本研究结果同样发现干旱能使杉木和木荷粗根、茎、叶等器官的生物量降低,并且干旱使木荷根冠比显著增加.这主要归因于地下部分生物量下降幅度小于地上部分,从而导致根冠比增加.同时,根据资源最优分配原则,一般植物在水分不足时将分配更多生物量资源至地下部分,这种策略能够提高植物对水分和养分的汲取能力[17].
钟小莉等[8]研究表明适量氮添加对胡杨幼苗在干旱胁迫下的生长存在补偿效应.因此本研究的氮水交互处理对两种幼苗总生物量无显著影响,可能是氮添加量对干旱胁迫下两种幼苗的生长存在补偿效应,说明适量氮添加能够抵消干旱对植株总生物量积累带来的部分负面影响.
3.2 氮添加与干旱对两种植物光合作用及光合作用同化物产量的影响
叶绿素作为光合主要色素其含量决定了植物光合过程中对光能的获取能力.而氮添加能够增加叶片氮素含量,促进植物叶绿素的合成,从而促进植物光合作用[7].由表2可知,相比于对照组,氮添加显著增加木荷净光合速率,这与氮添加导致木荷总叶绿素含量显著增加(图1)有一定关系.有研究表明不同植物对氮添加的敏感性不同[8,9],因此,虽然氮添加同样显著增加杉木总叶绿素含量,但其净光合速率增加不显著,因而杉木生物量无显著增加.这可能是因为本试验中所用杉木幼苗品种的光合速率对氮添加的敏感性低于木荷.
本研究中干旱显著增加两种植物总叶绿素含量(图2).也有研究结果表明随着干旱加剧,叶绿素含量显著升高[29],同时有研究发现干旱会使植物叶绿素先下降后升高再下降[30].叶片含水量随土壤干旱而降低,导致叶绿素含量上升,可能植物应对干旱胁迫的一种适应机制,以维持植物在干旱胁迫下的光合作用能力.植物光合作用除色素的影响外还会受气孔导度、蒸腾拉力和自身能量等影响[31].邓秀秀等[32]研究干旱对马尾松幼苗生长和光合特性的影响结果表明,干旱显著降低植物净光合速率、蒸腾速率、气孔导度和胞间CO2浓度,但光合色素含量无显著变化.因此在本试验结果中,虽然干旱处理导致两种植物幼苗叶片的叶绿素水平显著增加,但干旱处理下幼苗净光合速率均无显著变化.叶绿素水平上升只能一定程度缓解干旱胁迫下植物体机能下降对光合作用造成的不利影响[32].本研究中氮添加和干旱交互作用显著增加两种植物幼苗叶绿素含量,且两种幼苗净光合速率均呈增加的趋势,这与钟小莉等[8]研究结果相一致,可能是因为干旱条件下适量的氮添加能显著增加幼苗叶绿素含量,从而维持植株自身光竞争力.
有研究表明,植物叶片NSC含量随氮添加量增加而增加[33].另外也有一些结果认为,氮添加会使叶片中碳水化合物含量显著降低[34].而本试验中氮添加后植物叶片和细根NSC含量与对照处理无显著差别,这可能是因为NSC生成量和消耗量趋于平衡[10].但氮添加和干旱交互处理后植物叶片NSC含量降低,这可能表明在干旱和氮添加交互处理下叶片NSC含量主要受到干旱的影响.有研究表明相对于养分元素,植物对土壤水分变化的敏感性更高,并且在土壤含水率降低情况下植物对氮的吸收能力会随之下降[20],从而导致氮添加和干旱交互处理后植物叶片NSC含量低于对照处理.可溶性糖、淀粉是光合作用同化产物,NSC含量也预示植物对抗逆境的能力.
有研究表明,随着干旱胁迫加剧,叶片NSC含量持续下降,并且幼苗趋向于将NSC分配到地下部分来应对干旱胁迫,从而导致根系NSC含量上升[35,36].本研究的两种植物在干旱处理后,叶片NSC含量低于对照组,但细根NSC无显著差异,可能是因为受到干旱胁迫后,植物NSC含量和总生物量的消耗大于合成,都呈现下降的趋势,而植物对光合同化产物的资源配置趋向于地下部分,保持根部活力以维持植物根系汲取水分的能量需求[17].
3.3 氮添加与干旱对两种植物挥发性有机碳释放的影响
氮添加通过对植物同化物的积累能够间接影响植物挥发性有机物释放[22].此外,植物气体交换主要与光合速率、气孔导度以及蒸腾速率等光合参数有关.本试验中氮添加能促进木荷与杉木的BVOC-C释放,可能是由于氮添加促进木荷与杉木幼苗的净光合速率,导致木荷与杉木幼苗气体交换能力增强,从而促进植物BVOC释放.干旱同样能影响植物气体交换,有研究表明短期干旱胁迫能改变植物挥发性有机物的释放[18],从而导致植物BVOC-C释放的改变.如Haberstroh et al[37]研究表明干旱促进地中海两种植物挥发性有机物的释放.本试验同样表明干旱处理一年能促进木荷与杉木幼苗BVOC-C释放通量,但无显著影响,这可能是由于干旱对杉木和木荷净光合速率的正效应导致.本研究中氮添加和干旱交互处理显著促进木荷BVOC-C释放,这可能是由于较高的净光合速率和气孔导度导致(表2).而氮添加和干旱交互处理对杉木BVOC-C的释放无影响,虽然氮添加和干旱交互处理促进杉木净光合速率,但是由于其气孔导度和蒸腾速率降低.因此杉木BVOC-C释放量减少可能是因为氮添加和干旱交互处理下的气体交换主要受气孔导度和蒸腾速率影响.
针叶和阔叶树种挥发性有机物释放数量和成分占比具有显著差异,有研究表明不同树种BVOC-C释放对氮沉降响应不同[26].在不同处理条件下植物挥发性有机物释放存在复杂的生理生态调节过程,不同树种BVOC-C释放的调节机制将更为复杂[38],其内在原因有待进一步研究.
4 结论
(1)氮添加显著增加木荷净光合速率和生物量,并使杉木总生物量增加;干旱显著降低木荷净光合速率和生物量,使杉木总生物量降低;而氮添加和干旱交互处理对木荷和杉木总生物量无明显影响.(2)氮添加分别使木荷叶片和细根可溶性糖含量显著增加和降低;干旱使杉木叶片可溶性糖和NSC显著降低;而氮添加和干旱交互处理对两种幼苗NSC含量无明显影响.(3)干旱以及氮添加对两种植物幼苗BVOC-C释放量均有一定的促进作用,但氮水交互处理则分别对木荷与杉木的BVOC-C释放量起促进和抑制作用,这可能是树种差异引起,其内在机制需要进一步研究.

