黄毛草莓FnbHLH68转录因子基因 和启动子的克隆及表达分析
白金慧, 张 萌, 姚立萍, 王 琳, 申亚茹, 时雅倩, 花秀凤, 陈清西, 文志丰
(1.福建农林大学园艺学院,福建 福州 350002;2.福州市农业科学研究所, 福建 福州 350018;3.福州市蔬菜科学研究所,福建 福州 350111)
草莓(FragariaananassaDuch.)为蔷薇科(Rosaceae)草莓属(Fragaria)多年生草本植物,是一种经济价值较高的小浆果,其栽培面积和产量始终居世界小浆果生产首位[1-2].在草莓的生产过程中,炭疽病是危害草莓生长的重要真菌病害,严重影响草莓的产量和品质.目前,草莓炭疽病防治以化学防治为主,但在实际应用中存在盲目用药和用药品种单一等弊端,导致防治效果不理想,而且长期使用化学药剂使炭疽菌的抗药性日渐增强,引起病害蔓延,因此培育抗病品种是防治草莓炭疽病的最有效途径[1-2].我国野生草莓资源丰富,其中,黄毛草莓(FragarianilgerrensisSchltdl. ex Gay.)是二倍体野生种,具有独特的果香和果色,生长健壮,抽生能力强,具有抗旱、抗寒和抗病性等特点[4-5].研究人员对黄毛草莓进行了田间自然发病率调查,并结合人工接种试验对黄毛草莓进行了炭疽病抗性评价,结果显示,黄毛草莓对炭疽病有较强的抗性[6-8].利用黄毛草莓对炭疽病抗性较强的特点,从中挖掘抗病基因并研究其抗病机理,将传统杂交育种与分子育种手段相结合,创新育种材料,是实现草莓抗性育种的有效途径.
植物碱性螺旋—环—螺旋(basic helix-loop-helix, bHLH)转录因子是植物第二大类转录因子,不仅参与植物的生长发育和生理代谢发育,还广泛参与调控免疫反应、抗逆反应和信号转导等生物学过程[9].bHLH家族成员有两个保守的结构域:碱性区域和螺旋—环—螺旋(helix-loop-helix, HLH)区域[10].目前已在葡萄(VitisviniferaLinn.)[11]、杜梨(PyrusbetulaefoliaBge)[12]和草莓[13]等园艺作物中鉴定出bHLH转录因子基因.Tai et al[14]研究了马铃薯(SolanumtuberosumLinn.)58个bHLH转录因子基因在接种疥疮链霉菌(Streptomycesscabies)后的表达模式,发现有3个bHLH基因参与了马铃薯对疮痂病的防御反应;Jung et al[15]通过对转录谱的分析,鉴定到一个番茄(LycopersiconesculentumMill)转录因子基因SlbHLH132在受到黄单孢菌(Xanthomonaseuvesicatoria)侵染后诱导表达,其转录激活受到黄单孢菌SUMO蛋白的调控;Yu et al[16]利用全基因组鉴定了本氏烟草(NicotianabenthamianaLinn.)NbbHLHs的基因家族,发现有28个候选NbbHLHs基因参与调控疫霉菌(Phytophthoranicotianae)的抗性;Cheng et al[17]研究表明,大豆[Glycinemax(Linn.) Merrill]bHLH转录因子基因GmPIB1可增强对疫霉菌(Phytophthoranicotianae)的抗性;尹欢[18]从葡萄中鉴定出110个bHLH基因,其中,VvbHLH039基因参与葡萄抗逆胁迫过程;He et al[19]研究表明,陆地棉(GossypiumhirsutumLinn.)GhJAZ2可通过抑制GhbHLH171基因的转录活性来减弱棉花对大丽轮枝菌(Verticilliumdahliae)的抗性,GhbHLH171基因在棉花中的过表达可激活茉莉酸(JA)的合成和信号通路,提高了植株对大丽轮枝菌的抗性.目前,从草莓中已鉴定出113个bHLH转录因子家族成员[20],如FabHLH17、FabHLH3、FvbHLH78-like、FabHLH78基因等,研究主要集中在基因表达以及参与草莓果实花青素合成等方面[20-22].关于bHLH转录因子参与草莓抗病的研究目前尚未见报道.
黄毛草莓对环境适应性强,并且具有抗高温、耐寒和抗叶部病害等特点[23].本课题组前期以黄毛草莓为材料,接种胶孢炭疽菌[Colletotrichumgloeosporioides(Penz.) Sacc]后,利用转录组测序技术从黄毛草莓中筛选到一个受胶孢炭疽菌诱导表达上调的bHLH基因,本研究克隆了该基因cDNA序列和启动子序列,进行了生物信息学分析,并构建了FnbHLH68基因过表达载体和基因沉默载体.利用实时荧光定量PCR技术分析了黄毛草莓叶片分别用胶孢炭疽菌和水杨酸处理后,FnbHLH68基因表达水平的变化.本研究为进一步探讨黄毛草莓FnbHLH68转录因子基因参与抗胶孢炭疽菌的分子机理提供了参考.
1 材料与方法
1.1 材料
黄毛草莓取自福建农林大学园艺学院教学实践基地.接种的胶孢炭疽菌菌株FZ-1由本实验室保存[23].
PCR Master Mix购于天根公司;限制性内切酶(BamHⅠ、KpnⅠ、XbaⅠ)、DNA Marker购于TaKaRa公司;氨苄青霉素(Amp)、卡那霉素(Kan)等购于生工生物工程(上海)有限公司,其他常规试剂均为分析纯.
RNAprep Pure Plant Kit多糖多酚RNA提取试剂盒、DNA Secure Plant Kit植物基因组DNA提取试剂盒、Universal DNA Purification Kit DNA纯化回收试剂盒、TIANprep Mini Plasmid Kit质粒小提试剂盒均购于天根公司;pMDTM20-T克隆载体购于TaKaRa公司;植物过表达载体pCAMBIA1300、0380:GUS和pTRV2载体均由本实验室保存.
用Primer Primer 5.0软件设计引物,由尚亚生物技术(福州)有限公司合成,引物信息如表1所示.

表1 FnbHLH68基因的扩增及定量引物序列Table 1 Amplification and sequence of quantitative primer of FnbHLH68 gene
1.2 样品处理
将黄毛草莓培养于植物培养箱内,温度控制在23~25 ℃,湿度设为85%.
胶孢炭疽菌菌株FZ-1在培养基上活化后放置培养箱(25 ℃)中培养15 d,用液体PDA培养基进行摇菌,3~5 d后进行集菌,用蒸馏水制成浓度为1×106个·mL-1的孢子悬浮液.将孢子悬浮液均匀喷洒在黄毛草莓叶片上,对照组喷洒蒸馏水.发病培养条件为:温度25 ℃、湿度85%、光周期为12 h光照∶12 h黑暗、光照强度125 μmol·m-2·s-1.取接种后0、6 、12 、24 、48 和72 h等时间段植株从上往下数的第3~5位叶片,置于冰箱(-80 ℃)中保存备用.
将100 μmol·L-1水杨酸(Sigma公司的分析纯)以喷雾的方式均匀喷施在草莓叶片上至有水滴滴下,对照组喷蒸馏水,取处理0、6、12 、24和48 h等时间段的叶片,置于冰箱(-80 ℃)中保存备用.
1.3 黄毛草莓FnbHLH68基因cDNA的克隆和生物信息学分析
分析胶孢炭疽菌侵染后的黄毛草莓转录组数据库,筛选到一条在病原菌侵染后表达量显著上调的Unigene序列,通过Primer Premier 5.0软件设计上游引物FnbHLH68-F(5′-ATGAATAGAGGTCATGTTTTACA-3′)和下游引物FnbHLH68-R(5′-TCACCTTGAAGGTAGGTTGGGCTG-3′).以胶孢炭疽菌侵染后不同时间段的黄毛草莓叶片cDNA混样为模板,反应体系25 μL,反应程序为:94 ℃预变性90 s;94 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸2 min,36个循环;72 ℃延伸10 min.PCR产物经1.2%琼脂糖凝胶电泳后,将回收的目的片段纯化后连接pMDTM20-T载体,转化到大肠杆菌DH5α中,菌液经PCR扩增验证后,挑选5个阳性克隆送至铂尚生物技术(福州)有限公司进行测序分析.在NCBI上进行开放阅读框分析和Blast同源比对;使用DNAMAN 7.0软件进行不同物种间bHLH68基因编码氨基酸序列的相似性比较及系统进化树的构建;使用ExPASy网站(https://web.expasy.org/protparam/)对FnbHLH68蛋白的理化性质进行预测;使用SOPMA在线工具(https://npsa-prabi.bcp.fr/cgi-bin/npsa_ automat.pl?page-npsa sopma.html)对FnbHLH68蛋白的二级结构进行预测.
1.4 黄毛草莓FnbHLH68基因过表达载体和基因沉默载体的构建
以含有FnbHLH68目的质粒为模板,设计带有BamHⅠ和XbaⅠ限制性酶切位点的上游引物FnbHLH68-OVER-F(5′-CGGGATCCCGATGAATAGAGGTCATGTTTTACA-3′)和下游引物FnbHLH68-OVER-R(5′-GCTCTAGAGCTCACCTTGAAGGTAGGTTGGGCTG-3′).PCR扩增产物经回收后进行BamHⅠ和XbaⅠ双酶切,同时进行pCAMBIA1300-HA-35S目标载体BamHⅠ和XbaⅠ双酶切.回收两者的酶切产物后用T4DNA连接酶进行连接,转化到大肠杆菌DH5α中,菌液经PCR扩增验证后提取质粒,利用BamHⅠ和XbaⅠ进行双酶切验证,挑取阳性克隆送至铂尚生物技术(福州)有限公司进行测序分析.
根据FnbHLH68序列的基因沉默区设计带有BamHⅠ和XbaⅠ酶切位点的基因沉默载体引物,以含有FnbHLH68基因的目的质粒为模板,PCR产物扩增回收后,利用BamHⅠ和XbaⅠ进行双酶切,同时进行基因沉默载体BamHⅠ和XbaⅠ双酶切.回收纯化两者的目的条带,采用T4DNA连接酶进行连接,转化到大肠杆菌DH5α中,菌液经PCR扩增验证后提取质粒,利用BamHⅠ和XbaⅠ进行双酶切验证,挑取阳性克隆送至铂尚生物技术(福州)有限公司进行测序分析.
1.5 黄毛草莓FnbHLH68基因启动子的克隆
以黄毛草莓基因组DNA为模板,利用森林草莓(FragariavescaLinn.)bHLH68的序列信息查找FnbHLH68启动子的同源序列.采用Primer Premier 5.0软件设计启动子扩增的上游引物P-FnbHLH68-F(5′-GTGGCCATTTTATCAACATGTGAG-3′)和下游引物P-FnbHLH68-R(5′-GCCTTAGTCTCCTGAACTTGGCTT-3′),进行PCR扩增,扩增程序为:94 ℃预变性90 s ;94 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸2 min,36个循环;72 ℃延伸 10 min.PCR产物经回收连接后,转化到大肠杆菌DH5α中,进行菌液PCR鉴定,阳性克隆送至铂尚生物技术(福州)有限公司进行测序分析.
1.6 黄毛草莓FnbHLH68基因实时荧光定量PCR检测
采用RNA试剂盒分别提取黄毛草莓叶片在胶孢炭疽菌胁迫0、6、12、24、48和72 h后的总RNA,水杨酸处理0、6、12、24 和48 h后的总 RNA以及相应对照组的总RNA,使用Prime Script®RT reagent Kit反转录试剂盒(大连TaKaRa公司)反转录合成cDNA用于实时荧光定量PCR检测.反应体系为:6.25 μL SYBR Premix ExTaqTM、上下游引物各0.5 μL、1 μL cDNA模板、4.25 μL无菌水.扩增程序为:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火30 s;循环40次.以草莓Actin基因(GenBank登录号:AB116565)为黄毛草莓内参基因,每个样品设3次生物学重复和技术重复.用2-△△CT方法分析FnbHLH68基因的相对转录水平[24],并用Excel 2010和SPSS 18.0软件进行数据分析.

A:FnbHLH68基因PCR扩增(1:FnbHLH68基因目的条带; M:DL5000 Marker);B:菌液阳性克隆PCR扩增验证(1~4:PCR扩增检测菌液阳性克隆;M:DL5000 Marker).图1 黄毛草莓FnbHLH68基因克隆及检测的电泳图谱Fig.1 Cloning and electrophoretogram of FnbHLH68 gene in F.nilgerrensis
2 结果与分析
2.1 黄毛草莓FnbHLH68基因的克隆和生物信息学分析
以黄毛草莓叶片总RNA反转录的cDNA为模板,扩增到一条长度大于1 000 bp的特异条带(图1).测序后显示该条带长度为1 161 bp,序列比对分析发现,克隆的序列与森林草莓bHLH68高度同源,命名为FnbHLH68 (GenBank登陆号:MN879282),其开放阅读框长1 161 bp,编码386个氨基酸(图2),在第243~287位氨基酸处有一个保守的HLH结构域,表明FnbHLH68基因属于bHLH基因家族成员.
使用ExPASy在线工具进行蛋白质预测分析的结果显示,该基因预测编码的蛋白质分子式为C1820H2836N532O577S18,分子质量约为41.98 ku,理论等电点(pI)约为6.92,蛋白质不稳定指数为69.26%,亲水系数为-0.589,因此预测该蛋白为不稳定的疏水蛋白.使用SOPMA在线工具对FnbHLH68蛋白进行二级结构预测,结果(图3)显示,无规则卷曲结构所占比例最大,为66.58%,其次分别是α-螺旋(23.83%)、延伸链(7.51%)和β-转角(2.07%).利用GenBank上公布的bHLH68基因编码的氨基酸序列,使用DNAMAN 7.0软件进行多物种间氨基酸序列的相似性比对.结果(图4)显示,FnbHLH68基因编码的氨基酸序列与森林草莓、月季(RosachinensisLinn.)、白梨(PyrusbretschneideriRehd.)、梅(PrunusmumeSieb.)、核桃(JuglansregiaLinn.)、欧洲栓皮栎(QuercussuberLinn.)、东京樱花(PrunusyedoensisMatsum.)、巴西橡胶(HeveabrasiliensisMuell.)和海棠(MalusdomesticaSchneid.)的相似性分别为98.45%、93.30%、70.40%、69.87%、69.85%、69.77%、69.62%、69.33%和69.33%.利用DNAMAN 7.0软件构建黄毛草莓FnbHLH68蛋白与同源蛋白的系统进化树,结果(图5)显示,黄毛草莓FnbHLH68基因编码的氨基酸与森林草莓、月季聚为一小类,亲缘关系最近,这三者均属于蔷薇亚科.

方框中的序列表示起始密码子和终止密码子;下划线部分表示HLH保守结构域.图2 黄毛草莓FnbHLH68核苷酸序列与推测的氨基酸序列Fig.2 Nucleotide sequence and predicted amino acid sequence of FnbHLH68 in F.nilgerrensis
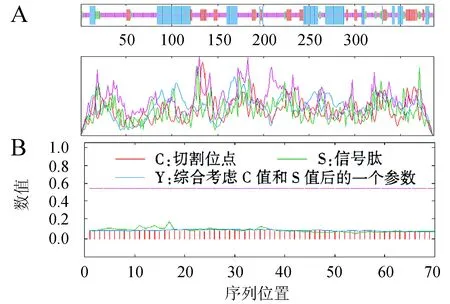
A:二级结构预测;B:信号肽结构预测.图3 黄毛草莓FnbHLH68蛋白的二级结构 预测和信号肽结构预测Fig.3 Predictions on secondary structure and peptide structure of FnbHLH68 protein in F.nilgerrensis
2.2 黄毛草莓FnbHLH68基因过表达载体和基因沉默载体的构建
以克隆测序正确的含FnbHLH68质粒为模板,设计带有BamHⅠ和XbaⅠ的过表达载体和基因沉默载体引物,通过PCR扩增获得1 161 bp的目的基因开放阅读框区和472 bp的基因沉默区(图6).回收后,分别与已用BamHⅠ和XbaⅠ双酶切的pCAMBIA1300-HA-35S和p-TRV2载体连接,转化到大肠杆菌DH5α中.菌液经PCR扩增验证后,提取阳性质粒利用BamHⅠ和XbaⅠ双酶切,送尚亚生物技术(福州)有限公司测序,成功构建植物过表达载体pCAMBIA1300-HA-35S-FnbHLH68和基因沉默载体pTRV2-FnbHLH68(图6).
2.3 黄毛草莓FnbHLH68基因启动子的克隆
以黄毛草莓DNA为模板,使用P-FnbHLH68-F(5′-GTGGCCATTTTATCAACATGTGAG-3′)和P-FnbHLH68-R(5′-GCCTTAGTCTCCTGAACTTGGCTT-3′)引物PCR扩增FnbHLH68启动子(命名为pFnbHLH68,GenBank登陆号:MW218450),测序结果(图7)显示,扩增得到的启动子长度为1 849 bp.使用PlantCare在线软件对序列进行预测(附件图Ⅰ,扫OSID码可见),发现启动子序列上除含有启动子的基本元件TATA-box和CAAT-box等以外,还存在着参与脱落酸响应的顺式作用元件ABRE、参与MeJA反应的顺式作用调节元件CGTCA-motif、参与愈伤调节元件WUN-motif以及参与光反应的G-box、BOX 4、I-box、TCT-motif、chs-CMAla和AE-box等元件,这些元件的存在表明黄毛草莓FnbHLH68启动子可能响应多种生物和非生物胁迫(表2).

FnbHLH68:黄毛草莓(Fragaria nilgerrensis Schltdl. ex Gay.)MK685675;FvbHLH68:森林草莓(Fragaria vesca Linn.)XP_011464892.1; HbbHLH68:巴西橡胶(Hevea brasiliensis Muell.)XP_021675294.1;JrbHLH68:核桃(Juglans regia Linn.)XP_018815054.1. 下划线部分表示HLH保守结构域.图4 黄毛草莓FnbHLH68基因编码的氨基酸与其他物种氨基酸的序列比较Fig.4 Comparison of homology amino acid sequences encoded by FnbHLH68 gene from F.nilgerrensis and other species

图5 黄毛草莓FnbHLH68蛋白与同源蛋白的系统进化树Fig.5 Phylogenetic tree of FnbHLH68 protein in F.nilgerrensis and homologous protein

A:FnbHLH68过表达载体的构建(1、2分别为BamHⅠ、XbaⅠ双酶切重组质粒;3、4分别为BamHⅠ、XbaⅠ酶切验证 pCAMBIA1300-HA-35S-FnbHLH68;M:DL5000 Marker);B::FnbHLH68基因沉默载体的构建(1、2分别为FnbHLH68 基因加入BamHⅠ、XbaⅠ酶切位点PCR扩增片段;3、4分别为BamHⅠ、XbaⅠ酶切重组质粒;5、6分别为 BamHⅠ、XbaⅠ酶切验证pTRV2-FnbHLH68-VIGS;M:DL5000 Marker).图6 黄毛草莓FnbHLH68基因过表达载体构建和基因沉默载体构建的电泳图谱Fig.6 Electrophoresis of the constructed overexpression vector and silencing vector for FnbHLH68 gene in F.nilgerrensis

1~2为FnbHLH68基因启动子PCR扩增;3~4为FnbHLH68启动 子菌液PCR阳性克隆验证;M:DL5000 Marker.图7 黄毛草莓FnbHLH68基因启动子克隆的电泳图谱Fig.7 Electrophoretogram of promoter of FnbHLH68 gene in F.nilgerrensis
2.4 不同处理下黄毛草莓FnbHLH68基因的相对表达量
黄毛草莓叶片接种胶孢炭疽菌后,采用实时荧光定量PCR检测FnbHLH68基因相对表达量的变化.结果(图8)显示:FnbHLH68基因响应胶孢炭疽菌的胁迫处理,在接种胶孢炭疽菌0~6 h后FnbHLH68基因的表达量逐渐升高,接种12 h后该基因的表达水平达到最高,为0 h的10.6倍,接种48 h后FnbHLH68基因的表达水平开始下降;接种12、24、48和72 h后的FnbHLH68基因转录水平均显著高于对照.表明黄毛草莓FnbHLH68基因的表达受胶孢炭疽菌诱导,可能参与黄毛草莓对炭疽病的防御反应.
用外源水杨酸处理黄毛草莓叶片后,分析水杨酸诱导后FnbHLH68基因的表达情况.结果(图9)显示:在水杨酸处理6、12、24和48 h后,FnbHLH68基因的表达量呈先上升后下降的趋势;处理12 h后的FnbHLH68基因表达量达到最高值,为0 h的11.5倍.表明水杨酸诱导黄毛草莓FnbHLH68基因的表达.

表2 黄毛草莓FnbHLH68基因启动子序列及顺式作用元件预测Table 2 Sequence and cis-acting elements prediction of FnbHLH68 gene promoter from F.nilgerrensis

附不同字母者表示在0.05水平上差异显著,附相同字母者表示在0.05水平上差异不显著.图8 黄毛草莓叶片接种草莓胶孢炭疽菌后FnbHLH68基因的相对表达量Fig.8 Relative expression of FnbHLH68 gene in leaves of F.nilgerrensis inoculated with C.gloeosporioides

附不同字母者表示在0.05水平上差异显著,附相同字母者表示在0.05水平上差异不显著.图9 黄毛草莓叶片用外源水杨酸处理后FnbHLH68基因的相对表达量Fig.9 Relative expression of FnbHLH68 gene in leaves of F.nilgerrensis treated with exogenous salicylic acid
3 讨论
转录因子是一类位于细胞核内,能够通过特定的氨基酸残基与靶基因启动子区域上的顺式反应元件相互作用,进而调控相关基因表达的蛋白质[25].大量研究表明,高等植物的转录因子在植物的生长发育、抗逆反应和次生代谢等方面都具有重要作用.bHLH家族转录因子是植物转录因子中很重要的一个家族,数量众多,其超家族的成员具有两个保守但功能不同的结构域,分别是氨基末端的基本DNA结合结构域(E-box)及羧基末端的HLH结构域,其中,HLH结构域赋予异源或同源二聚化蛋白质[26].本研究利用同源克隆技术,从野生黄毛草莓叶片中克隆到FnbHLH68基因cDNA序列,其编码的氨基酸包含一个HLH保守结构域.多物种间氨基酸序列相似性比对的结果显示,FnbHLH68氨基酸序列与森林草莓、月季氨基酸序列的相似性较高,这三者均属于蔷薇亚科,推测其蛋白功能也可能相近.克隆了FnbHLH68基因上游的启动子序列,进而分析发现启动子序列含有激素响应元件MeJA、愈伤调节元件WUN-motif以及参与光反应的G-box等多种类型的顺式作用元件,对研究启动子转录活性有很大的帮助.
植物在应答生物或非生物胁迫时,转录因子调控基因在转录水平上发生转录重排并诱导下游某些防御反应,bHLH转录因子作为植物中最大的转录因子家族成员之一,在植物受到逆境胁迫时起着重要的调控作用[18].本课题组前期研究表明,野生黄毛草莓接种胶孢炭疽菌6 h后,FnbHLH68转录因子基因表达上调,表明该基因可能参与对炭疽病抗性的调控;马达[27]研究表明,拟南芥bHLH转录因子基因HFR1参与对丁香假单胞杆菌(Pseudomonassyringae)抗性的调控;Wang et al[28]研究表明,小麦bHLH转录因子基因TabHLH060增强了转基因拟南芥对丁香假单胞杆菌的敏感性;Wang et al[29]研究表明,番茄SlbHLH131基因参与对黄叶卷曲病毒抗性的调控;Cheng et al[17]研究表明,大豆bHLH转录因子基因GmPIB1可增强大豆疫霉菌的抗性;薛宝平[30]研究表明,辣椒在接种青枯菌(Pseudomonassolanacearum)1 h后,CabHLH94基因转录表达开始显著上调,6 h后达到最大值,此外还可被外源激素水杨酸、脱落酸、MeJA、乙烯和芸苔素内酯诱导上调,转基因辣椒对青枯菌的侵染起到了抗病性作用;高敏[31]在葡萄上接种黑痘病病原菌(Sphacelomaampelinum)后,有7个VvbHLH基因在抗黑痘病毛葡萄‘商-24’和感黑痘病的‘红地球’中表达上调,在接种白粉菌(Erysiphenecator)后,有13个VvbHLH基因在毛葡萄‘商-24’中表达上调;本研究在黄毛草莓上接种胶孢炭疽菌后,FnbHLH68基因的表达水平均显著高于对照组,接种12 h后的表达水平最高,为对照组的10.6倍,接种24 h后的表达水平逐渐下降,推测该基因可能参与抗炭疽病反应.
水杨酸在植物防卫信号传导中起着重要作用,其介导的信号途径与植物抗性密切相关,是激活植物超敏反应和系统获得抗性的内源信号分子[32].杨金华[33]利用外源激素水杨酸处理‘富士’苹果幼苗后,MdbHLH050基因表达下调,15个bHLH基因表达上调,推测这些bHLH基因受水杨酸信号调控;周宏骏等[34]研究表明,丹参幼苗用水杨酸处理后,SmbHLH93基因的表达开始受到了明显的抑制,处理24 h后其表达量有所升高,但仍显著低于对照;韩永涛等[35]采用水杨酸处理茶树品种‘陕茶一号’后,CsbHLH2基因受水杨酸诱导表达,处理12 h后的表达量达到最高.上述研究结果表明,bHLH基因可以被水杨酸诱导表达.本研究用水杨酸处理黄毛草莓叶片后,FnbHLH68基因的表达水平整体上比无菌水处理的对照组高,处理12 h后的表达水平达到最高,是对照组的11.5倍.推测FnbHLH68基因可能通过水杨酸信号途径参与对炭疽病抗性的调控.

