NLRP3炎症小体介导单核细胞增生李斯特菌感染小鼠和巨噬细胞的细胞焦亡
袁琳, 朱昱蓉, 林琳, 黄霜, 姜旭淦, 陈盛霞
(江苏大学医学院,江苏 镇江 212013)
单核细胞增生李斯特菌(Listeriamonocytogenes,Lm)是一种重要的人兽共患食源性病原,被WHO列为四大食源性病原菌之一。免疫力低下的人群(如老人、婴幼儿、孕妇等),Lm感染会造成致命的脑膜炎、败血症,孕妇早产、流产、死胎等[1],死亡率可高达20%~30%,危害很大,已成为一种全球性疾病。
研究发现,炎症小体和细胞焦亡与多种感染性疾病、神经系统疾病、代谢性疾病以及心血管疾病等密切相关[2]。细胞焦亡是细胞程序性死亡机制中的一种特殊方式,主要通过炎症小体介导包含半胱氨酸的天冬氨酸蛋白水解酶1(caspase-1)在内的多种caspase的激活,造成包括消化道皮肤素D(gasdermin D,GSDMD)在内的多种gasdermin家族成员发生剪切和多聚化,表现为GSDMD前体蛋白(pro-GSDMD)剪切,释放氨基端裂解片段(GSDMD-NT),造成细胞穿孔,进而引起细胞死亡。相比于细胞凋亡,细胞焦亡发生得更快,并会伴随着大量促炎症因子的释放。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体是目前研究较为透彻的炎症小体之一,由NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和caspase-1三部分组成,可以被多种微生物、内源性危险信号和环境刺激物激活[3]。MCC950是针对NLRP3炎症小体的特异性抑制剂,主要通过改变NLRP3的构象来抑制炎症小体的形成[4]。目前,炎症小体对Lm感染引起的免疫调控机制仍不清晰。本研究通过体内和体外实验,检测Lm感染C57B/6小鼠和人急性单核细胞白血病细胞系(human acute monocytic leukemia cell line,THP-1)源巨噬细胞的细胞焦亡及相关炎症小体的表达水平,并通过NLRP3炎症小体抑制剂MCC950来探讨NLRP3炎症小体在Lm感染过程中的作用。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞与实验动物 单核细胞增生李斯特菌EDG株由天津医科大学申艳娜教授惠赠,THP-1细胞购于中科院上海细胞库,5~6周龄雌性C57B/6小鼠购于江苏大学动物实验中心。
1.1.2 主要试剂 RPMI 1640培养基及胎牛血清(以色列BI公司);脑心浸出液肉汤(BHI,北京路桥技术股份有限公司);实时荧光定量PCR(qRT-PCR)所用引物由上海生工合成;Trizol试剂、逆转录试剂(南京诺唯赞公司);LPS、ATP(美国Sigma公司);人IL-1β ELISA 试剂盒(杭州联科生物公司);NLRP3 抗体(美国Abcam公司);ASC抗体(美国Santa Cruz公司);caspase-1前体蛋白(pro-caspase-1)、IL-β前体蛋白(pro-IL-β)、caspase-1裂解片段蛋白20(caspase-1 p20)和IL-1β裂解片段蛋白17(IL-1β-17)抗体(沈阳万类公司),GSDMD抗体(美国CST公司);HRP标记的羊抗兔和羊抗小鼠二抗(北京康为世纪公司);Alexa Fluor488羊抗小鼠荧光二抗(南京福麦斯公司);CoraLite594羊抗兔荧光二抗(武汉Proteintech公司);MCC950(美国MCE公司)。
1.1.3 主要仪器 二氧化碳细胞培养箱、紫外分光光度计(美国Thermo Fisher公司);PCR仪(上海天能公司);qRT-PCR StepOne Plus(美国ABI公司);电泳仪(美国Bio Rad公司);荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 Lm培养 挑取Lm单个菌落接种于BHI培养基中,37 ℃ 200 r/min于恒温空气浴摇床培养16 h,在无菌条件下离心去除BHI培养液,并用PBS清洗2次,使用分光光度计调整细菌悬液光密度至D(600 nm)=1,此时对应细菌浓度约为1×109CFU/mL,用于后续实验。
1.2.2 Lm感染C57B/6小鼠及组织蛋白提取 C57B/6小鼠随机分为Lm感染组(Lm组)和阴性对照组(NC组),每组3只,分别经尾静脉注射等体积Lm菌液(5×104CFU/只)及无菌PBS,24 h后断颈处死,收集小鼠脾脏、肝脏和脑组织,用组织蛋白提取试剂盒提取蛋白。
1.2.3 THP-1细胞培养及THP-1源巨噬细胞诱导 THP-1细胞用含10%胎牛血清RPMI 1640培养基在5% CO2,37 ℃恒温培养箱中常规培养,细胞密度达到约90%时,1 ∶3进行传代。取6代以内状态良好的细胞,用佛波酯(100 ng/mL)诱导THP-1细胞分化为巨噬细胞,诱导时间为48 h。
1.2.4 Lm感染THP-1源巨噬细胞 体外实验包括Lm组、NC组、LPS+ATP组(阳性对照组)、Lm+MCC950组(感染+抑制剂组)和LPS+ATP+MCC950组(阳性对照+抑制剂组)。用6孔或24孔板培养细胞,每孔加入1×106个或2×105个THP-1源巨噬细胞。Lm组按感染复数(multiplicity of infection,MOI)=10接种Lm于细胞中,孵育1 h后加入10 μL庆大霉素杀胞外菌,杀菌1 h后换无抗生素培养基继续培养。NC组加等体积PBS。LPS+ATP组先加100 ng/mL LPS,3 h后再加5 mmol/L ATP孵育30 min,吸弃培养基加入新培养基继续培养。Lm+MCC950组和LPS+ATP+MCC950组均先加40 μmol/L MCC950抑制剂于细胞中,2 h后分别进行细菌刺激或阳性对照刺激。从加入Lm开始记为0 h,于6 h和24 h收集细胞培养上清用于ELISA检测;0 h、1 h、3 h和6 h收集细胞用于qRT-PCR检测,3 h收集细胞用于蛋白质印迹法及免疫荧光检测。
1.2.5 qRT-PCR检测细胞NLRP3、ASC、caspase-1、IL-1β、IL-18的mRNA表达 加入Trizol试剂裂解细胞,按照说明书提取总RNA,逆转录后采用SYBR Green Ⅰ染料法进行定量PCR。引物序列如下,内参GAPDH:上游5′-GAAGGTCGGAGTCAACGGAT-3′,下游5′- CTGGAAGATGGTGATGGGATT-3′,扩增产物169 bp。NLRP3:上游5′-GCTGCGATCAACAGGCGAGAC-3′,下游5′-AAGGCTGTCCTCCTGGCATACC-3′,扩增产物108 bp。ASC:上游5′-CTCAAGAAGTTCAAGCTGAAGC-3′,下游5′-TAGGTCTCCAGGTAGAAGCTG-3′,扩增产物134 bp。Caspase-1:上游5′-GAAGAAACACTCTGAGCAAGTC-3′,下游5′-GATGATGATCACCTTCGGTTTG-3′,扩增产物112 bp。IL-1β:上游5′-ACAGTGGCAATGAGGATGAC-3′,下游5′-AGGTGCATCGTGCACATAAG-3′,扩增产物311 bp。IL-18:上游5′-ACAGTGGCAATGAGGATGAC-3′,下游:5′-AGGTGCATCGTGCACATAAG-3′,扩增产物121 bp。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,共40个循环。分析基因扩增的平均Ct值,以GAPDH为内参,按照公式2-ΔΔCt进行相对定量计算。
1.2.6 ELISA检测细胞上清液中IL-1β含量 收集处理后的THP-1源巨噬细胞上清液,按照说明书进行操作,绘制标准曲线并计算出标本浓度。
1.2.7 蛋白质印迹法检测小鼠和细胞炎症小体及焦亡蛋白表达 试剂盒提取小鼠组织蛋白,常规方法提取细胞总蛋白,甲醇-氯仿浓缩细胞上清蛋白,各样本蛋白浓度调整一致后,进行SDS-PAGE约2 h,然后350 mA、90 min将蛋白转移至PVDF膜,用含5%脱脂牛奶的TBST室温封闭2 h,一抗(GAPDH 1 ∶2 000,NLRP3 1 ∶1 000,ASC 1 ∶100,pro-IL-β 1 ∶1 000,pro-caspase-1 1 ∶500,IL-1β-17 1 ∶300,caspase-1 p20 1 ∶500,GSDMD 1 ∶1 000)4 ℃孵育过夜,TBST洗膜,用相应HRP标记二抗(羊抗小鼠1 ∶3 000,羊抗兔1 ∶2 000)室温孵育1 h,TBST洗膜,ECL曝光液曝光,拍照记录结果。Image J软件进行蛋白灰度扫描分析。
1.2.8 免疫荧光检测ASC斑点及与NLRP3的共定位 24孔板内放置细胞玻片,每孔2×105个细胞,按MOI=10接种Lm 3 h后,加4%多聚甲醛室温固定20 min,0.5% Triton X-100 4 ℃下透膜5 min后,用含5% BSA的PBS室温封闭1 h,一抗(NLRP3 1 ∶100,ASC 1 ∶50)4 ℃孵育过夜,二抗(羊抗小鼠1 ∶250,羊抗兔1 ∶250)37 ℃孵育1 h。DAPI 1 ∶300稀释,染核5 min,荧光淬灭剂封片,荧光显微镜下观察并拍照。
1.3 统计学分析
2 结果
2.1 Lm感染C57B/6小鼠和THP-1源巨噬细胞均发生焦亡
蛋白质印迹结果显示,与NC组比较,Lm组小鼠脾、肝、脑组织以及THP-1细胞GSDMD蛋白表达水平均明显增高(P<0.05),且出现GSDMD-NT,见图1。
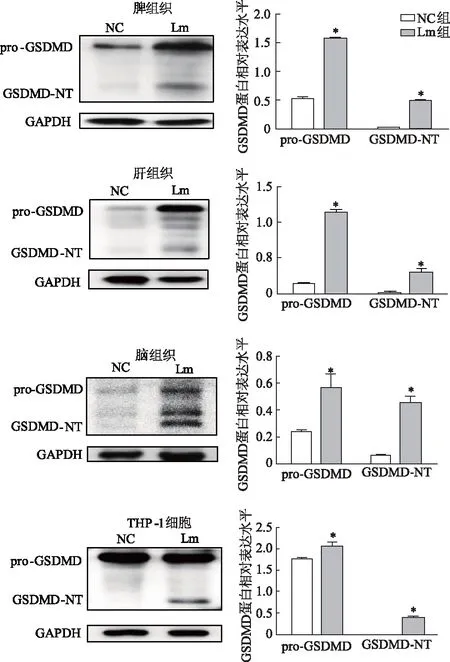
*:P<0.05,与NC组比较
2.2 Lm感染C57B/6小鼠激活靶器官NLRP3炎症小体
蛋白质印迹结果显示,与NC组比较,Lm组小鼠脾、肝、脑组织NLRP3炎症小体相关蛋白NLRP3、pro-caspase-1、pro-IL-1β及裂解片段caspase-1 p20、IL-1β-17蛋白表达量均明显升高(P<0.05),见图2。
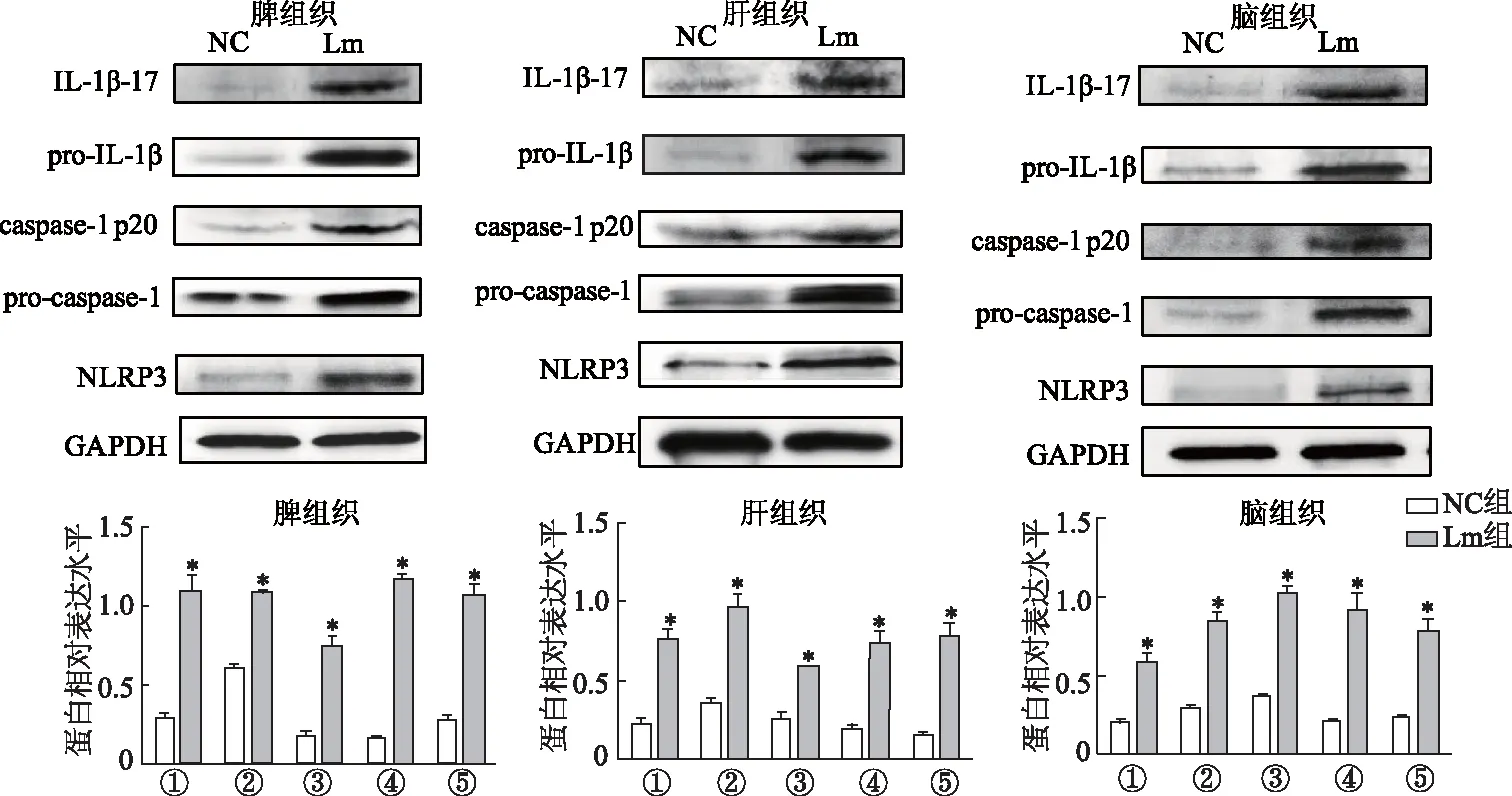
①:NLRP3蛋白;②:pro-caspase-1蛋白;③:caspase-1 p20蛋白;④:pro-IL-1β蛋白;⑤:IL-1β-17蛋白;*:P<0.05,与NC组比较
2.3 Lm感染THP-1源巨噬细胞激活NLRP3炎症小体
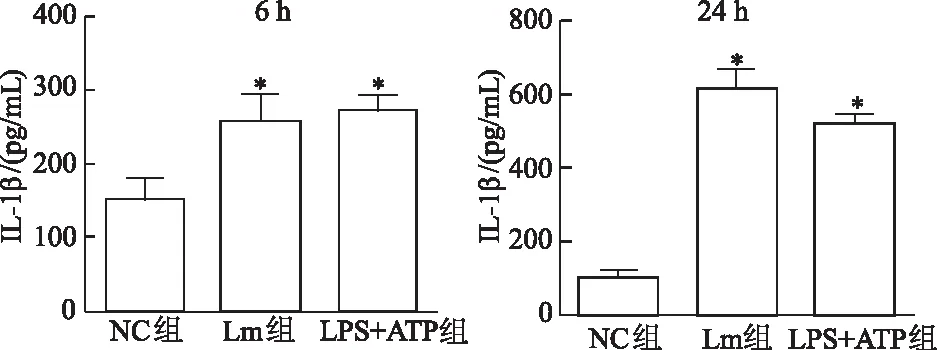
qRT-PCR结果显示,Lm感染1 h、3 h、6 h后NLRP3、caspase-1、IL-1β、IL-18mRNA表达量均较0 h呈上升趋势(P<0.05),且3 h升高最明显,而ASCmRNA表达量变化不明显,见图3。收集6 h和24 h培养上清液,ELISA检测结果显示,Lm感染组及阳性对照组6 h和24 h IL-1β表达水平均升高(P<0.05),见图4。

*:P<0.05,与0 h比较
*:P<0.05,与NC组比较
蛋白质印迹结果显示,Lm感染组及阳性对照组细胞裂解液中NLRP3、pro-caspase-1、pro-IL-1β蛋白表达量较阴性对照组明显升高(P<0.05);ASC略微升高,但差异无统计学意义;细胞上清液中出现pro-caspase-1及pro-IL-1β的活化裂解片段caspase-1 p20及IL-1β-17,见图5。免疫荧光染色结果显示,Lm感染后有明显的ASC斑点形成,细胞中有炎症小体的激活,同时ASC蛋白与NLRP3蛋白存在共定位,表明激活的是NLRP3炎症小体。Lm组结果与LPS+ATP组一致,见图6。
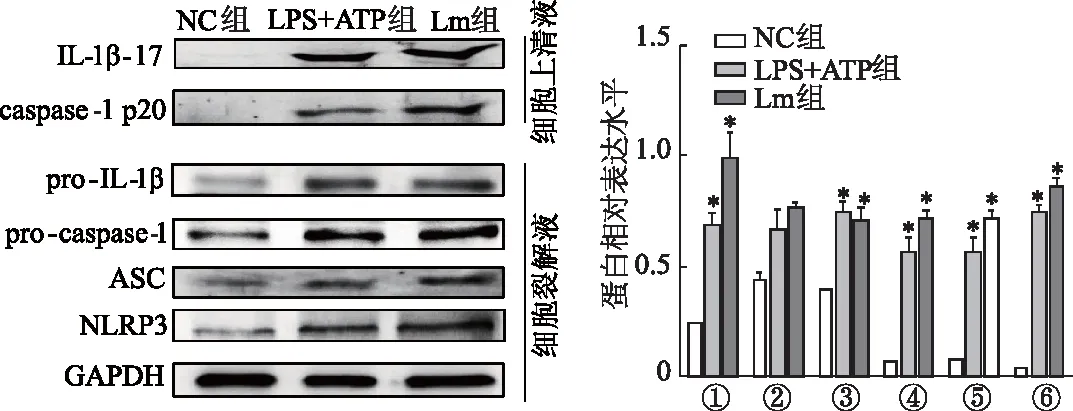
①:NLRP3蛋白;②:ASC蛋白;③:pro-caspase-1蛋白;④:pro-IL-1β蛋白;⑤:caspase-1 p20蛋白;⑥:IL-1β-17蛋白;
2.4 MCC950抑制剂处理后细胞焦亡减少
特异性抑制剂MCC950处理后,蛋白质印迹结果显示,与Lm组比较,Lm+MCC950组裂解片段GSDMD-NT明显减少(P<0.05),总片段pro-GSDMD基本不变;与LPS+ATP组比较,LPS+ATP+MCC950组GSDMD-NT明显也减少(P<0.05),pro-GSDMD基本不变,见图7。
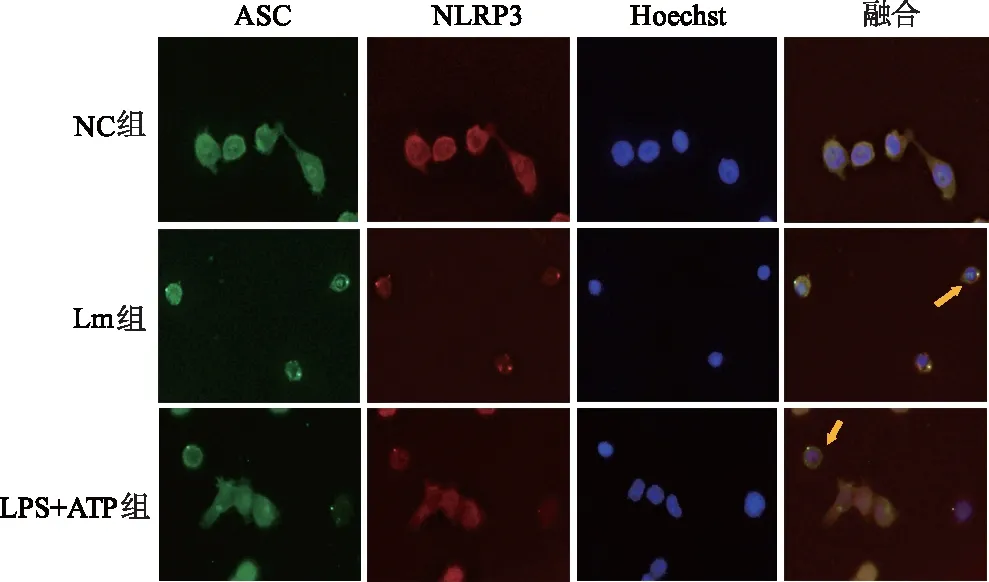
DAPI(蓝)染细胞核,FITC(绿)染ASC,TRITC(红)染
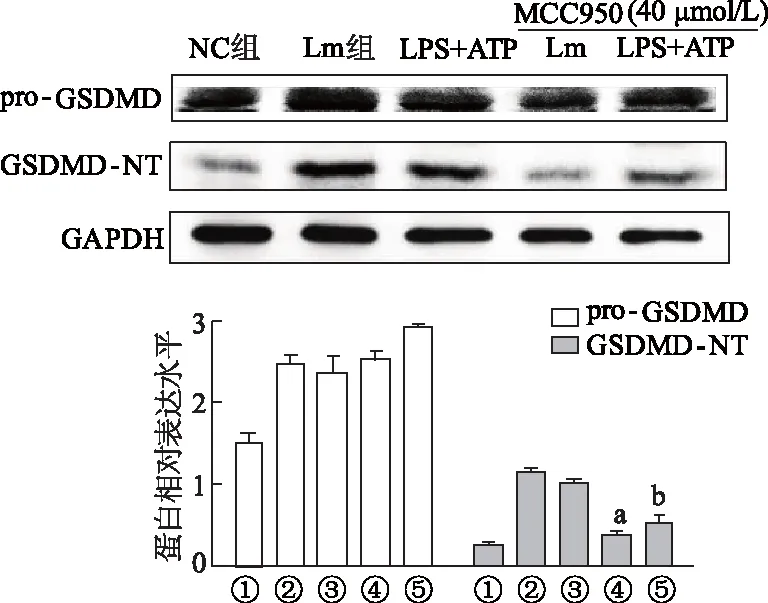
①:NC组;②:Lm组;③:LPS+ATP组;④:Lm+MCC950组;⑤:LPS+ATP+MCC950组;a:P<0.05,与Lm组比较;b:P<0.05,与LPS+ATP组比较
3 讨论
细胞焦亡可通过诱导宿主细胞死亡,将细菌从细胞内的复制生态位中驱逐出去[5-6],或通过直接的抗菌作用来减少细胞内的细菌数量,是细胞内细菌清除的有效机制[2]。这一过程调节宿主对病原体的防御,但另一方面,过度的炎症小体激活及细胞焦亡可诱导严重的炎症反应,引起组织器官损伤,导致宿主死亡。NLRP3炎症小体作为先天免疫的重要成分,通过激活caspase-1加工分泌成熟的促炎因子IL-1β、IL-18[7],在细胞焦亡中发挥重要作用[8]。感染猪链球菌流行株导致的链球菌中毒性休克样综合征(STSLS)中,NLRP3炎症小体被证实发挥了重要作用,使用MCC950抑制剂及NLRP3基因敲除鼠,小鼠STSLS症状明显缓解[9]。NLRP3炎症小体在感染过程中可以被病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)激活,但损伤相关分子模式(danger-associated molecular patterns,DAMPs)的慢性激活对宿主是有害的。已有研究表明,在致死性甲型流感病毒感染的不同阶段,阻断NLRP3的激活可能具有保护作用,也可能是有害的[10]。目前大多数研究仅基于体外实验证明NLRP3炎症小体在Lm感染的巨噬细胞中具有清除细菌的作用,表明Lm感染可诱导caspase-1介导的巨噬细胞死亡[11],激活多种炎症小体[12-15]。但具体哪一种炎症小体发挥主要作用尚无定论,争议集中在NLRP3和AIM2两者之中[16-17],并且大多仅仅基于巨噬细胞体外模型的研究,对体内感染的研究较少。
本研究表明,Lm感染小鼠及巨噬细胞后均会引起细胞焦亡,且NLRP3炎性小体在细胞焦亡中发挥了重要的作用。Lm感染巨噬细胞后能诱导IL-1β的产生和分泌,ASC斑点的形成,及裂解片段caspase-1 p20、IL-1β-17的释放,充分证明了NLRP3炎症小体的激活。同时,在体内感染模型中,Lm感染的主要靶器官,脾、肝、脑组织均检测到NLRP3炎症小体的激活以及焦亡的发生。NLRP3炎症小体特异性抑制剂MCC950能够抑制Lm诱导的细胞焦亡。
本研究中GSDMD抗体能够同时检测出总片段和剪切后的活性片段,在小鼠组织中pro-GSDMD表达升高,同时发生剪切,产生具有活性的GSDMD-NT蛋白;而在THP-1巨噬细胞中,仅GSDMD-NT发生变化,这可能与THP-1巨噬细胞系有关,THP-1细胞经佛波酯诱导贴壁后,激活了某些炎症通路,导致本底偏高,因此在Lm感染和MCC950加入后总蛋白表达变化不明显。另外,由于ASC主要通过寡聚化聚合使炎症小体激活,其表达量的变化与炎症小体无直接联系;炎症小体是否激活主要看ASC斑点是否形成,对ASC蛋白表达的检测不是必需的,因此未在小鼠组织中检测ASC蛋白表达。
Lm是一种可穿越血肠屏障、血胎屏障、血脑屏障的病原菌,而NLRP3作为该菌的主要传感器之一,可能在单核细胞增生李斯特菌相关的流产[18]、脑膜炎[19]、败血症等病理过程中发挥重要作用。对细胞焦亡及炎症小体的深入研究,有助于更好地了解李斯特菌病的发生发展机制,特异性抑制剂MCC950的作用提示NLRP3可作为李斯特菌病治疗新靶点。

