低温干馏煤气 /富氧大当量比燃烧热力学分析*
任萌萌 赵俊学 邹 冲 何江永 张 红
(西安建筑科技大学冶金工程学院,710055 西安)
0 引 言
低温煤干馏是目前陕西、宁夏、内蒙古、新疆等地广泛应用的一种低变质煤分质综合利用技术[1-2],年产能已突破1.3亿t。内热式直立炉是现行低温煤干馏工艺采用的一种主要炉型,利用煤气和空气燃烧产生高温烟气作为干馏过程的内热源,导致空气中的氮气大量混入煤气产品中(氮气体积分数高达50%以上),造成低温干馏煤气“量大质低”,难以实现煤气的高附加值利用。富氧低温煤干馏技术[3-4]利用富氧代替空气与煤气燃烧作为干馏过程内热源,同时增大入炉煤气量(即提高燃料当量比),可以在维持炉内温度基本不变的前提下,有效降低煤气中的氮气含量,提高煤气利用价值,展现出良好的应用前景。
富氧低温煤干馏中,随着燃料当量比增大,入炉煤气在炉内发生不完全燃烧,煤气中CO,H2和CH4等可燃组分间存在氧化剂竞争关系,各组分参与反应的程度直接影响其产生干馏介质的温度和成分,明确该过程中反应温度及产物分布规律具有重要意义。热力学分析是研究复杂反应系统的一种有效手段[5-14]。谢华清等[5]对焦炉荒煤气中焦油组分的蒸汽重整制氢反应进行了热力学分析,获得了温度、压力和初始组分等对氢气产率的影响规律。邱朋华等[11]对准东煤合成气的生产系统进行了热力学分析,获得了氧碳物质的量比和气化剂水蒸气比等操作参数对合成气产出率的影响。马苗等[13]对合成气、焦炉煤气和煤热解气三种不同原料气的甲烷化制天然气过程进行了热力学分析,获得了温度、压力和原料气组成对甲烷产率的影响。
目前,针对低温干馏煤气富氧大当量比燃烧过程的热力学研究较鲜见。本研究以富氧低温煤干馏中的典型工况为研究对象,通过热力学分析方法,探究在氧化剂不足的情况下,煤气中不同可燃组分的选择性燃烧机理及其对产物组成和绝热火焰温度的影响,并分析不同氧化剂稀释介质及当量比对该过程的影响机制。以期为富氧低温干馏技术的工艺参数调节提供参考。
1 研究方案
本实验结合简明分析法和最小吉布斯自由能法两种方法展开分析。简明分析法通过对比各反应在不同温度下的标准吉布斯自由能变,判断各反应发生的优先级及其随温度变化的规律。最小吉布斯自由能法借助Chemkin软件,充分考虑体系中各组分分压及化学平衡,计算反应体系的热力学平衡状态。研究选用典型富氧低温煤干馏条件[4]下的煤气组分摩尔分数比(xH2∶xCH4∶xCO∶xN2=46∶17∶30∶7)和燃料当量比(8.42,当量比按照燃料完全燃烧所需的氧气量除以体系中初始氧气量计算得到),在恒温和绝热两种条件下,分别研究反应温度、稀释剂成分、物质的量比和当量比对反应体系平衡状态的影响规律,并结合简明分析法得到的各反应发生条件及优先级对其影响机制加以分析。各研究工况条件如表1所示。下面对两种分析方法分别进行详细阐述。

表1 最小吉布斯自由能法各工况条件Table 1 Analyzed conditions by minimum Gibbs free energy method
1.1 简明分析法
根据化学反应热力学简明分析法则,多组分反应体系中,标准吉布斯自由能变越小(负值的绝对值越大)的反应,其反应的优先级越高。对于CO,H2和CH4三种燃料,分别考察它们与1 mol氧气的反应方程式:

(1)

(2)

(3)
计算各反应的吉布斯自由能变:
ΔG=ΔH-TΔS
(4)
式中:ΔG,ΔH,ΔS分别为反应的标准吉布斯自由能变(J/mol)、焓变(J/mol)和熵变(J/(mol·K));T为温度,K。根据反应方程式,由各反应物及产物的比焓和比熵计算得到。每种组分的比焓跟比熵是温度的函数,由多项式计算得到:
(5)
(6)
式中:H,S分别为比焓(J/mol)和比熵(J/(mol·K)),R为通用气体常数,8.314 J/(mol·K);a1~a7为热力学参数拟合系数,本研究采用GRI3.0燃烧机理中的热力学文件作为a1~a7的数据来源。
1.2 最小吉布斯自由能法
最小吉布斯自由能法是依据元素守恒,寻求系统中各组分吉布斯自由能之和最小的状态,即为系统中各组分间化学反应达到平衡的状态,是一种准确求解复杂反应系统平衡状态的方法。本研究采用Chemkin-Ⅱ[15]中的平衡计算模块来实现最小吉布斯自由能平衡状态的求解,反应体系考虑GRI3.0燃烧机理中涉及的53种组分(包括CH4,H2,CO,CO2,H2O和O2等主要组分,O,H,OH,CH和HO2等自由基组分,C2,C3和NOx生成相关组分)。反应体系吉布斯自由能之和计算式如下:
G=∑(hk-T(Sk-Rlnxk))xk
(7)
式中:hk,Sk,xk分别为组分k的比焓(J/mol),比熵(J/(mol·K))和摩尔分数。本实验用到的最小吉布斯自由能法包括在给定反应温度和压力下计算平衡组分,以及在等压和等焓条件下考虑系统能量守恒计算平衡组分和平衡温度两种模式。本研究所有工况的计算压力均为常压(0.1 MPa)。
2 结果与讨论
2.1 选择性燃烧分析
图1所示为计算得到的CH4,CO,H2分别与1 mol O2完全燃烧反应的标准吉布斯自由能变随温度的变化。其中,298 K下的标准吉布斯自由能变与文献[16-17]中的数值一致,验证了本研究计算结果的可靠性。比较三个反应在不同温度下的吉布斯自由能大小可以得出:当T<849 K时,各组分与氧完全燃烧反应的优先级由大到小为CO,H2,CH4;当849 K

图1 CH4,CO和H2完全燃烧的标准吉布斯自由能变Fig.1 Standard Gibbs free energy change of complete combustion of CH4, CO and H2
采用最小吉布斯自由能法计算不同反应温度下,典型富氧低温煤干馏煤气/纯氧在典型当量比条件[4]下的平衡组分分布,结果如图2所示。其中煤气组分的xH2∶xCH4∶xCO∶xN2=46∶17∶30∶7,燃料当量比为8.42。同时,也计算了初始温度为300 K时,考虑反应体系能量守恒(即绝热条件)的平衡组分,对应的平衡温度为974 K,结果也示于图2。由图2可知,当反应温度为500 K时,平衡组分中几乎没有H2和CO。当反应温度逐渐升高(700 K~1 500 K),平衡组分中xCO和xH2逐渐增大,xCH4逐渐减小。当温度到1 100 K以上时,平衡组分中几乎没有甲烷存在。这一结果与简明分析结果(CO在低温下优先和氧反应,而高温下甲烷与氧反应的优先级最高)相符,CO在低温下优先和氧反应,而高温下甲烷与氧反应的优先级最高。SIANG et al[14]研究的甲烷部分氧化平衡组分随温度的变化也与这一结果相一致。

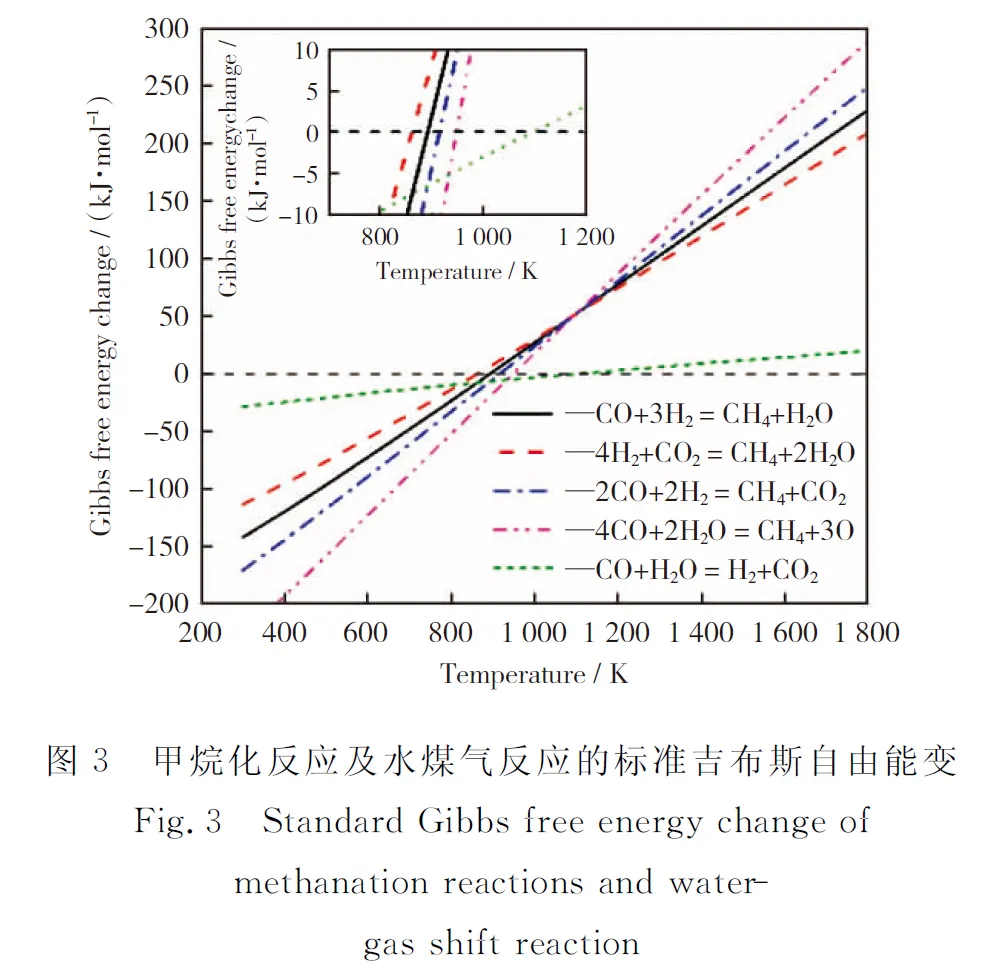
值得注意的是,在燃料当量比为8.42的条件下,反应体系中的氧气只够与煤气中部分CO完全燃烧,而反应温度在500 K时平衡组分中几乎不存在H2和CO,这说明除了部分燃烧反应外,体系中还发生了很大程度的甲烷化反应,可能包括以下反应[13]:

(8)

(9)

(10)

(11)
图3所示为上述四种反应的标准吉布斯自由能变。由图3可以看出,在反应温度为500 K时,各反应均可以自发进行。随着温度升高,各反应的标准吉布斯自由能变增大,到800 K以上时,逐渐无法自发进行。同样,在反应温度大于1 100 K时,体系中的氧气只够与部分甲烷反应,其余的甲烷发生重整反应生成CO和H2(即为图3各反应的逆反应,在高温条件下自发进行)。

2.2 绝热火焰温度
目前,对于煤气富氧大当量比燃烧的绝热火焰温度计算有以下几种方法:1) 假设煤气中各可燃组分与氧反应的先后顺序,列出全局反应方程式计算反应放热;2) 假设煤气中各组分按照其初始比例与氧气进行反应,列出全局反应方程式计算反应放热;3) 基于最小吉布斯自由能法,计算绝热条件下平衡温度即为绝热火焰温度。针对当量比为8.42的典型富氧低温干馏煤气/纯氧燃烧工况(反应体系初始组分的物质的量比为nH2∶nCH4∶nCO∶nN2∶nO2=0.424∶0.157∶0.276∶0.064∶0.079),三种方法的计算结果如表2所示。由表2可以看出,在不同燃烧顺序假设下,由于各燃料热值差异,导致绝热火焰温度相差在400 K左右。由最小吉布斯自由能平衡计算得到的绝热火焰温度最低,仅为974.3 K。

表2 不同选择性燃烧假设下的反应方程及绝热火焰温度Table 2 Global reaction equation and adiabatic flame temperature at different selective reaction assumptions
从全局化学反应方程式可以看出,整个反应过程包括甲烷的部分氧化和重整产氢,其中甲烷重整反应为吸热反应,这是导致绝热火焰温度降低的主要原因。不同选择性燃烧假设下绝热火焰温度的差值最高可达550 K以上,这主要是由于在大当量比条件下,氧化剂不足以氧化所有燃料,剩余燃料间发生重整反应,随着当量比的降低,这一现象将逐渐消失。最小吉布斯自由能法计算的平衡温度理论上可以反映实际绝热火焰温度的大小,但考虑到1 000 K以下时甲烷重整反应可能进行较为缓慢,能否到达平衡状态还需进一步借助反应动力学加以研究。富氧低温干馏工业试验中测得的火道出口处温度在900 K~1 000 K左右,与平衡计算结果基本相符。
2.3 氧化剂稀释的影响


图4 当量比8.42时氧化剂稀释比对平衡组分及平衡温度的影响Fig.4 Effect of dilution fraction on equilibrium species and temperature at equivalence ratio of 8.42
2.4 当量比的影响
对于现行煤低温干馏炉采用的同轴扩散式烧嘴,煤气和氧化剂可能在混合过程中就发生反应,混合界面处的温度分布受局部当量比影响。STELZNER et al[18]在甲烷/氧大当量比反扩散燃烧实验中发现,火焰峰面处最高温度可高达2 700 K左右,接近当量比为1时的完全燃烧火焰温度。本小节分析了不同当量比对煤气/富氧燃烧体系的平衡组分及温度变化影响,结果如图5和图6所示。



在当量比大于1的范围内,平衡温度随当量比增大而减小。一方面是由于体系中参与反应放热的燃料量随当量比增加而减小,另一方面随着当量比的增加,煤气组分相对增加,促进了甲烷蒸汽重整和二氧化碳重整反应的进行,而这些反应吸热进一步降低了平衡温度。当平衡温度降低到1 000 K以下时(当量比大于6),甲烷重整反应减弱甚至逆向进行放热的甲烷化反应(参考图3分析),导致温度变化随当量比增大不再明显。图6所示为煤气/富氧/不同稀释介质燃烧体系平衡组分分布随当量比的变化。结合图6中平衡组分分布变化,在当量比5.5~6时,氢气的摩尔分数达到最大,也进一步验证了这一论点。上述分析表明在大当量比(大于6)范围内,平衡温度对当量比变化不敏感,可以通过适当减小当量比,来增加产物中氢气含量,以促进干馏过程中的加氢热解。
3 结 论
1) 低温干馏煤气中H2,CO,CH4三种组分与氧发生燃烧反应的优先度随反应温度的变化而变化,在低温(T<849 K)条件下,CO的优先度最高,在高温(T>1 143 K)条件下,CH4的优先度最高。
2) 在煤气/富氧大当量比燃烧体系中,除了各燃料组分的燃烧反应外,还存在甲烷化反应、甲烷重整反应和水煤气反应。其中甲烷化和甲烷重整反应分别发生在低温和高温下(转变温度800 K~1 000 K),导致平衡组分中甲烷的摩尔分数随温度升高而降低。水煤气反应吉布斯自由能变的绝对值较低,反应容易达到平衡,使反应体系中CO和H2在较广的温度范围内共存。

4) 不同选择性燃烧假设下计算的绝热火焰温度差值高达550 K以上,考虑各燃料组分选择性燃烧和不完全燃烧产物间相互转化的热效应,对准确预测绝热火焰温度十分必要。

