丙泊酚对胃癌细胞恶性生物学行为的影响及机制
祁占花,张建业,杨世荣
1青海省交通医院麻醉科,西宁810000;2青海省交通医院普外科;3青海省第五人民医院肿瘤内科
胃癌是临床常见的消化道恶性肿瘤,特指产生于胃黏膜上皮的恶性肿瘤。胃癌在全球范围内的发病率和病死率均较高[1-2]。我国胃癌的发病率显著高于世界平均水平;且随我国老龄化进程的加快,胃癌发病率还将持续增长[3]。因此,寻找有效治疗方法具有重要意义,而目前手术仍是胃癌治疗的常见手段,但术后易发生肿瘤扩散、迁移等,患者病死率仍较高[4-6]。近年来有研究显示,丙泊酚作为一种麻醉药物,常被用于各类恶性肿瘤手术。丙泊酚能够抑制乳腺癌、肝癌、食管癌细胞的侵袭和迁移[7-9],且这一过程可能通过调控细胞外信号调节激酶(ERK)/血管内皮生长因子(VEGF)信号通路实现的。2019年6月—2020年8月,本研究主要基于ERK/VEGF信号通路探讨丙泊酚对胃癌细胞增殖、侵袭及迁移的影响,为胃癌的临床治疗提供依据。
1 材料与方法
1.1 细胞、材料及仪器 人胃癌细胞株MGC-803由中国科学院提供。丙泊酚、DMSO、MTT试剂、甲醇均购自美国默克Sigma公司;PBS缓冲液购自北京百奥莱博科技有限公司;兔源ERK一抗、兔源VEGF一抗、β-actin一抗、山羊抗兔lgG二抗均购自英国Abcam公司;Transwell小室购自美国Corning公司;MR-96A型酶标仪购自深圳迈瑞生物医疗电子股份有限公司。
1.2 细胞培养、分组及干预 将细胞株放置在含10%胎牛血清、青霉素及链霉素的RPMI-1640培养基中,在温度37℃、空气湿度95%、5%CO2的环境下进行常规培养,隔天换液,进行传代培养,取对数生长期细胞进行试验。将对数生长期的胃癌细胞随机分为0、2、4、8 μg/L丙泊酚组,2、4、8 μg/L丙泊酚组分别加入相应浓度的丙泊酚溶液处理72 h。0μg/L丙泊酚组作为对照组。
1.3 细胞增殖能力检测 采用MTT法。将各组细胞分别接种于96孔板,每组设置3个平行样本,每孔加入MTT溶液20μL,遮光培养4 h后加入DMSO溶液200μL,振荡溶解。充分溶解后用酶标仪检测490 nm波长处的吸光度,计算细胞存活率(%),细胞存活率=(实验组细胞吸光度/对照组细胞吸光度)×100%。实验重复3次。
1.4 细胞侵袭能力检测 采用Transwell小室实验。将各组细胞悬浊液分别接种于小室的上室,把含血清的培养基放于下室,将细胞放入温度37℃、空气湿度95%、5%CO2的环境下常规培养48 h,取出小室后擦去上室中未侵袭的细胞,用甲醇固定10 min后用结晶紫染色,高倍镜(×100)观察下室细胞数,随机抽取3处视野计算细胞数量,实验重复3次。
1.5 细胞迁移能力检测 采用细胞划痕实验。将各组细胞分别接种于6孔板,待细胞融合至90%,让细胞在无血清培养基中培养12 h。用1 mL枪头小心地划伤单层细胞,弃培养基,用PBS洗净划伤细胞,将细胞放置在无血清培养基中继续培养,在高倍镜下观察并拍照记录0、24 h的划痕宽度。计算细胞划痕愈合率,划痕愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,实验重复3次。
1.6 细胞ERK、VEGF蛋白表达检测 采用Western blotting法。根据蛋白提取试剂盒要求分别提取各组细胞的总蛋白,各取蛋白样品30μg用SDSPAGE胶进行电泳,蛋白分离后用湿法将蛋白质从凝胶转移到PVDF膜上,用5%脱脂奶粉在室温条件下封闭1 h,然后加入稀释过的一抗(1∶1 000),在4℃环境下培养过夜,用PBS清洗3遍后加入稀释过的二抗(1∶10 000),室温培育1 h,再次用PBS缓冲液清洗3遍,显色显影后进行分析。目的蛋白相对表达量=目的蛋白灰度值/内参蛋白灰度值。
1.7 统计学方法 采用SPSS20.0统计软件。计量资料用±s表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 丙泊酚对胃癌细胞增殖能力的影响 对照组、2μg/mL丙泊酚组、4μg/mL丙泊酚组、8μg/mL丙泊酚组细胞存活率分别为100%、(87.63±9.52)%、(72.21±7.84)%、(57.38±8.29)%。与对照组比较,各丙泊酚组细胞存活率低(P均<0.05),且随丙泊酚浓度增加,细胞存活率逐渐降低(P<0.05)。
2.2 丙泊酚对胃癌细胞侵袭能力的影响 对照组、2μg/mL丙泊酚组、4μg/mL丙泊酚组、8μg/mL丙泊酚组侵袭至小室下室的细胞数目分别为(456.28± 44.34)、(378.91 ± 53.83)、(238.39 ± 52.19)、(169.39±47.87)个。与对照组比较,各丙泊酚组侵袭至小室下室的细胞数目少(P均<0.05),且随丙泊酚浓度增加,侵袭至小室下室的细胞数目逐渐减少(P<0.05)。
2.3 丙泊酚对胃癌细胞迁移能力的影响 对照组、2μg/mL丙泊酚组、4μg/mL丙泊酚组、8μg/mL丙泊酚组细胞划痕愈合率分别为(41.38±4.38)%、(34.84 ± 3.91)% 、(26.35 ± 3.17)% 、(11.76 ±3.74)%。与对照组比较,各丙泊酚组细胞划痕愈合率低(P均<0.05),且随丙泊酚浓度增加,细胞划痕愈合率逐渐降低(P<0.05)。
2.4 丙泊酚对胃癌细胞ERK、VEGF蛋白表达的影响 与对照组比较,各丙泊酚组ERK、VEGF蛋白表达低(P均<0.05),且随丙泊酚浓度的增加,胃癌细胞ERK、VEGF蛋白表达逐渐降低(P均<0.05)。见表1。
表1 各组细胞ERK、VEGF蛋白表达比较(±s)
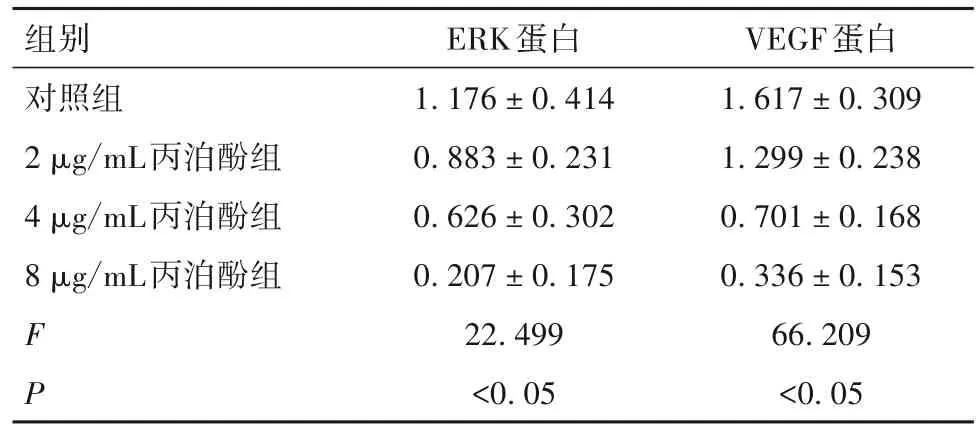
表1 各组细胞ERK、VEGF蛋白表达比较(±s)
组别对照组2μg/mL丙泊酚组4μg/mL丙泊酚组8μg/mL丙泊酚组FP ERK蛋白1.176±0.414 0.883±0.231 0.626±0.302 0.207±0.175 22.499<0.05 VEGF蛋白1.617±0.309 1.299±0.238 0.701±0.168 0.336±0.153 66.209<0.05
3 讨论
丙泊酚是一种临床常用麻醉剂,起效迅速、不良反应小,被广泛应用于多种手术的静脉麻醉。但近年来关于丙泊酚的研究逐渐倾向于其对恶性肿瘤细胞的抑制作用[10-12]。关于丙泊酚在胃癌方面的研究,张志发等[13]发现,丙泊酚能够抑制胃癌细胞的侵袭和迁移,这一过程可能与黏附分子CD44v6和基质金属蛋白酶7(MMP-7)的表达受到抑制有关。张冰等[14]用不同浓度的丙泊酚处理胃癌细胞,并对胃癌细胞周期和某些蛋白表达进行检测,结果显示丙泊酚能够显著抑制胃癌细胞增殖,这可能与半胱氨酸蛋白酶3、9水平升高及B淋巴细胞瘤2水平下降有关。马浩文等[15]对胃癌细胞HGC-27进行研究,结果显示丙泊酚能够显著抑制胃癌细胞的侵袭,且随着丙泊酚浓度的增加,蛋白激酶B(Akt)的磷酸化水平、MMP-7表达量均降低,推测丙泊酚可能通过调控Akt信号通路抑制胃癌细胞的侵袭。从以上研究可以看出,丙泊酚通过对多种信号通路的调节发挥抑癌作用。本研究结果显示,与对照组相比,经丙泊酚处理的各组细胞增殖、侵袭及迁移能力均低,且随丙泊酚浓度增加,胃癌细胞受到的抑制作用越强,说明丙泊酚能够抑制胃癌细胞的侵袭迁移能力,且丙泊酚的浓度越大,抑制作用越强。
VEGF是一种内皮生长因子,能够刺激内皮细胞增殖、迁移,是目前已知的在多种恶性肿瘤中均广泛存在的重要促癌因子[16-18]。有研究显示,VEGF在胃癌细胞中呈高表达,且能促进淋巴细胞生成[19]。ERK属于丝裂原活化蛋白激酶中的一种类型,具有调节细胞生长、周期等多种功能,在癌细胞的发展过程中也起重要作用。研究显示,ERK能够促进VEGF的表达[20],由此推测ERK能够通过促进VEGF的表达发挥促癌作用。与对照组相比,经丙泊酚处理的各组胃癌细胞ERK、VEGF蛋白表达低,且随丙泊酚浓度的增加,胃癌细胞ERK、VEGF蛋白表达逐渐降低。说明丙泊酚对ERK/VEGF信号通路有抑制作用。
综上所述,丙泊酚能够抑制胃癌细胞的增殖、侵袭及迁移,这可能通过调控ERK/VEGF信号通路实现的。关于丙泊酚的抑癌作用,也有研究提示丙泊酚对癌细胞具有双重作用[21],可能是丙泊酚浓度和细胞类型不同导致的。因此需扩大丙泊酚浓度范围和胃癌细胞类型进一步验证丙泊酚对胃癌细胞的调控作用。

