N/LPR及SOFA评分对老年脓毒症患者病情及预后评估的价值
李红,白旭宝,王利松,孟新丽,郭星云
(承德市中心医院,1.老年病科;2.急诊科;3.康复医学科;4.呼吸内科;5.重症医学科,河北 承德 067000)
脓毒症是机体对感染反应失调所致的器官功能障碍,为急诊科重症感染患者的主要死因[1]。早期准确识别并及时干预对改善脓毒症患者预后有重要意义。近年来研究[2]认为,免疫失衡及凝血功能紊乱与脓毒症的发生发展密切相关。中性粒细胞与淋巴细胞作为重要的机体免疫细胞,在免疫应答中起着至关重要的作用;血小板不仅是影响凝血功能的重要因子,还在机体免疫炎症反应过程中发挥着重要作用。既往研究[3-4]显示,外周血中性粒细胞与淋巴细胞比值(neutrophil/lymphocyte ratio,NLR)及淋巴细胞与血小板计数比值(lymphocyte/platelet ratio,LPR)均对脓毒症患者病情及预后有评估意义。最新研究[5]发现,中性粒细胞与LPR比值(N/LPR)与脓毒症合并肾损伤患者的预后相关,提示N/LPR或许可作为脓毒症患者预后评估的新指标。序贯器官衰竭(sequential organ failure assessment,SOFA)评分作为危重患者病情评估的重要评分系统,对于脓毒症的诊断价值已得到认可[6]。本研究旨在探讨N/LPR及SOFA评分对脓毒症患者病情及预后评估的价值。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年12月承德市中心医院重症监护病房(ICU)收治的200例脓毒症患者为研究对象,其中男性113例,女性87例;年龄60~86岁,平均(69.95±4.62)岁。按照病情程度分为脓毒症组(n=112)和脓毒性休克组(n=88);按照28 d预后分为存活组(n=165)与死亡组(n=35)。
纳入标准:(1)符合脓毒症/脓毒性休克治疗国际指南(2016年版)[1]的诊断标准;(2)年龄≥60岁;(3)入院时SOFA评分≥2分;(4)临床资料完整。排除标准:(1)各种疾病终末期患者;(2)哺乳期妇女、孕妇;(3)既往长期免疫抑制剂长期服用史或免疫功能低下者;(4)伴血液系统疾病者;(5)近期有服用影响血小板或升白细胞药物者。
1.2 方法
1.2.1 资料收集 (1)患者一般资料:包括性别、年龄、伴基础疾病、感染部位及入ICU时的SOFA评分。(2)患者入ICU时血常规检测数据:包括中性粒细胞计数(NEU)、血小板计数(PLT)、淋巴细胞计数(LYM)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)、降钙素原(PCT)及N/LPR等。N/LPR=(NEU)/(LYM×PLT)。
1.2.2 观察指标 (1)患者基本情况:包括一般资料及28 d 病死率;(2)外周血常规:包括TNF-α、CRP、PCT及N/LPR;(3)影响脓毒症病情及预后的因素;(4)N/LPR 及SOFA评分对脓毒症病情及预后评估的价值。
1.3 统计学分析
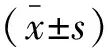
2 结果
2.1 脓毒性休克组与脓毒症组患者基本情况比较
脓毒性休克组患者入院时SOFA评分及28 d病死率高于脓毒症组(P<0.05),两组患者性别、年龄、基础疾病及感染部位比较,差异无统计学意义(P>0.05)。见表1。

表1 脓毒症组与脓毒性休克组基本情况比较
2.2 脓毒症与脓毒性休克组外周血常规比较
脓毒性休克组N/LPR及TNF-α、CRP水平高于脓毒症组(P<0.05);两组患者PCT水平比较,差异无统计学意义(P>0.05)。见表2。

表2 脓毒症与脓毒性休克组外周血常规比较
2.3 N/LPR与SOFA评分的相关性
相关性分析显示,脓毒症患者外周血N/LPR与SOFA评分呈正相关(r=0.645,P<0.001)。
2.4 生存组与死亡组各项指标比较
死亡组SOFA评分、N/LPR高于存活组(P<0.05);两组患者血清TNF-α、CRP、PCT水平比较,差异无统计学意义(P>0.05)。见表3。

表3 生存组与死亡组各项指标比较
2.5 影响脓毒症患者28 d预后的因素
以患者28 d预后为因变量, SOFA评分、N/LPR、性别、年龄等为自变量行回归分析,结果显示,SOFA评分、N/LPR是脓毒症患者28 d死亡的独立危险因素(P<0.05)。见表4。

表4 影响脓毒症患者28 d预后的因素
2.6 N/LPR及SOFA评分对脓毒症患者28 d预后的评估价值
ROC曲线分析显示,N/LPR、SOFA评分单独及联合预测脓毒症患者28 d死亡的AUC分别为0.789、0.868和0.918, N/LPR联合SOFA评分的预测价值更高(P<0.05)。见图1及表5。

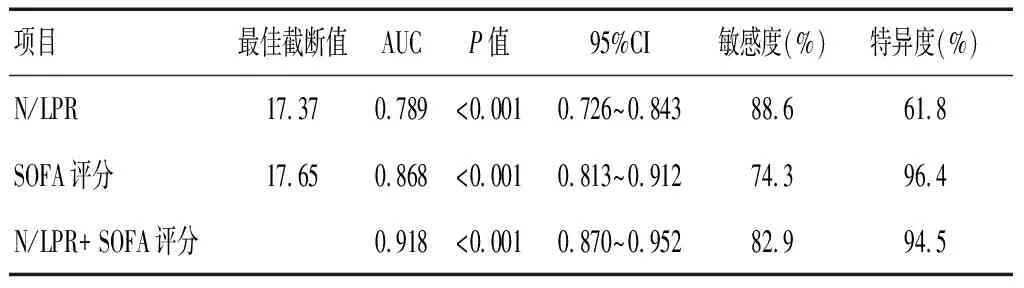
表5 N/LPR、SOFA评分单独及联合对脓毒症患者28 d预后的预测效能
3 讨论
脓毒症的发生与全身炎症反应、免疫调节异常、凝血障碍等多方面有关,但具体机制尚不明确。目前临床常采用PCT、CRP等感染标志物或危重症评分系统来评估脓毒症,但应用价值有限。因此,探寻新的诊断标志物至关重要。
近年研究[7]发现,病原微生物侵袭及机体免疫功能低下是脓毒症发生发展过程中的两个关键因素。中性粒细胞作为人体重要的免疫应答细胞,在感染发生后能够迅速抵达感染位置,激活其他免疫细胞,共同促使机体免疫功能活化,从而清除病原菌[8]。淋巴细胞也是机体免疫的关键因子,参与了体液细胞免疫过程[9]。通过检测NEU和LYM的比值(NLR)能够在某种程度上反映脓毒症病情及预后,但NLR仅对机体免疫活化状态进行评估,未能考虑机体凝血功能的改变。研究[10]发现,脓毒症患者存在有明显的凝血功能异常改变,对预后极为不利。血小板作为联系机体凝血功能与免疫应答的“枢纽”,在炎症免疫反应及凝血活化过程中发挥着重要作用。有研究[11]显示,很多脓毒症患者伴随血小板减少,且是导致预后不良的危险因素之一。
Cameiro等[5]研究发现,N/LPR与脓毒症合并肾损伤患者病死率明显相关,原因可能是脓毒症发生时,机体释放大量毒素,引起凝血功能亢进,促进微血栓形成,血小板遭到破坏、消耗;此外,大量生成的毒素,还会对骨髓造血功能造成抑制,引起血小板合成减少,使外周血PLT降低,凝血功能失衡,引发弥散性血管内凝血,从而加重病情,增加病死率[12]。SOFA评分是通过客观数据对器官功能障碍进行动态监测,已成为脓毒症诊断的重要评分系统,其与脓毒症患者28 d病死率的相关性已得到较多研究证实[13-14]。本研究结果显示,脓毒症休克组患者N/LPR及SOFA评分高于脓毒症组(P<0.05),二者均是影响患者28 d死亡的独立危险因素(P<0.05),且呈正相关(P<0.05),表明N/LPR和SOFA评分均与脓毒症病情及预后密切相关。ROC曲线分析显示,N/LPR、SOFA评分单独及联合预测脓毒症28 d预后的AUC分别为0.789、0.868和0.918,表明二者对患者预后均有较高的预测价值,但联合使用预测的价值更高(P<0.05)。
综上, N/LPR及SOFA评分与脓毒症患病情及预后密切相关,二者均可作为病情判断及预后评估的指标,联合使用对预后评估的价值更高。

