川陈皮素对麻醉后老龄认知功能障碍大鼠学习记忆功能损伤的改善作用
赵广平,史炯,程晶晶,陈永学
(邯郸市中心医院麻醉科,河北 邯郸 056008)
术后认知功能障碍(postoperative cognitive dysfunction,POCD)为麻醉和手术后患者出现的中枢神经系统并发症,患者在术后表现出人格、人际交往与认知学习能力障碍,主要为记忆力、集中力及话语理解力、社交能力较术前退化、受损,可在术后一段时间持续,部分并发症持续时间甚至达数周,尤其对合并基础疾病多的老龄患者预后较差。延长住院时间、重症监护室内滞留时间增加了术后并发症的发生风险[1-2],因此如何降低POCD发生率仍是目前临床研究的重点之一。川陈皮素为中药陈皮的主要成分之一,属于多甲氧基黄酮类化合物,对乳腺癌、胃癌、肺癌及结肠癌等多种癌症有抵抗作用,可抑制肿瘤血管生成,从而阻碍癌细胞增殖、侵袭、迁移并促进细胞凋亡[3-5]。川陈皮素还可预防动脉血栓形成,减轻糖尿病性心血管功能障碍[6]。核因子E2相关因子-2(nuclear factor E2-related factor 2,Nrf-2)、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)、血红素氧合酶(heme oxygenase,HO-1)为神经元细胞损伤后常见的氧化应激性指标;含半胱氨酸的天冬氨酸蛋白水解酶-12(caspase-12)是内质网应激(endoplasmic reticulum stress,ERS)通路重要调控蛋白,参与细胞凋亡的调控;环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)为特定的记忆调节基因;糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)则可调控神经细胞生长、增殖及凋亡。杨华等[7]报道川陈皮素可降低脑梗死大鼠低氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)含量,提高血管内皮生长因子(vascular endothelial growth factor,VEGF)含量,下调Cleaved caspase3蛋白表达而抑制神经细胞凋亡,据此推测川陈皮素可能对改善麻醉后认知功能障碍也有一定作用。因此,本文拟探讨川陈皮素对麻醉后老龄认知功能障碍大鼠学习记忆功能的改善作用,以Nrf-2、γ-GCS、HO-1、CREB、GSK-3β、caspase-12为监测的定量指标。
1 材料与方法
1.1 材料
1.1.1 实验动物 Sprague Dawley(SD)大鼠一般寿命为2.5~3年,依据人类60岁即为老年年龄的标准计算,SD大鼠进入老龄化时间约为1.7年,即20月龄。本次选取18~20月龄的健康雄性SD大鼠35只,体重470~540 g,平均(505.41±51.27)g,均由武汉大学动物实验中心提供[SCXK(鄂)2014-004],动物福利批次编号DWFL-201403005,依据该实验中心的动物实验伦理委员会相关规定进行实验操作。SD大鼠均饲养于标准鼠笼,光照周期12/12 h光/暗循环,相对湿度45%~50%,温度22~24 ℃,不间断供给水、食物,适应性饲养1周使大鼠适应试验环境方可开始实验。
1.1.2 主要仪器与试剂 水平温控摇床(XMOOOLDR-MLM,北京中西远大科技有限公司),体重称、高速低温离心机、电泳转移槽与垂直电泳仪均由北京六一仪器厂生产,自动洗板仪(ELX50型,美国Bio-Tek Instruments Inc),漩涡振荡器(XW-80A型,上海精料实验有限公司),Morris水迷宫及分析软件(中国医学科学院药物研究所),Fluor Chen5500凝胶成像分析系统(美国Thermo公司);1.5%异氟烷(江苏恩华医药公司),川陈皮素(陕西慧科生物科技有限公司),β-actin抗体(北京中衫金桥生物技术公司,货号:A-09);兔抗Nrf-2、γ-GCS、HO-1、CREB、GSK-3β、caspase-12多克隆抗体(均购自美国KPL公司,货号分别为A-AP52270、PAB4279、H00197259、QC999Hu01、WL03683、ABP50853),抗体稀释液(碧云天生物科技研究所),SDS-聚丙烯酰胺凝胶(PAGE)电泳液粉剂(碧云天生物科技研究所),BCA蛋白浓度测定试剂盒(北京德莱生物科技有限公司)等。
1.2 方法
1.2.1 水迷宫预训练 训练实验开始前,以500 g奶粉将水迷宫中的水混匀成乳白色,遮蔽圆形平台。在适应性训练开始前1 d,将大鼠置于水中自由游泳5 min,剔除不会游泳的大鼠。后将水迷宫中平台露出水面,使动物可看见平台,将动物放入池中,若大鼠毫无困难直接游向平台则说明其视力正常,由此排除视力障碍对实验结果的影响。由专门的实验人员进行操作,实验中保持环境安静和稳定,动物放入水中后立即离开,并维持水迷宫周围物体位置及光源不变。通过预训练的30只大鼠进入后续研究。
1.2.2 分组及建模 分组:水迷宫预训练结束后第1天将30只大鼠随机分为正常组、模型组、低剂量组、中剂量组、高剂量组,每组各6只。建立模型:禁食不禁水16 h后,在麻醉箱出气口处检测的异氟烷浓度维持在1.5%时,将模型组、低剂量组、中剂量组和高剂量组的大鼠放置于麻醉诱导箱内隔板上部,麻醉生效时开始计时,连续吸入2 h浓度为1.5%的异氟烷。正常组吸入同样时间的含30%氧气的混合气体。麻醉期间监测出气口处的异氟烷浓度,适时调整异氟烷挥发罐刻度,保持麻醉诱导箱中异氟烷气体浓度恒定。麻醉生效标准:大鼠夹尾反射消失,此时开始计时并让大鼠在麻醉环境中维持2 h。麻醉完全恢复标准:实验大鼠从麻醉箱中取出后自然苏醒且可在地板上稳定自主地行走,记录其时间,为后续实验做参考。
1.2.3 川陈皮素注射方法 低剂量组、中剂量组、高剂量组分别腹腔内注射10 mg/kg、20 mg/kg、30 mg/kg川陈皮素,连续3 d,模型组及正常组经腹腔注射同等体积的吐温-80,连续3 d。其中前2 d为麻醉实施前,第3天为麻醉完全恢复后2 h。注射药物器具均灭菌消毒,注射时先回抽以避免注射针头误入血管内。
1.2.4 Morris水迷宫实验 在异氟烷麻醉完全恢复24 h后,连续进行4 d的Morris水迷宫实验。方法:将水池分为4个象限,依据顺时针方向标记为Ⅰ~Ⅳ,水池及平台均为黑色,平台固定于第Ⅲ象限,将水池染成黑色以隐匿水下平台,保持水温26 ℃,打开计算机,确定设备及软件工作正常,经自动图像拍摄系统记录游泳轨迹,以入水时找到平台时间为潜伏期,测4次后取均值,评估其学习记忆能力。在第4天记录各组大鼠在目标象限中停留时间及60 s内穿越平台次数,测定空间探索功能,见图1。
1.2.5 海马组织取材及制片 水迷宫实验结束后大鼠空腹过夜8 h。每组随机选取4只大鼠进行心脏灌注,予以10%水合氯醛(3 mL/kg)进行腹腔注射麻醉(1%戊巴比妥钠30 mg/kg),开胸暴露心脏,进行左心室插管,后将右心耳剪开,快速完整取出全脑组织放入4%中性多聚甲醛灌注固定,并参考前人的研究方法分离海马组织,以液氮冷冻后置于-80 ℃冰箱保存待测。剪取1 mm3海马组织,石蜡包埋,苏木精-伊红染色(hematoxylin-eosin staining,HE),光镜观察。
1.2.6 Western blot试验 采用Western blot试验检测海马组织CA1区的Nrf-2、γ-GCS、HO-1、CREB、GSK-3β、caspase-12表达水平。组织蛋白试剂盒提取各组脑组织蛋白,经BCA法对总蛋白定量。取40 μg蛋白样品于12%的SDS-PAGE分离,转膜、封闭后孵育1∶1 000稀释的一抗及GAPDH,4 ℃孵育过夜,TBST洗膜(3×5 min),二抗孵育(辣根过氧化物酶标记的羊抗鼠IgG,1∶1 000稀释),室温孵育2 h,采用化学发光剂显色,室温下避光显影,采用全自动数目凝胶成像分析系统(Image J)对蛋白条带光密度进行测定并分析,相对表达量=目的蛋白灰度值/内参灰度值,连续测3次后取平均值。
1.3 统计学分析
2 结果
2.1 Morris水迷宫实验结果
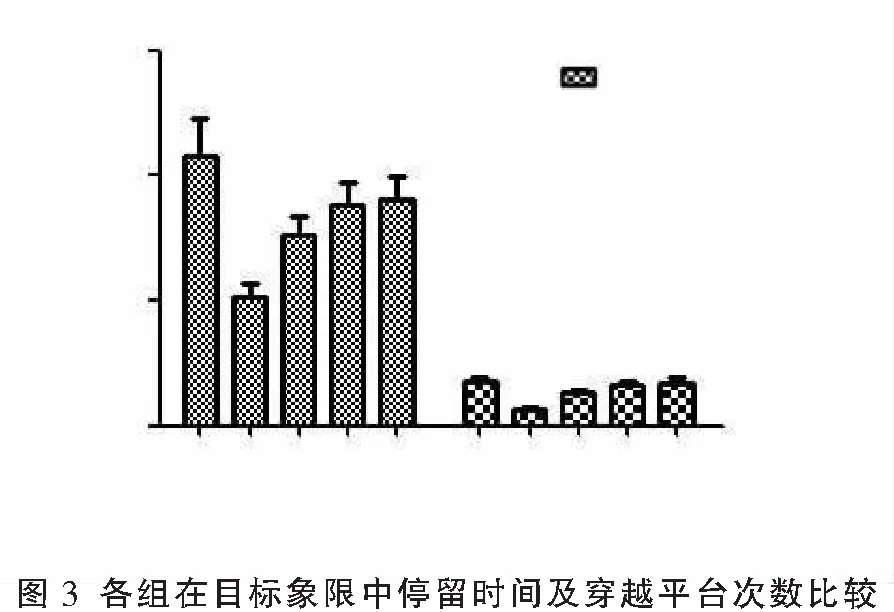
随时间延长,各组SD大鼠逃生潜伏期呈缩短趋势,与正常组比较,模型组第1~3天逃生潜伏期延长(P<0.05),低剂量组、中剂量组、高剂量组在第2 天、第3天逃生潜伏期短于模型组(P<0.05),第4天中剂量组、高剂量组逃生潜伏期短于模型组(P<0.05)。低剂量组、中剂量组、高剂量组的逃生潜伏期比较,差异无统计学意义(P>0.05)。模型组在目标象限中停留时间、穿越平台次数短低于正常组,低剂量组、中剂量组、高剂量组在目标象限中停留时间及穿越平台次数高于模型组,中剂量组、高剂量组在目标象限中停留时间及穿越平台次数高于低剂量组(P<0.05),且中剂量组、高剂量组在目标象限中停留时间与正常组仍有差异(P<0.05),而穿越平台次数与正常组比较差异无统计学意义(P>0.05);中剂量组、高剂量组的上述指标比较,差异无统计学意义(P>0.05)。见表1、表2、图2、图3。

表1 Morris水迷宫实验-学习记忆能力


表2 Morris水迷宫实验-空间探索功能指标
2.2 HE染色结果
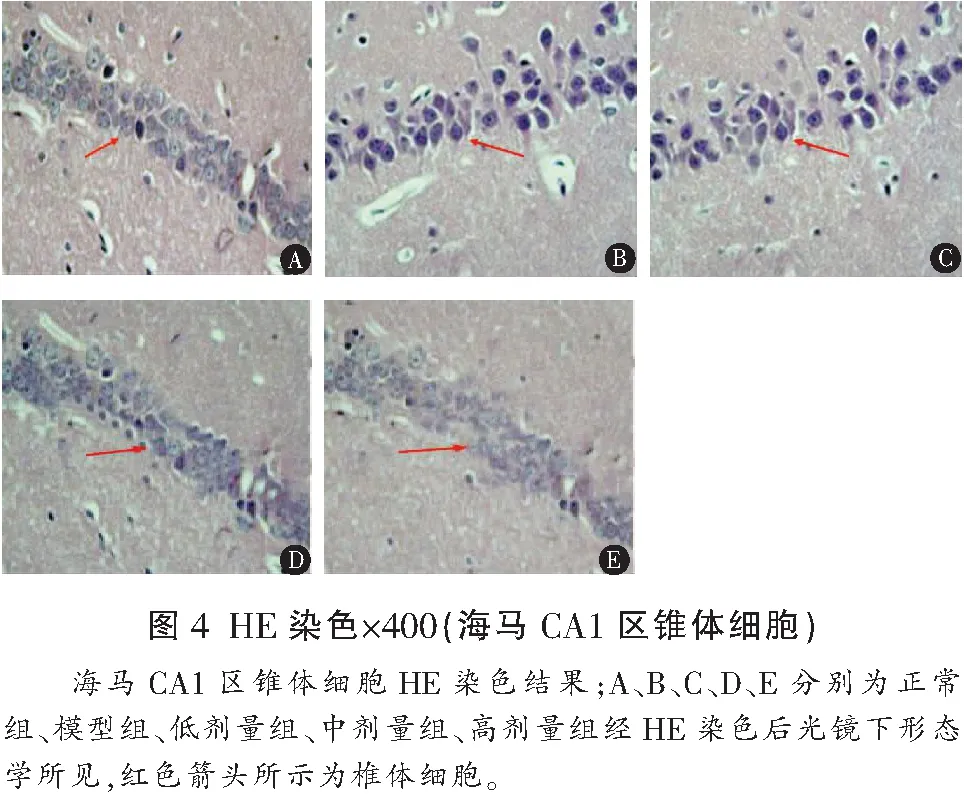
光镜下可发现,正常组的大鼠海马CA1区锥体细胞数目正常,排列紧密,胞浆内结构清晰,脑白质形态正常,模型组海马CA1锥体细胞缺失脱失,排列疏松,部分细胞出现核固缩、深染色,脑白质无明显梗死灶,部分白质纤维变稀疏且走行紊乱,低剂量组、中剂量组、高剂量组锥体细胞缺脱失程度小于模型组,脑白质未见梗死灶,白质纤维部分稀疏。见图4、图5。

2.3 Western blot结果
模型组海马组织CA1区Nrf-2、γ-GCS、HO-1、CREB、GSK-3β、caspase-12水平高于正常组(P<0.05);低剂量组、中剂量组、高剂量组Nrf-2、γ-GCS、HO-1、CREB、GSK-3β水平高于模型组,caspase-12低于模型组,其中高剂量组的变化最显著(P<0.05);低剂量组Nrf-2、γ-GCS、HO-1、CREB、GSK-3β低于中剂量组、高剂量组,而caspase-12高于中剂量组、高剂量组(P<0.05);中剂量组与高剂量组的各指标比较,无统计学差异(P>0.05)。见图6、图7。


3 讨论
POCD为多种因素诱发及加重神经功能退行性改变引起的并发症[8],而老年人群中枢神经系统本身有不同程度退化,多数合并各种心脑血管疾病更易引起POCD,且近年来我国已初步进入老龄化社会,老年人口基数庞大,接受麻醉手术的老年患者增多,POCD发生率增多,早期进行预防、尽早识别并治疗有着重要意义[9]。川陈皮素为从芸香科柑桔属橘子的果皮中提取出来的多甲氧基黄酮类化合物,有广泛的药理活性,如抗炎、抗氧化、抗癌、抗动脉粥样硬化、调节营养神经等[10-11],近年来研究[12-13]也发现,川陈皮素有一定的保护脑屏障、抗阿尔茨海默病及帕金森病作用,但是川陈皮素对术后认知功能障碍的改善作用目前研究甚少。
异氟烷为最常用的吸入麻醉药,临床研究[14]表明1.4%及更高浓度的异氟烷麻醉6 h后可诱导广泛的脑神经凋亡及认知功能下降,其机制可能与GSK-3β活性的增加有关。本次选择异氟烷建立麻醉后老龄认知功能障碍大鼠模型,在水迷宫Morris实验-学习记忆能力测试中发现,随时间延长各组的逃生潜伏期呈下降趋势,且模型组第1~3天逃生潜伏期较正常组高,予以低、中、高剂量川陈皮素的大鼠在第2天、第3天逃生潜伏期均短于模型组,而不同剂量的川陈皮素对逃生潜伏期无影响,表明川陈皮素可较好改善麻醉后认知功能障碍老龄大鼠的学习记忆能力,提高其认知功能,但未发现较明显的剂量效应。空间探索功能部分中,模型组在目标象限中停留时间、穿越平台次数短于正常组,川陈皮素给药的三组在目标象限中停留时间及穿越平台次数高于模型组,且以中剂量组、高剂量组的变化更为显著,与张红蕊等[15]报道结果相似,均表明川陈皮素可改善麻醉后认知功能障碍大鼠的空间探索功能,改善其认知功能。但既往Kang等[16]却认为,川陈皮素可改善情绪和新奇识别记忆,但不能改善空间参照记忆,与本研究结论不一致,这可能与试验选取的动物月龄及样本量不同有关,即川陈皮素对不同种群的空间定位学习记忆能力的影响不同。
海马为学习记忆的关键部位,其CA1及CA3区锥体细胞为形成记忆的长时程增强效应(long-term potentiation,LTP)重要区域,对异氟烷的麻醉浓度变化异常敏感,且海马结构与学习记忆能力密切相关,当海马结构功能受损时可导致认知功能障碍[17-18]。本次HE染色显示,与其他各组相比,模型组海马CA1锥体细胞缺失脱失,排列疏松,部分白质纤维变稀疏且走行紊乱,与柏慧[19]的观察结果相近,表明在异氟烷麻醉后可引起老龄大鼠海马组织损伤,但其作用机制仍待进一步分析。
Nrf-2属于CNC家族,为家族中活性最强的转录因子,在正常情况下,Nrf-2被细胞质中Keap1锚定,其活性相对抑制,Keap1对氧化还原酶较敏感,有氧化应激时与Nrf-2解离,使其进入细胞核,在核内和抗氧化反应元件(antioxidant response element,ARE)作用,启动下游抗氧化蛋白,增强解毒素酶系的表达,如γ-GCS、HO-1等,清除大量自由基,减轻细胞损伤,而经下调胶质细胞活化介导对神经元的保护作用,此外内质网也易受机体内环境影响,在氧化应激时即可破坏内质网稳定性,其中caspase-12为ERS通路的重要调控蛋白,手术或麻醉后可使ERS反应激活,活化的caspase-12能激活caspase-3、caspase-9而引起细胞凋亡[20]。本研究发现,模型组海马组织CA1区Nrf-2、γ-GCS、HO-1、caspase-12高于正常组,川陈皮素给药的三组Nrf-2、γ-GCS、HO-1也高于模型组,而caspase-12则低于模型组,其中高剂量组的变化最显著,与田玉娜等[21]研究结果相似,表明川陈皮素可有效改善麻醉后老龄大鼠认知功能及海马组织神经元结构,上调Nrf2、γ-GCS、HO-1的表达,下调caspase-12的表达,抑制海马组织凋亡,其机制可能与增强Nrf-2活性及激活抗氧化应激通路有关。在麻醉后创伤环境下,对氧化应激敏感的Keap1即释放Nrf-2入细胞核,Nrf-2活性增强、表达量增多,启动下游抗氧化蛋白(如γ-GCS、HO-1等)表达,中和大量氧化应激产物、神经元毒素等,以保护海马神经元,但仍不能抵抗麻醉损伤导致的氧化应激,因此海马损伤使大鼠出现认知功能障碍,经川陈皮素治疗的麻醉后老龄大鼠认知功能有所改善,海马Nrf-2表达水平较异氟烷麻醉者高,进而推测川陈皮素可能为Nrf-2的激活剂,可诱导Nrf-2活性增强、表达量增多,继而产生更多的抗氧化蛋白以保护海马结构,激活Nrf-2-ARE信号通路的抗氧化作用,因此川陈皮素对麻醉后老龄大鼠的认知功能障碍有一定治疗作用。
CREB为特定的调节记忆基因,可经cAMP和/或Ca2+通过各种蛋白激酶在Ser133磷酸化而激活核中的CREB信号,从而改变认知功能。GSK-3β为一种丝氨酸/酸酸蛋白激酶,对神经细胞生长、增殖及凋亡有重要调控作用。早期研究[22]发现,通过川陈皮素治疗可增加CREB信号传导而挽救亚硝基-谷胱甘肽还原酶(S-nitrosoglutathione reductase,GSNOR)诱导衰老过程中的神经衰老。本次模型组海马组织CA1区CREB、GSK-3β水平高于正常组,川陈皮素给药的三组CREB、GSK-3β水平高于模型组,其中高剂量组的变化最显著,表明川陈皮素可通过增加老龄大鼠的海马体中CREB/GSK-3β依赖性的信号传导途径,减轻麻醉后海马神经元损伤,改善其认知功能。早期Bi等[23]也报道,川陈皮素有抗氧化、抗炎、抗凋亡作用,川陈皮素可通过激活磷酸化磷酸化蛋白激酶B(phosphorylated-akt,P-Akt)、CREB及脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)蛋白表达,降低B细胞淋巴瘤2相关X蛋白水平,改善衰老大鼠由异氟烷诱导的认知障碍。Zhang等[24]的研究也发现,川陈皮素可通过抑制表达Slug的神经胶质瘤细胞中AKT/GSK3beta/β-catenin信号传导途径来抑制侵袭。毕俊英[25]发现,川陈皮素可改善老年大鼠麻醉后学习记忆功能的损害,且大剂量川陈皮素的改善作用更明显,其可能是通过调节PI3K/Akt-核转录因子κB(nuclear transcription factor-κB,NF-κB)通路所介导的中枢神经系统内炎症反应及氧化应激反应来实现的。以上研究均表明激活CREB/GSK-3β通路可能也是川陈皮素减轻老龄大鼠麻醉后认知功能障碍的机制。
综上所述,川陈皮素可能通过激活Nrf-2、γ-GCS、HO-1、CREB、GSK-3β的表达增强抗氧化应激,减少caspase-12的表达抑制凋亡,进而改善麻醉后老龄认知障碍大鼠的学习记忆功能。

