脑膜瘤组织中H3K27me3的表达及临床意义
崔 黎,崔 莹,张红燕,陈奎生
(1.郑州大学第一附属医院病理科,河南 郑州 450052;2.郑州卫生健康职业学院基础医学系,河南 郑州 450052)
脑膜瘤是中枢神经系统最常见的原发性肿瘤之一,是起源于蛛网膜脑膜上皮细胞的颅内和椎管内肿瘤[1],脑膜瘤占全部脑肿瘤的19.2%~30.0%[2-3]。2016年,世界卫生组织(World Health Organization,WHO)将脑膜瘤分为3级,脑膜瘤组织学亚型15种。不同WHO级别和组织学亚型的脑膜瘤的复发风险和侵袭能力不同,术后治疗方式也不同,因此,明确诊断脑膜瘤WHO级别和组织学亚型对临床治疗以及患者预后评估具有重要意义。组蛋白H3在体内存在单甲基化(me1)、二甲基化(me2)及三甲基化(me3)3种形式,其N-末端赖氨酸残基K27是主要的甲基化修饰位点,其甲基化的程度可影响相应区域DNA的转录活性,从而发挥抑制转录的作用[4],组蛋白H3K27me3在肿瘤发生、发展中起着重要作用。有研究发现,H3K27me3在正常的脑膜上皮不表达,而在脑膜瘤组织中表达[5],部分脑膜瘤组织中H3K27me3表达缺失,H3K27me3表达缺失的脑膜瘤患者复发率较高[6]。为进一步探讨H3K27me3是否能够作为评估脑膜瘤级别及预后的指标,本研究检测了脑膜瘤组织中H3K27me3的表达,并分析了其与患者临床病理学参数的关系。
1 资料与方法
1.1 一般资料选择2018年5月至2019年12月郑州大学第一附属医院手术切除的140例脑膜瘤患者的肿瘤标本为研究对象。140例患者中男81例,女59例;年龄≥40岁者74例,<40岁者66例;脑膜瘤WHO分级Ⅰ级62例,Ⅱ级47例,Ⅲ级31例;WHOⅠ级患者脑膜瘤组织学亚型:脑膜上皮细胞型14例,纤维型17例,过渡细胞(混合)型21例,砂砾体型3例,血管瘤型1例,微囊型2例,分泌型1例,富于淋巴浆细胞型1例,化生型2例;WHOⅡ级患者脑膜瘤组织学亚型:脊索样型4例,透明细胞型1例,非典型性脑膜瘤42例;WHO Ⅲ级患者脑膜瘤组织学亚型:乳头型2例,横纹肌样型1例,间变型脑膜瘤28例。患者术后病理诊断明确,未进行放射治疗和化学治疗。标本离体0.5~1.0 h固定于中性多聚甲醛液体中,用于苏木精-伊红(hematoxylin-eosin,HE) 染色和免疫组织化学试验。
1.2 主要试剂兔抗人H3K27me3单克隆抗体和免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学法检测脑膜瘤组织中H3K27me3蛋白表达石蜡切片用二甲苯进行脱蜡处理,滴加体积分数3%过氧化氧,室温下孵育30 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3次,每次5 min。将切片放入有枸橼酸盐抗原的修复盒,高压锅中高压20 min,自然冷却后再用PBS洗涤3次,每次5 min;滴加体积分数10%兔血清(PBS稀释)后继续孵育30 min,弃血清,滴加H3K27me3单克隆抗体(1100),空白对照滴加PBS代替一抗,切片仍置于湿盒内,4 ℃冰箱保存过夜;取出湿盒,滴加生物素化二抗工作液孵育30 min,PBS洗涤3次,每次5 min。滴加辣根酶标记的链霉卵白素工作液孵育 10 min,PBS液洗涤3次,每次5 min。滴加3,3-二氨基联苯胺底物工作液于切片,显微镜下控制显色,自来水终止显色反应,苏木精复染,乙醇脱水,二甲苯透明,中性树胶封片,封片后显微镜下观察。
1.4 脑膜瘤组织中H3K27me3蛋白表达的结果判定H3K27me3蛋白表达于细胞核,呈浅黄色至深褐色颗粒。参照文献[5],每张切片随机选取10个视野,每个视野计数100个细胞,在显微镜下观察,根据着色强度和着色数量综合判断H3K27me3蛋白的表达。着色强度:细胞核未染色为0分,细胞核可见淡黄色颗粒为1分,细胞核可见棕黄色颗粒为2分,细胞核可见深褐色颗粒为3分;着色数量:靶组织中着色细胞数<5%为0分,5%≤靶组织中着色细胞数<25%为1分,25%≤靶组织中着色细胞数<50%为2分,靶组织中着色细胞数≥50%为3分。根据着色强度评分与着色数量评分的乘积判断H3K27me3蛋白表达强度,0~2分为阴性表达,≥3分为阳性表达。用已知的H3K27me3阳性表达的神经鞘瘤组织作阳性对照;用已知的H3K27me3阴性表达的脑膜上皮组织作阴性对照。
1.5 统计学处理应用SPSS 22.0软件进行统计学分析。计数资料用例数和百分率表示,两两比较采用χ2检验;多样本率的比较采用行列表资料的χ2检验;检验水准α=0.05。
2 结果
2.1 不同WHO分级脑膜瘤组织学特征及H3K27me3蛋白表达结果见图1、图2和表1。WHOⅠ级脑膜瘤组织中细胞密度中等,未见核分裂;WHOⅡ级脑膜瘤组织中细胞密度稍增大,可见明确的脑组织侵犯;WHO Ⅲ 级脑膜瘤组织中细胞密度明显增多,核分裂易见。脑膜瘤组织中H3K27me3蛋白表达强度随着WHO级别升高而逐渐降低。脑膜瘤组织中H3K27me3蛋白阳性表达率随着WHO级别升高逐渐降低,两两比较差异均有统计学意义(P<0.05)。

A:WHOⅠ级脑膜瘤;B:WHOⅡ级脑膜瘤;C:WHO Ⅲ级脑膜瘤。

A、D:WHOⅠ级脑膜瘤组织;B、E:WHOⅡ级脑膜瘤组织;C、F:WHO Ⅲ级脑膜瘤组织;A~C:×200;D~F:×100。

表1 不同WHO分级脑膜瘤组织中H3K27me3蛋白表达
2.2 脑膜瘤组织中H3K27me3蛋白表达与脑膜瘤患者临床病理学参数的关系脑膜瘤组织中H3K27me3蛋白的表达与脑膜瘤患者的年龄、性别及肿瘤的组织学亚型均无关(P>0.05),见表2。
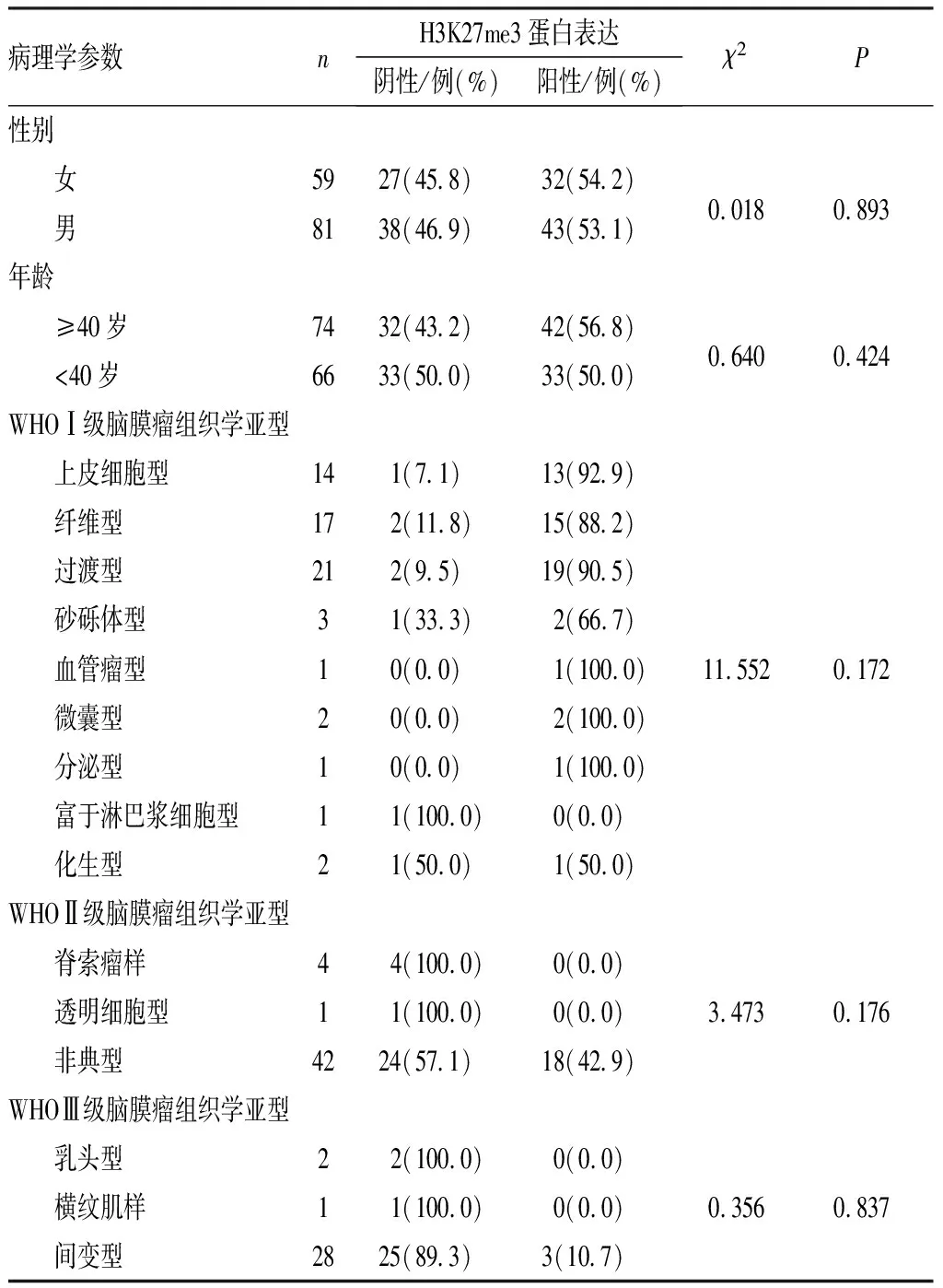
表2 脑膜瘤组织中H3K27me3蛋白表达与脑膜瘤患者临床病理学参数的关系
3 讨论
脑膜瘤是常见的中枢神经系统肿瘤之一,脑膜瘤术后的复发率、患者是否需要联合放射治疗以及预后情况均与脑膜瘤的级别相关[7],但脑膜瘤的组织学亚型种类多且分级复杂,因此,寻找协助脑膜瘤分级的分子标志物是临床病理诊断工作中的重中之重。研究表明,肿瘤的发生、发展是由表观遗传异常导致基因的DNA序列不发生变化的条件下,基因功能发生可遗传的变化,引起表达失常所致,表观遗传学包括组蛋白修饰、DNA甲基化、染色质结构重构和非编码RNA的调控[8]。核心组蛋白在翻译完成后其N端尾区发生的甲基化、乙酰化及磷酸化均是组蛋白修饰,这些修饰可以改变染色质结构从而影响复制、转录及DNA修复等一系列重要的生理过程,进而调节其下游基因的表达。组蛋白H3K27me3的修饰是表观遗传中重要的基因沉默标志,参与调节细胞分化与增殖之间的平衡,其表达失衡可导致细胞增殖分化失控,进而导致肿瘤的发生[9-10]。研究表明,组蛋白H3K27me3在肿瘤发生、发展中起着重要作用[11]。多梳抑制复合物2(polycomb repressive complex2,PRC2)可产生H3K27me3 ,PRC2由Zeste基因增强人类同源物2(enhancer of Zeste homolog 2,EZH2)和胚胎干细胞抑制蛋白(suppressor of Zeste,SUZ12)及胚胎外胚层发育蛋白(embryonic ectoderm development,EED)3部分关键亚基构成,EZH2在多种肿瘤中过表达,EZH2与H3K27me3的表达呈负相关[12];EZH2表达过高或者功能改变均会导致H3K27me3的表达失衡[13]。研究发现,H3K27me3在肝癌、前列腺癌、乳腺癌及胰腺癌中存在异常表达,且是重要的独立预后评估因子[14];H3K27me3在神经鞘瘤中呈高表达,而在恶性外周神经鞘膜瘤中表达缺失[15]。本研究通过检测H3K27me3蛋白在脑膜瘤组织中的表达发现,H3K27me3蛋白在脑膜瘤组织中呈高表达,随着脑膜瘤WHO级别的升高,其表达逐渐降低;H3K27me3蛋白在脑膜瘤组织中的表达与脑膜瘤患者的性别、年龄及各种组织学亚型无相关性。本研究结果表明,H3K27me3蛋白可以作为脑膜瘤的WHO分级的一个重要免疫组织化学指标,为临床上脑膜瘤术后是否进行放射治疗提供理论依据。随着对H3K27me3研究的深入,其有望成为脑膜瘤靶向治疗的新靶点。

