共价有机骨架材料(COFs)对Cr(Ⅵ)的吸附行为分析 *
马蕴杰,丁思文,张成格,张 伟,2,李 芊,王绍艳,2
(1. 辽宁科技大学 化学工程学院,辽宁 鞍山 114051; 2. 精细分离工程技术中心,辽宁 鞍山 114051)
0 引 言
随着工业的高速发展,废水排放也随之增加,工业废水中的重金属处理成了治理工业废水的重中之重[1-4]。在环境污染方面常见的重金属主要是指汞、镉、铅、铬等生物毒性显著的重元素[5-9]。常见的处理方法有生物法[10]、沉淀法[11]、吸附法[12]等。采用生物法处理重金属虽成本低、不易造成二次污染,但也存在着处理效率低、吸附容量小的问题[13];沉淀法的操作流程最为简单,并且处理效果也较为理想,但易造成二次污染,并且溶剂使用量大、成本高[14];吸附法作为一种高效、高速的重金属处理方法,工业上常常采用该方法处理含重金属的废水[15]。有机共价骨架材料作为一种新型的多孔结构材料在催化、电化学、气体储运等方面得到了广泛应用,同时COFs凭借其比表面积大、孔结构多、化学性质稳定的优势也常被用来作为吸附剂进行金属离子的吸附[16-18]。
本实验以三醛基间苯三酚为合成单体采用水热合成法分别制备了两种共价有机骨架材料TpBD COFs和MICOFs,并分别考察了两种材料对Cr(Ⅵ)的吸附行为。实验通过扫描电镜,比表面积测定和红外光谱等表征手段对COFs材料的结构和基本物性参数进行了分析,并利用动态和静态吸附实验研究了其对Cr(Ⅵ)的吸附行为。研究结果可为COFs材料应用于金属离子吸附富集提供参考。
1 实 验
1.1 试剂与仪器
重铬酸钾,沈阳试剂厂;三醛基间苯三酚(Tp)、1,3,5-三(4-氨苯基)苯(TAPB)、联苯胺(BD)、三氟甲基磺酸钪,阿尔法化工有限公司;均三甲苯,阿拉丁有限公司;乙醇,国药集团化学试剂有限公司。以上试剂均为分析纯。
HY-5A数显回旋振荡器,常州翔天实验仪器厂;BPJ-A型真空干燥箱,上海和呈仪器制造有限公司;iS20 FTIR型红外光谱仪(FTIR),赛默飞有限公司;ZEISS蔡司钨灯丝扫描电子显微镜(SEM),德国蔡司公司;WFZ UV-2000紫外可见分光光度计,尤尼柯(上海)仪器有限公司;Kubo型比表面积分析仪,北京彼奥德电子技术有限公司。
1.2 实验方法
1.2.1 TpBD COFs的制备
将15 mL含有0.3 mmol 1,3,5-三甲酰间苯三酚(Tp)的乙醇溶液和5 mL含有0.45 mmol的联苯胺(BD)混合在100 mL的烧瓶中,在室温下持续搅拌15 min得到均匀的黄色溶液,将混合物在80℃下回流并通入氮气保护,混合溶液由黄色变为浅棕色,再将混合溶液在回流状态下强力搅拌3h,将所得溶液离心(10 000 r/min,5 min),剩余的Tp和BD成分通过索氏萃取去除,产物在真空干燥箱中烘干24 h得到干燥后的TpBD COFs,合成路线如图1所示。
1.2.2 MICOFs的制备
分别称量0.15 g 1,3,5-三(4-氨基苯基)苯(TAPB)、0.09 g Tp于10mL圆底烧瓶中,再向其中加入2 mL均三甲苯、在25 ℃下超声直到单体完全溶解,静置30 min,再向悬浮溶液中加入4 mg三氟甲基磺酸钪并超声,用保鲜膜将烧瓶封住静置30 min,将反应混合物转移到容器里并将所得的沉淀物活化,采用索氏提取的方法用甲醇:醋酸(9∶1v/v)提取12 h,用甲醇冲洗直到中性,在60 ℃下干燥12 h得到MICOFs,合成路线如图1所示。
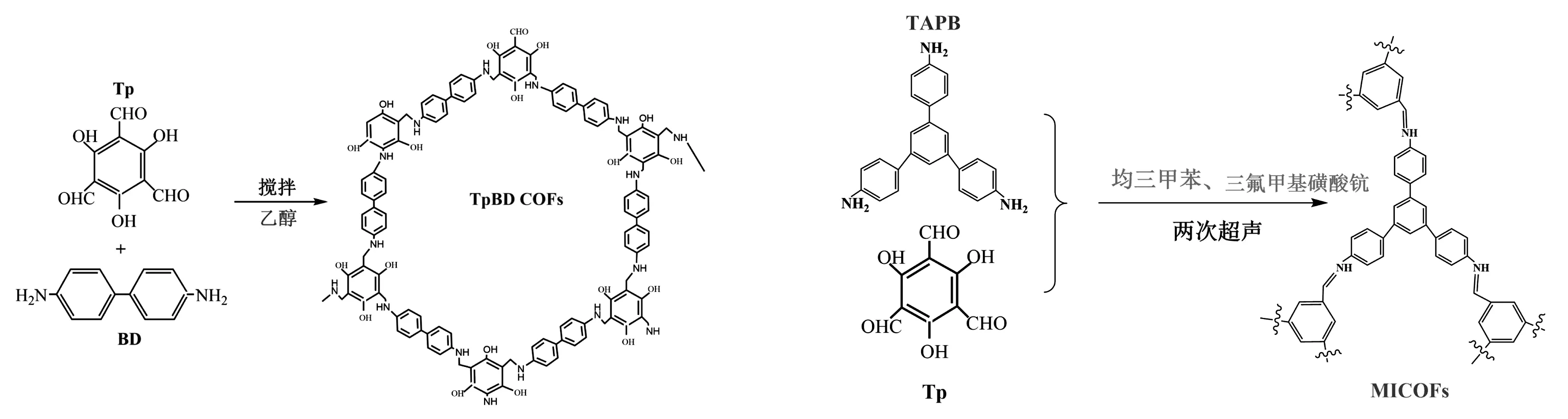
图1 两种COFs材料的制备路线Fig 1 Preparation route of two kinds of materials
1.2.3 吸附实验
(1)静态吸附
分别准确称量6份一定量的TpBD COFs、MICOFs于容量瓶中,并分别加入不同浓度梯度的重铬酸钾溶液25 mL,在298 K下恒温振荡1h(转速120 r/min),吸附实验结束后,残余的Cr(Ⅵ)浓度利用紫外可见分光光度计进行测定进而计算COFs材料对Cr(Ⅵ)的吸附量,以Cr(Ⅵ)浓度和COFs的吸附量为坐标作图,可得材料的吸附静力学曲线。吸附量计算公式为:
(1)
其中:C0为溶液中Cr(Ⅵ)的初始浓度,mg/L;Ce为平衡时浓度,mg/L;V为吸附溶液体积,L;m为材料质量,g。
(2)动态吸附实验
分别准确称取6份一定量的TpBD COFs、MICOFs于容量瓶,加入一定浓度的 重铬酸钾溶液25 mL,在298 K下恒温振荡(转速为120 r/min),且间隔相同时间取样检测溶液中残留Cr(Ⅵ)浓度并计算材料对其的吸附量。分别以时间和吸附量为横纵坐标作图,考察COFs材料的吸附量与吸附时间t的变化关系。
1.2.4 材料的表征
两种COFs的形貌采用扫描电子显微镜进行分析,材料官能团分析采用红外光谱分析方法(波数范围为470~4 000 cm-1),材料的孔结构和比表面积测定利用比表面积吸附方法实现。
2 结果与讨论
2.1 材料的形貌分析
图2为两种COFs材料的扫描电镜图。通过对外观形貌分析可知,TpBD COFs的外表多为不规则的球状,表面有很多大直径的孔道,MICOFs的外表为不均匀的丝状结构,表面有很多小直径的孔道,两种材料外表面均较为粗糙,表面孔道数量多且结构复杂,因此应具备更大的比表面积,两种材料均具备作为吸附材料的能力。且表1中关于两种材料的比表面积测定结果表明,MICOFs的比表面积大于TpBD COFs,这一测定结果也可通过材料的扫描电镜结果加以验证。

图2 两种COFs材料的SEM谱图Fig 2 SEM images of COFs materials

表1 COFs材料比表面积属性
2.2 材料的红外光谱分析
图3为COFs材料吸附前后的红外光谱对比图。TpBD COFs原先存在于818、990 cm-1处的C-H官能团发生了一定程度的蓝移,分析认为是C-H键发生了诱导效应,烷基为推电子基团;当它们连接到某个化学键或与Cr(Ⅵ)结合后,将使该键的极性改变,电子云密度减小,偶极也就减小,造成C-H吸收峰移往高波数,伸缩振动波数升高;1592 cm-1处光谱图红移,分析原因可能是在吸附了Cr(Ⅵ)后,环的键角越大,环外双键碳的s轨成分越少,使双键伸缩振动所需能量减小造成的。此外,红外谱图在3025、3340 cm-1处都发生了一定程度的蓝移,分析认为TpBD COFs在吸附Cr(Ⅵ)后,C-H、N-H键断裂,基团的键力常数变大,因此基团伸缩振动频率增大,产生蓝移。同理,MICOFs红外光谱在吸附Cr(Ⅵ)后在819 cm-1处发生了小程度的红移,分析认为MICOFs材料的骨架结构小,环的键角占主导地位,环的键角越大,环外双键碳的s轨成分越少,使双键伸缩振动所需能量减小,所以波数降低;在3 346 cm-1处红外光谱产生了小程度的红移,应是TAPB的N含量较多,由于TAPB中含N基团较大,会使键角发生变化,使双键的p轨成分增多,造成伸缩振动波数减小。
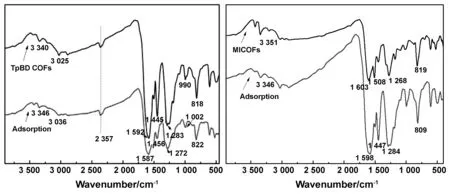
图3 两种COFs材料吸附Cr(Ⅵ)前后的FTIR谱图Fig 3 FTIR spectra of two COFs before and after adsorption of Cr (Ⅵ)
通过红外谱图比较可知,两种COFs材料吸附前后的移动幅度较小,吸附只发生在材料的表面;分析认为COFs材料对Cr(Ⅵ)的作用机理主要是COFs材料中的羟基、酯基、氰基和双键共同作用的结果。
2.3 吸附行为研究
2.3.1 COFs材料的吸附平衡分析
通过对图4两种COFs材料对Cr(Ⅵ)吸附平衡曲线分析可知,两种材料的吸附过程均为快速吸附-吸附平缓-吸附饱和的过程,以TpBD COFs材料为例,在吸附前期(0~5 min)时,吸附量随着时间的变化而快速增大,分析原因是在前期时材料可提供的吸附位点很多,随着吸附实验的进行,在吸附中期(5~20 min)吸附量逐渐趋于平缓,在吸附后期(20~50 min)吸附位点全部被重金属Cr(Ⅵ)占据后,吸附量不随时间的变化而变化,说明吸附达到平衡。此外从放大图可知,MICOFs的吸附平衡时间(10 min)比TpBD COFs短(20 min),分析认为MICOFs孔结构更丰富,能够实现对Cr(Ⅵ)的快速吸附,但两种材料均可以实现对Cr(Ⅵ)的短时快速吸附,这一结论也可通过扫描电镜和比表面积测定加以证明。
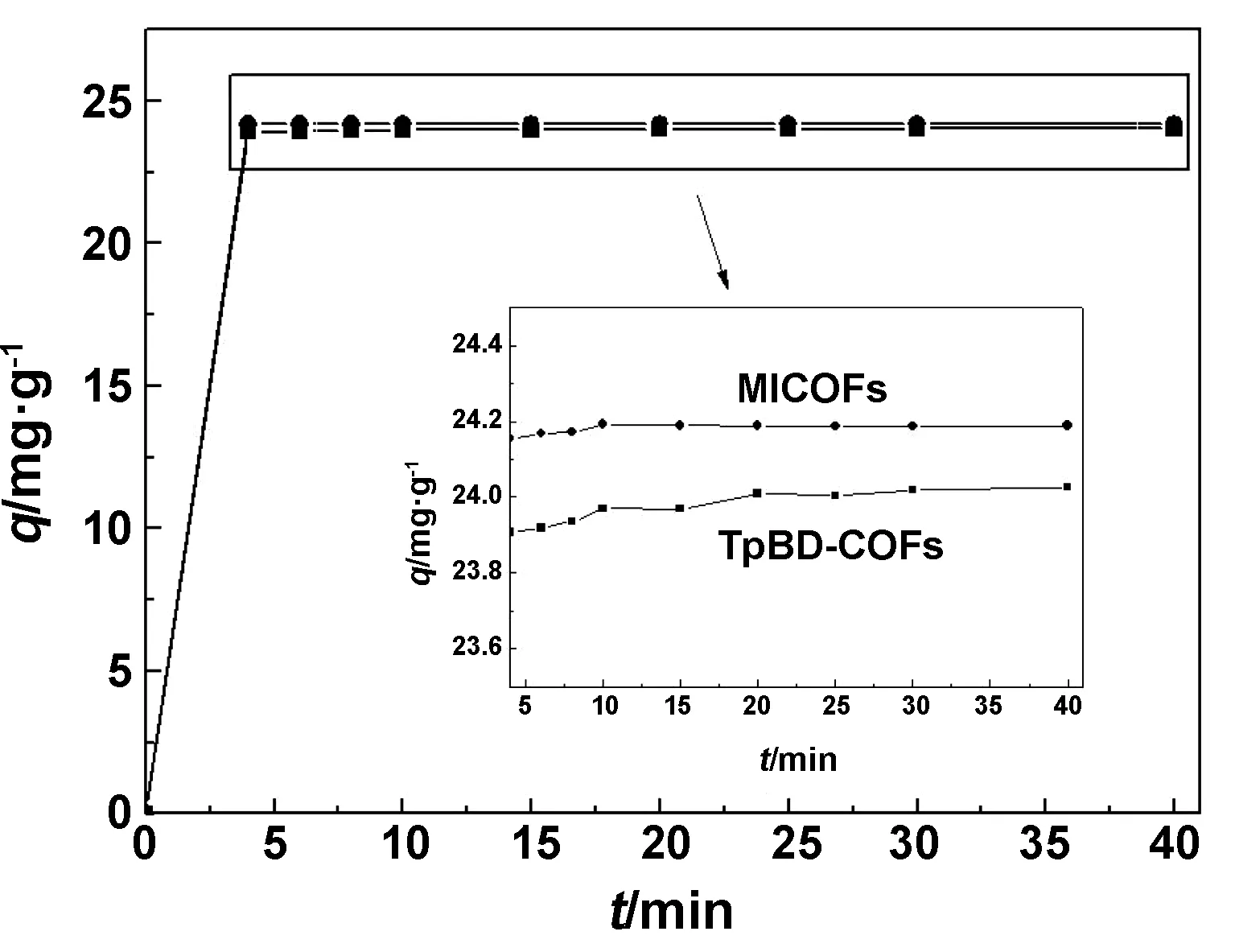
图4 吸附平衡曲线Fig 4 Adsorption equilibrium curve
2.3.2 材料的吸附动力学行为分析
分别采用准一级动力学模型[19]和准二级动力学模型[20]对两种COFs材料的吸附动力学行为进行考察,吸附动力学实验拟合结果如表2所示。

表2 吸附动力学方程及参数
由表2不同类型吸附动力学方程拟合相关系数比较可知,TpBD COFs、MICOFs的动力学吸附行为均更符合准一级动力学模型,这表明两种材料在吸附过程中不涉及化学变化,即吸附剂与吸附质之间无电子转移,为单一作用下的物理吸附,吸附效果主要依靠COFs材料的多孔结构以及较大的比表面积。
2.3.3 材料的吸附静力学行为
分别采用Langmuir模型[21]和Freundlich模型[22]考察两种材料的静态吸附行为,并将吸附实验结果进行拟合,拟合曲线结果在表3列出。

表3 吸附静力学方程及参数
对表3数据分析可知,两种COFs材料的静态吸附行为均更符合Langmuir等温吸附模型,表明两种COFs材料对Cr(Ⅵ)的吸附行为属于单分子层的表面吸附,吸附行为发生在吸附材料的表面,这与红外分析、动力学行为分析得出的结论是一致的,同时也说明两种材料的吸附行为是吸附质与吸附位点相互对应的。
3 结 论
实验制备了两种共价有机骨架材料TpBD COFs、MICOFs,并对两种材料的结构进行了表征分析,同时考察了COFs材料吸附Cr(Ⅵ)的吸附行为,得出如下结论:
(1)采用水热合成法以三醛基间苯三酚为合成单体可制备两种COFs材料(TpBD COFs、MICOFs),且材料具备丰富的孔道,比表面积大;两种材料对Cr(Ⅵ)的作用机理主要是COFs材料中的羟基、酯基、氰基和双键共同作用的结果;
(2)TpBD COFs、MICOFs对Cr(Ⅵ)的吸附平衡时间分别为20、10 min,动力学行为符合准一级动力学模型,静力学符合Langmuir等温吸附模型,分析认为两种材料在吸附过程中不涉及化学变化,吸附过程均发生在两种材料的表面。
(3)制备的两种材料具有孔道丰富、比表面积大、吸附效果理想的特点,且制备条件简单;并且可以实现对重金属Cr(Ⅵ)的短时快速吸附。实验研究成果可为重金属的有效去除提供参考,并对处理工业废水中重金属离子有一定的应用价值。

