拮抗芽孢杆菌对蒙古黄芪主要药效成分的影响
郭 捷,田海娇,秦雪梅,赵晓霞,高 芬
(1山西省科技资源与大型仪器开放共享中心,太原 030006;2山西大学中医药现代研究中心,太原 030006;3山西大学应用化学研究所,太原 030006)
0 引言
黄芪为豆科植物蒙古黄芪(Astragalus membranaceus var.mongholicus)或膜荚黄芪(Astagalus membranaceus)的干燥根,具有补气固表、利尿托毒、排脓、敛疮生肌等功效。在临床上应用广泛,具有免疫调节、降血糖、抗炎、抗氧化、抗病毒等多种药理作用[1],其主要活性成分包括黄酮类化合物、皂苷类化合物、黄芪多糖等[2]。但是,随着黄芪用量的急剧增长,多年生传统黄芪(野生)远远不能满足需求,并急剧减少,几乎绝迹。随着中药现代化的发展,20世纪70—80年代育苗移栽2年生蒙古黄芪的栽培技术在甘肃、内蒙、山西等地获得成功[3]。2012年黄芪纳入药食同源目录,年需求量达3.5万~4万t,其中90%以上为移栽黄芪,且主要是蒙古黄芪[4]。山西作为蒙古黄芪的主产区,移栽芪的种植面积日趋扩大,但随之而来被称为“植物癌症”的根腐病发生逐年加重[5-6],给黄芪产业的发展造成了明显影响。
同时,研究人员还发现移栽芪中某些药效成分明显低于(仿)野生芪。如杜国军等[3]报道传统黄芪的毛蕊异黄酮葡萄糖苷和总多糖含量明显高于2年生移栽黄芪;刘凤波等[7]发现野生黄芪总皂苷的含量较栽培黄芪高;熊一峰等[8]比较了山西2种种植方式黄芪的次级代谢产物的差异后,发现传统芪中黄芪皂苷Ⅲ的含量显著高于移栽芪,移栽芪中的黄芪皂苷Ⅰ显著高于传统芪,但4种皂苷含量的总和无显著差异;Li等[9]发现野生黄芪中多糖和糖缀合物等糖类组分的含量普遍高于速生黄芪。药材中的化学成分是其发挥药效的物质基础,药效成分的稳定性和均一性是确保中药材质量及中医临床用药安全有效的关键[10]。因此,移栽芪药效成分含量变化导致的药材质量不稳定及质量下降问题也成为了困扰黄芪栽培发展的瓶颈。
利用有益拮抗微生物进行病害生物防治是目前的研究热点,其中芽孢杆菌以抗逆性强、易于在植物根际定殖、对病原菌具有拮抗作用等优势,对多种作物的土传病害显示出了良好的防治效果[11-13],同时还可促进植物生长,提高产量[14-15]。不仅如此,芽孢杆菌在调节植物营养成分、改善品质方面也显示出了潜力。如吴东升[16]发现解淀粉芽孢杆菌T3可提高西瓜中可溶性糖的含量,改善其风味和品质。巩子毓等[17]在设施黄瓜的种植中施用含解淀粉芽孢杆菌SQR9的生物有机肥,明显提高了黄瓜中维生素C、可溶性糖、可溶性蛋白的含量。刘德兴等[18]也发现多粘性芽孢杆菌生物菌肥处理在提高甜瓜单果重的同时,促进了可溶性糖和维生素C含量的升高。
芽孢杆菌对中药材药效成分也有影响。Karthikeyan等[19]报道,固氮菌、芽孢杆菌和假单胞菌等根际促生细菌共同作用可以提高长春花抗癌有效成分生物碱的含量。Sharaf-Eldin等[20]报道枯草芽孢杆菌FZB24可以提高藏红花中番红花苦苷、番红花酸和藏红花醛的含量。宋胜男等[21]研究发现内生多黏类芽孢杆菌对农田人参生长和皂苷累积起着促进作用。冯世鑫等[22]发现枯草芽孢杆菌肥施用后罗汉果中的主效成分皂苷Ⅴ含量明显升高。目前,虽未见芽孢杆菌对蒙古黄芪有效成分影响的相关报道,但有研究发现,非生物诱导子水杨酸(SA)、萘乙酸(SNP)和硝普钠(NAA)可分别有效提高其黄酮、皂苷及多糖的含量[23]。
鉴于黄芪作为药用植物在生产和用途上的特殊性,在病害防治中使用的制剂既要能有效防治病害,又不能影响药材的品质。菌株SXKF16-1(Bacillus atrophaeu)[24]和 SXKF16-2(B.methylotrophicus)是本课题组前期以根腐病致病菌腐皮镰刀菌(Fusarium solani)和锐顶镰刀菌(F.acuminatum)为靶标筛选获得的2株拮抗芽孢杆菌,其发酵液对黄芪根腐病具有较好的预防和治疗效果。但是,上述菌株的发酵液施用后对黄芪药效成分的影响,以及能否提升某些药效成分的含量等问题还不明确。本研究采用课题组前期建立的HPLC-UV-ELSD法,测定并分析上述2株拮抗芽孢杆菌发酵液施用后,蒙古黄芪10种主要药效成分(黄酮类包括毛蕊异黄酮苷、芒柄花苷、紫檀烷苷、异黄烷苷、毛蕊异黄酮、芒柄花素;皂苷类包括黄芪皂苷IV、黄芪皂苷III、黄芪皂苷II和黄芪皂苷I)的含量变化,以明确其对黄芪药效成分的影响,进而寻找药效成分的促进因子,旨在为开发具有抗病增效作用的多功能制剂提供依据。
1 材料与方法
1.1 供试材料
蒙古黄芪(以下简称黄芪)生长6个月的新鲜健康黄芪(根长15 cm左右,直径3~4 mm),采自山西宁武黄芪种植基地。黄芪品种由山西大学中医药现代研究中心秦雪梅鉴定。
拮抗菌为菌株SXKF16-1(Bacillus atrophaeus)、菌株SXKF16-2(B.methylotrophicus),由本课题组前期筛选获得并保存。
1.2 仪器与试剂
Waters e2695液相色谱仪、Waters 2489紫外可见检测器、Chromachem ELSD检测器、Empower色谱工作站;RE-52A旋转蒸发仪(上海亚荣生化仪器厂);Sartorius BSA124S分析天平。
乙腈(色谱纯,美国Fisher公司);甲醇(色谱纯,美国Fisher公司)。
对照品毛蕊异黄酮葡萄糖苷(CAS No.20633-67-4)、芒柄花素(CAS No.485-72-3)、黄芪皂苷 I(CAS No.84680-75-1)、黄芪皂苷 II(CAS No.84676-89-1)、黄芪皂苷III(CAS No.84687-42-3)、黄芪皂苷IV(CAS No.84687-43-4)、紫檀烷苷(CAS No.94367-42-7)和异黄烷苷(CAS No.94367-43-8)均购于上海永恒生物科技有限公司;芒柄花苷(CAS No.486-62-4)、毛蕊异黄酮(CAS No.20575-57-9)购于成都曼斯特公司;质量分数均大于98%。
1.3 试验方法
1.3.1 拮抗菌发酵液的制备与浇注 分别将拮抗芽孢杆菌SXKF16-1、SXKF16-2在PDA培养基上活化48 h(28℃),配制成浓度为1.5×107~2.0×108cfu/mL的菌悬液,按体积比4%的比例接种到50 mL(250 mL三角瓶)的专用发酵培养基中,摇床恒温振荡培养48 h(180 r/min,30℃),用血球计数板计数拮抗菌数量后,用于黄芪苗的浇注。黄芪幼苗移栽40天后浇注拮抗菌发酵液;每盆300 mL,浇注3次,每次间隔10天;第3次浇注后20天采集样本并置于液氮速冻15 min后,于-80℃冰箱保存备用。对照组黄芪浇注相同体积的水。花盆内径17 cm、高15 cm,齐沿将土装满;每处理3次重复(3盆),每盆15株;从每重复中随机采样5株,共计15株进行测定。
1.3.2 供试品溶液的制备 将各处理黄芪样品晾干,用研钵研磨后过筛;精确称取黄芪粉末1.5 g,置于250 mL圆底烧瓶中,加入60 mL甲醇加热回流3 h后过滤;滤渣用20 mL甲醇冲洗3次,合并滤液,旋转至干;用色谱纯甲醇溶解试样,超声2~3 min使其充分溶解后,转移至5 mL容量瓶中定容[3];用0.22 μm有机相滤膜过滤,上机测定。
1.3.3 色谱条件 按照课题组前期已建立的方法[8]进行测定。流动相为乙腈(A)-水(B),体积流量为1.0 mL/min;蒸发光检测器参数N2压力158.5 MPa,雾化温度35℃,汽化温度50℃,增益值5.0;Venusil MP C18色谱柱(250 mm×4.6 mm,5 μm),紫外检测波长230 nm,柱温25℃,进样量20 μL。梯度洗脱:0~8 min,20%A;8~15 min,30%A;15~30 min,30%~43%A;30~40 min,43%~60%A;40~60 min,60%~100%A;60~65 min,100%~20%A。
1.3.4 标准曲线的绘制 分别精确称取对照品毛蕊异黄酮葡萄糖苷、芒柄花苷、紫檀烷苷、异黄烷苷、毛蕊异黄酮、芒柄花素和黄芪皂苷Ⅳ、Ⅲ、Ⅱ、I于10 mL容量瓶中,甲醇溶解定容,配制成浓度为1.870、1.360、1.362、0.601、0.552、1.254、0.979、0.500、0.582、1.972 mg/mL的贮备液。贮备液分别逐级稀释,配制成系列浓度并经0.45 μm滤膜过滤后,进样20 μL测定并绘制标准曲线。6种黄酮类成分,以横坐标为进样量(浓度)(X)、纵坐标为峰面积(Y)进行线性回归;4种皂苷成分,以进样量(浓度)的对数(x)为横坐标、峰面积的对数(y)为纵坐标进行线性回归;回归方程及其线性范围见表1,对照品色谱图见图1。
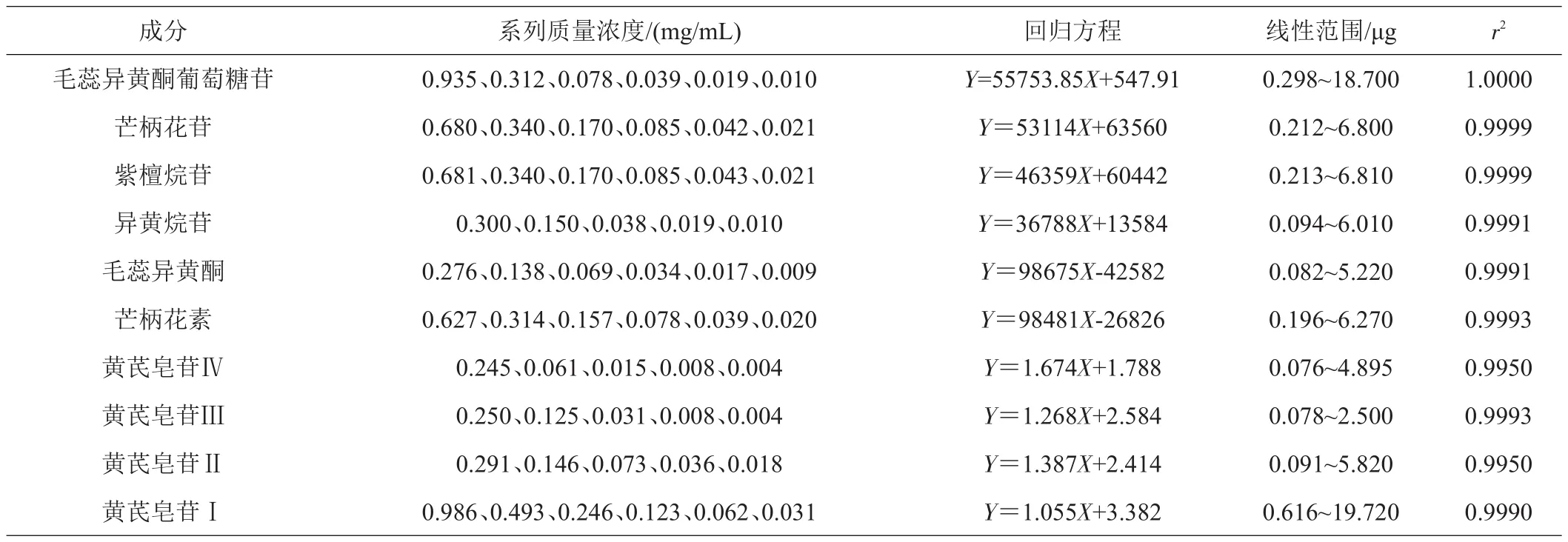
表1 黄芪10种药效成分的回归方程
1.3.5 样品测定 取各组次样品按1.3.2处理后测定。黄酮类成分对照品溶液和供试品溶液分别进样20 μL;皂苷类成分对照品溶液、供试品溶液分别进样10、20 μL。记录色谱峰的峰面积,用外标法计算各成分的含量。样品色谱图见图1。
1.3.6 数据处理 采用Microsoft Excel 2016处理数据,SPSS 16.0进行方差分析。各处理间每个组分的显著性差异比较采用Duncan’s新复极差检验(P<0.05)。
2 结果与分析
2.1 HPLC-UV-ELSD测定结果
图1 中不同处理的10种成分在2种检测器中得到了良好的响应,且出峰时间基本一致。毛蕊异黄酮葡萄糖苷、芒柄花苷、紫檀烷苷、异黄烷苷、毛蕊异黄酮、芒柄花素、黄芪皂苷Ⅳ、黄芪皂苷Ⅲ、黄芪皂苷Ⅱ和黄芪皂苷Ⅰ的保留时间分别为9.789、19.398、21.14、21.917、24.298、35.014、25.455、26.03、31.096、38.713 min,各色谱峰的峰形良好,与前后峰的分离度符合要求,基线也较为平坦,能够满足不同成分含量变化测定的要求。测定完成后,将6种黄酮的含量相加得到总黄酮的含量,4种皂苷的含量相加得到总皂苷含量。
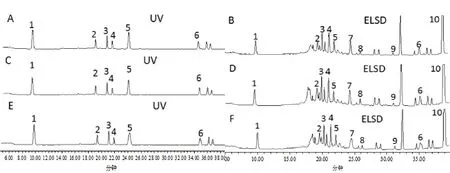
图1 黄芪10种药效成分的HPLC图谱
2.2 芽孢杆菌对黄芪药效成分的影响
与对照组相比,黄芪幼苗浇注芽孢杆菌SXKF16-1和SXKF16-2的发酵液后,毛蕊异黄酮葡萄糖苷、芒柄花苷、紫檀烷苷、异黄烷苷、毛蕊异黄酮、芒柄花素、黄芪皂苷Ⅱ、黄芪皂苷Ⅳ的含量均无明显变化,而黄芪皂苷Ⅰ和黄芪皂苷Ⅲ的含量在2株菌发酵液浇注处理后均显著升高(表2)。同时,SXKF16-1和SXKF16-2处理间对毛蕊异黄酮和芒柄花素的影响存在差异,前者的处理组中这2种成分的含量均显著高于后者。从总黄酮和总皂苷含量的变化看,2株拮抗芽孢杆菌处理后总黄酮含量与对照组差别不明显,总皂苷的含量相较于对照组明显升高(图2)。
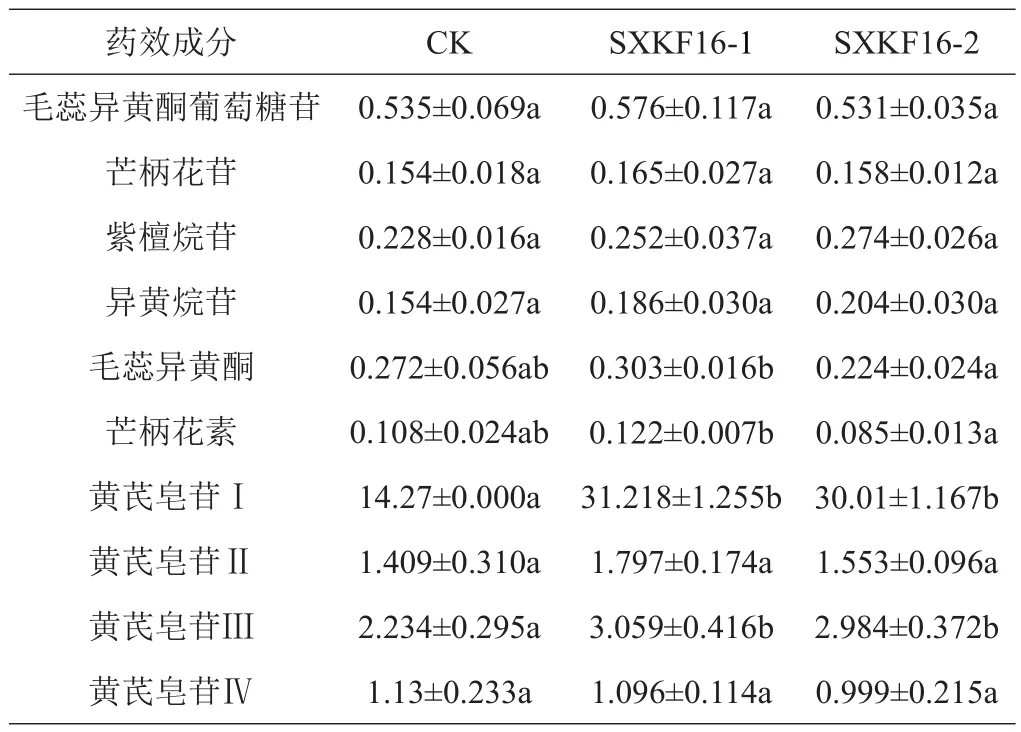
表2 芽孢杆菌处理组与对照组黄芪中10种成分的含量比较 mg/g
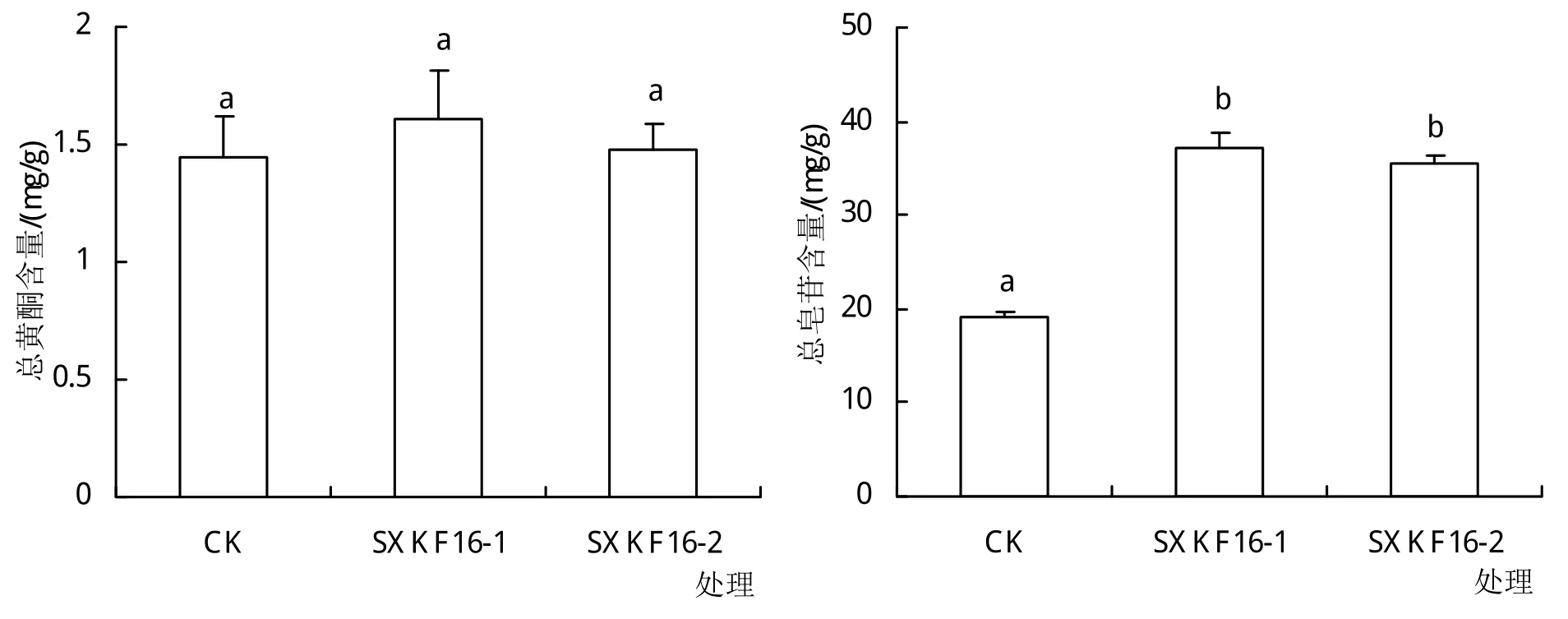
图2 芽孢杆菌处理组与对照组黄芪总黄酮和总皂苷含量比较
3 讨论
研究结果表明,拮抗芽孢杆菌SXKF16-1和SXKF16-2的发酵液浇注黄芪幼苗后,其根内总黄酮成分含量都没有明显变化,但是总皂苷类成分含量均明显升高,这一变化主要来源于黄芪皂苷Ⅰ和黄芪皂苷Ⅲ含量在2组处理中的显著升高。可见,菌株SXKF16-1和SXKF16-2对黄芪部分皂苷类药效成分有促进积累的作用。在黄酮类成分毛蕊异黄酮和芒柄花素的测定中发现,尽管2株菌处理后这2种成分的含量变化与对照相比无明显差异,但不同的菌株处理间呈现出了差异性的变化。这一现象表明,不同的芽孢杆菌对黄芪药效成分的影响并不完全相同,其原因可能在于不同的芽孢杆菌与黄芪的互作机制不同,进而造成黄芪药效成分产生或积累的差异。同时需注意的是,本研究测定的是拮抗菌发酵液整体对黄芪药效成分的影响,体现的是菌体和发酵代谢产物共同作用的效果。因此,具体是何种因素对黄芪药效成分的代谢变化起到主要作用,还需进一步研究。
叶如梦等[25]在营养土环境中接种枯草芽孢杆菌B117显著降低香蜂花总酚及迷迭香酸(RA)的含量,在相对贫瘠环境中接菌则没有显著影响,推测该菌株对香蜂花次级代谢产物的作用依赖于土壤营养条件。由此,在后期深入评价菌株SXKF16-1和SXKF16-2对黄芪药效成分含量的影响时,还应考虑施用地土壤因素的作用。
测定中药材有限成分的含量并不能全面、准确地反映其质量的优劣[26],本研究仅针对黄芪的10种主要药效成分进行测定,无法反映其活性成分的整体变化。近年来,以组群指标分析为基础的植物代谢组学技术在分析植物在非生物或生物胁迫下的应答机制方面已经取得了很大进展[27],并在中药材质量的整体评价中显示出了巨大优势[26]。利用该技术研究芽孢杆菌对药用植物活性成分的影响,将更有利于从整体变化的层面来准确评价其作用。
另外,本试验中黄芪皂苷I的含量较其他文献中报道的偏高。由文献可知,黄芪中皂苷80%以上分布在表皮[28],且总皂苷生长3年含量达到最高,除3年生黄芪外,皂苷含量随着生长时间的延长含量逐渐降低[29],可见黄芪的生长时间对皂苷含量有显著影响。本试验所用黄芪的生长时间仅有6个月,根相对较细,表皮在根重中占有较大的比例,这可能是导致所测得的皂苷含量与其他报道不尽一致的直接原因。
4 结论
黄芪根腐病拮抗芽孢杆菌SXKF16-1和SXKF16-2发酵液的施用,对黄芪黄酮类活性成分的积累无显著影响,但可促进皂苷类成分特别是黄芪皂苷Ⅰ和黄芪皂苷Ⅲ含量的升高,表明供试芽孢杆菌具有提高移栽黄芪药效成分,改善其品质的潜力,但不同菌株的作用效果具有一定差异。研究结果为将上述菌株开发为多功能制剂,针对性地缓解黄芪规模化生产中根腐病严重发生和主要药效成分含量降低的问题,提供了有效的理论依据。

