解淀粉芽孢杆菌发酵红小豆的理化特性和生物活性
吴珊,卢帅,刘军,杨绍青,闫巧娟,#,*,江正强,#,*
a Key Laboratory of Food Bioengineering (China National Light Industry), College of Engineering, China Agricultural University, Beijing 100083, China
b Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
1. 引言
心血管疾病(CVD)是影响人类健康的重要因素,因CVD导致的死亡人数约占全世界死亡人数的三分之一。中风和冠心病主要是由血管阻塞引起的,血管阻塞会阻止血液流入大脑或心脏。因此,溶栓治疗是预防CVD的有效方法[1]。在过去几十年中,许多研究人员致力于安全和低价的抗血栓食品。发酵可以提高大豆食品的纤溶酶活性,包括中国的豆豉、日本的纳豆和韩国的大豆酱[2]。由于微生物的作用使发酵大豆食品在风味和质地上有显著改变[3]。细菌,特别是芽孢杆菌,是重要的产纤溶酶菌。已从食品中分离出产纤溶酶芽孢杆菌,如枯草芽孢杆菌[4]、解淀粉芽孢杆菌[5-7]、死亡谷芽孢杆菌Ace02 [8]和巨大芽孢杆菌KSK-07 [9]。枯草芽孢杆菌发酵的大豆在体内和体外均具有抗血栓形成作用[4,10]。解淀粉芽孢杆菌与枯草芽孢杆菌亲缘性高,从中国的豆豉和韩国的酱油等发酵食品可以筛选到[5,10]。解淀粉芽孢杆菌发酵过程中可生成一种纤溶酶-枯草杆菌蛋白酶[7]。许多豆类和谷物经芽孢杆菌发酵后,营养物质和活性成分以及生物活性都得到显著提升[11]。迄今,采用解淀粉芽孢杆菌固态发酵提升食物溶栓和抗凝血活性的相关研究较少[6]。
红小豆是一种生存能力较强的豆类,具有抗旱性,生长周期较短并且栽培技术较简单。红小豆起源于亚洲热带地区,在印度、韩国、日本和中国华南地区都有种植。与同一种属的其他豆类相比,红小豆中的营养和活性物质含量较高[12]。红小豆中富含酚类化合物,并具有抗氧化活性和降血糖等多种生理活性[13]。目前,大众对红小豆的接受程度较低,而红小豆的高营养品质使其在食品市场上具有很大的发展潜力[14]。固态发酵具有生产率高、能耗低、发酵过程易于控制和无菌要求低的优点[15]。本研究采用解淀粉芽孢杆菌固态发酵红小豆,并分析发酵对红小豆的理化特性和抗氧化、降血糖、抗血栓等生物活性的影响。
2. 材料和方法
2.1. 实验材料、试剂和菌种
红小豆购自中国北京某超市,4 ℃下储存直至使用。福林(Folin)-酚试剂、没食子酸、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、2,2-二苯基-1-苦肼基(DPPH)、2,2-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、三吡啶基三嗪(TPTZ)、尿激酶(10 KU,来自人肾细胞)、纤维蛋白原、二肽基肽酶IV(DPP-IV)和凝血酶(来自牛血浆)购于西格玛奥德里奇公司(加拿大)。肝素钠、芦丁和阿卡波糖由拜尔迪生物技术有限公司(中国)提供。
解淀粉芽孢杆菌CAUNDJ118筛选自蘑菇酱,2018年7月3日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCC NO.16050。
2.2. 红小豆的发酵和提取
50 g红小豆在去离子水中浸泡18 h。浸泡后的红小豆在121 ℃下蒸煮,冷却后接种不同浓度的解淀粉芽孢杆菌CAUNDJ118,40 ℃下固态发酵,根据纤溶酶活性优化发酵条件。未接种解淀粉芽孢杆菌CAUNDJ118的红小豆作为空白对照。发酵和未发酵的样品冷冻干燥后,分别用去离子水[1/5(V/V)]、80%(V/V)乙醇和0.5% HCl的甲醇溶液进行萃取,收集提取液并在-20 ℃下保存备用。
2.3. 纤溶酶活性的测定
采用下述两种方法分析纤溶酶活性。方法一为纤维蛋白降解方法[16],冻干样品按1/10 (m/V)加入生理盐水,25℃水浴浸提2 h (200 r·min-1),离心(10 000 r·min-1, 10 min)取上清液。分别取1.4 mL硼砂缓冲液(50 mmol·L-1, pH 8.5)和0.4 mL纤维蛋白原溶液(0.72%,m/V),混合后于37 ℃预热5 min,加入0.1 mL凝血酶溶液(20 U·mL-1)于37 ℃水浴中反应10 min。加入适当稀释的样品上清液0.1 mL,于37 ℃水浴中继续反应60 min后,加入0.2 mol·L-1三氯乙酸溶液2 mL终止反应,10 000 r·min-1离心10 min取上清液,275 nm下测定吸光值。将纤溶酶活性分析过程中先加入三氯乙酸终止反应后加入待测样品上清液作为对照。每分钟在275 nm处吸光度增加0.01所需酶量定义为1个纤维蛋白降解酶活力(FU)单位。纤溶酶活性表示为FU·g-1鲜重。
方法二是纤维蛋白平板法[17]。在硼酸盐缓冲液中加入5 mL 0.4%纤维蛋白原、5 mL 0.8%琼脂糖和1 mL凝血酶(200 U·mL-1),混匀后制备纤维蛋白平板。以尿激酶标准品制作标准曲线,计算样品的纤溶酶活力相当量,结果表示为IU·g-1鲜重。
2.4. 红小豆的物理性质
参照Shih等[18]的方法测定解淀粉芽孢杆菌发酵红小豆和未发酵红小豆的硬度。将未发酵和发酵的红小豆置于25 ℃室温,采用质构仪(TMS-PRO;FTC,美国)测定硬度。测定方法:负载单元为25 000 g,探头为TA4/1000 38.1-mm D,样品平行放置,压缩形变量为60%,触发点负载为5 g,测试速度为1 mm·s-1,每个样品平行测定9次后取平均值。第一次下压区段内的最大力值即为样品的硬度(g)。采用黏度计(DV-1黏度计;中国岳平)测定发酵红小豆的动态黏度。将10 g样品于100 mL去离子水中振荡30 min提取黏稠物质,将20 mL提取物放入烧杯中测量黏度。采用扫描电子显微镜(SEM, S-3400N; HITACHI, Japan)观察样品的微观结构,将样品冻干粉进行镀金膜处理,加速电压为5 kV,放大倍率是1000×。
2.5. 红小豆的化学特性
采用3,5-二硝基水杨酸(DNS)法测定样品中还原糖含量[19],以葡萄糖为标准品制作标准曲线,还原糖含量表示为g葡萄糖·100 g-1干豆。采用邻苯二醛法测量样品中多肽含量[20],以Gly-Leu二肽为标准品绘制标准曲线。采用福林-酚比色法[13]分别测定样品的醇提物(乙醇)总酚含量和总黄酮含量。使用pH示差法[21]测定样品的0.5% HCl-醇提物(甲醇)中的花青素含量。制备样品水提物,采用超氧化物歧化酶(SOD)试剂盒(南京建城生物工程研究所,中国)测定水提物的SOD活性。将粉末状样品进行酸水解处理,使用日立L-8900氨基酸分析仪结合离子交换色谱和茚三酮柱后衍生法测定样品中的氨基酸组成及含量[22]。采用17种氨基酸标准溶液(0.2 mmol·L-1)制作的标准曲线进行定量,样品的氨基酸含量表示为mg·g-1干重。
2.6. 抗氧化、α-葡萄糖苷酶抑制、DPP-Ⅳ抑制和抗凝血活性分析
采用Dudonné等[23]的方法对样品水提物和醇提物(乙醇)的抗氧化活性进行分析,测定DPPH和ABTS自由基清除活性和铁离子还原抗氧化能力(FRAP),结果表示为μmol Trolox·g-1干重。
参照Shukla等[24]的方法测定样品醇提物(乙醇)的α-葡萄糖苷酶抑制活性。将磷酸盐缓冲液(0.1 mol·L-1, pH 6.8, 50 μL)、样 品(30 μL)和α-葡 萄 糖 苷 酶(1.5 U·mL-1, 30 μL)的反应溶液在37 ℃恒温箱中保温10 min。加入硝基苯基-α-D-吡喃葡萄糖苷(0.5 mmol·L-1, 40 μL)开始反应,在37 ℃恒温箱中保温40 min后加入Na2CO3(0.2 mol·L-1, 80 μL)终止反应。以不添加提取物样品的反应液作为样品对照,以不添加α-葡萄糖苷酶的反应液作为空白对照。测量反应液在405 nm处的吸光度,以阿卡波糖为阳性对照。根据公式(1)计算α-葡萄糖苷酶抑制活性:

式中,Acontrol为不添加提取物样品的反应液的吸光度;Asample为含样品反应液的吸光度;Acontrolblank为不添加α-葡萄糖苷酶的空白溶液的吸光度。
样品水提取物的DPP-Ⅳ抑制活性参照Wang等[25]的方法进行测定,样品提取液用0.1 mol·L-1Tris-HCl缓冲液(pH 8.0)稀释后(25 μL)与25 μL 1.6 mmol·L-1Gly-Pro-对硝基苯胺溶液混合,在37 ℃恒温箱中保温10 min。加 入50 μL DPP-Ⅳ(8 U·L-1)后 将 反 应液在37 ℃下放置60 min,加入100 μL乙酸钠缓冲液(1 mol·L-1, pH 4.0)终止反应。测量反应液在405 nm处的吸光度,根据公式(2)计算样品的DPP-Ⅳ抑制活性:

式中,AB为不添加样品提取液的反应液吸光度(空白组);ABC和ASC分别为不添加DPP-Ⅳ的空白对照和样品对照的反应液吸光度;AS为样品组或阳性组的吸光度。
抗凝活性采用96孔微孔板法进行测定[26]。根据公式(3)进行计算抗凝活性:

式中,AC为不添加样品的空白对照组反应液的吸光度(缓冲液代替样品);AS为样品组反应液的吸光度;ACB和ASB分别为不添加凝血酶(缓冲液替代凝血酶)的空白对照和样品对照组反应液的吸光度。
2.7. 统计分析
所有实验均重复3次。结果以平均值±标准偏差表示。采用SPSS 20.0软件(SPSS Chicago, IL, USA)对实验数据进行单因素方差分析(ANOVA)和多重比较分析(Duncan),p< 0.05表示各组间差异显著。
3. 结果与讨论
3.1. 红小豆发酵条件的优化
红小豆蒸煮10~50 min后接种解淀粉芽孢杆菌,接种量为1×105CFU·100g-1。固态发酵24 h后分析发酵红小豆的理化特性和纤溶酶活性。如图1(a)所示,随着蒸煮时间的增加,红小豆硬度降低(从2798 g到1058 g),纤溶酶活性和黏度增加。蒸煮40 min,纤溶酶活性(73.7 FU·g-1)和黏度(68.0 mPa·s)达到最大值。此外,本研究考察了活菌数和发酵时间对纤溶酶活性、硬度和黏度的影响,如图1(b)和(c)所示,当活菌数为107CFU·100g-1、发酵时间为24 h时,最大的纤溶酶活性和黏度分别为78.0 FU·g-1(4890 IU·g-1,纤维蛋白平板法)和76.0 mPa·s,且发酵红小豆的感官特征、黏度和风味与日本传统的发酵大豆制品纳豆相似[10],发酵红小豆的“氨”臭味比纳豆淡。
在最适发酵条件下,发酵红小豆的纤溶酶活性最大达78.0 FU·g-1(4890 IU·g-1,纤维蛋白平板法)。目前尚无纤溶酶活性测定的标准方法。纤维蛋白降解法和纤维蛋白平板法是最常用的纤溶酶活性测定方法。与纤维蛋白降解法相比,纤维蛋白平板法易于操作,但灵敏度较低。为了更好地与其他研究对比,本研究同时采用纤维蛋白降解法和纤维蛋白平板法两种方法测定了解淀粉芽孢杆菌发酵红小豆的纤溶酶活性。通常,市售纳豆的纤溶酶活性为20~40 FU·g-1[27]。在鹰嘴豆的固态发酵中,最优发酵条件下纤溶酶活性达39.3 FU·g-1。研究发现其他发酵豆类也具有纤溶酶活性,如枯草芽孢杆菌和德氏乳杆菌乳酸亚种共同发酵的红豆的纤溶酶活性可达28.2 FU·g-1(纤维蛋白降解法)[2]。采用纤维蛋白降解法和纤维蛋白平板法分别测得枯草芽孢杆菌发酵木豆的纤溶酶活性达1895.1 IU·g-1和53.0 FU·g-1[16,17]。可见,解淀粉芽孢杆菌发酵红小豆的纤溶酶活性远高于商品纳豆和其他发酵豆类。
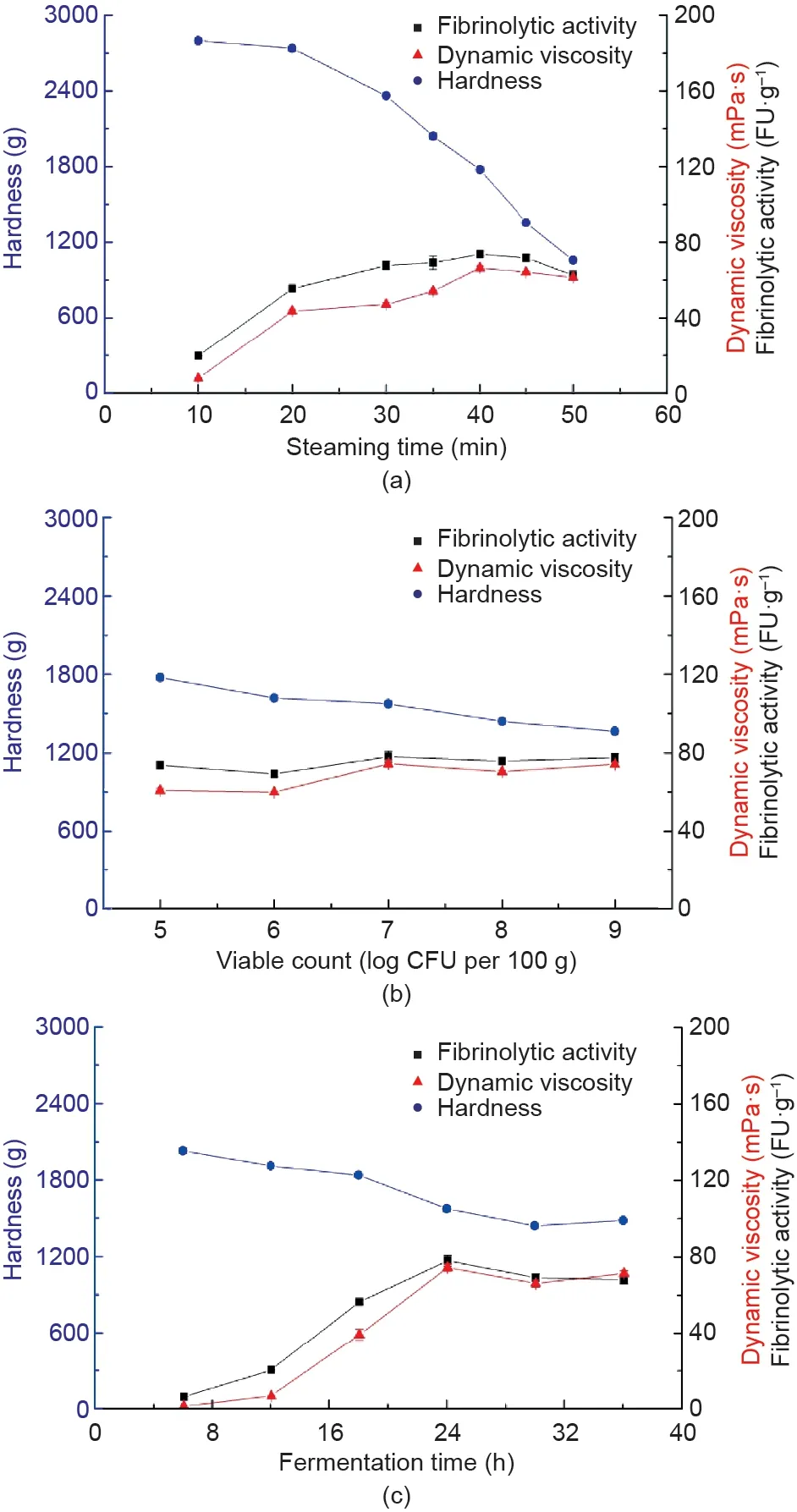
图1. 蒸煮时间(a)、活菌数(b)和发酵时间(c)对解淀粉芽孢杆菌发酵红小豆纤溶酶活性、黏度和硬度的影响。
3.2. 解淀粉芽孢杆菌发酵红小豆的理化特性
优化解淀粉芽孢杆菌发酵条件得到的红小豆,其硬度下降(2194.6 g→1575.0 g),水分含量(60.5%→64.6%)、黏度(0.5 mPa·s→65.8 mPa·s)、还原糖含量(1.9 g葡萄糖·100 g-1干重→13.9 g葡萄糖·100 g-1干重)、肽含量(2.1 g·100 g-1干重→10.9 g·100 g-1干重)增加(表1)。红小豆经解淀粉芽孢杆菌发酵后,理化特性发生显著变化,发酵红小豆的黏度是未发酵红小豆的131.6倍。Hu等[28]和Shih等[18]发现黑豆在发酵过程中黏度增加,而硬度降低。黏度是评价芽孢杆菌发酵豆类纤溶酶活性的重要指标,γ-聚谷氨酸是发酵大豆黏丝的主要成分之一[29]。本研究与Shih等[18]的研究结果一致,表明黏度与纤溶酶活性呈正相关(相关系数r= 0.986;p< 0.05,图1),解淀粉芽孢杆菌发酵红小豆的过程中产生了具有纤溶酶活性的黏性物质。
与未发酵红小豆相比,解淀粉芽孢杆菌发酵红小豆中的总酚(116.7~388.5 mg·100 g-1)、总黄酮(235.5~ 354.2 mg·100 g-1)和花青素含量(20.1~47.1 mg·100 g-1)增加了1.5~3.3倍(表1)。由于酚类化合物具有潜在的生物活性,近年来广受关注。人们可以根据饮食来源和生活习惯补充每日所需酚酸和类黄酮化合物(20~1000 mg·d-1)[30]。发酵会释放豆类中游离酚苷元,从而增加酚类化合物的总含量。研究表明发酵过程会增加黑豆(1.5倍)、鹰嘴豆(3.2倍)、大豆(1.7倍)和木豆(1.4倍)中的总酚含量(TPC)[6,16,31,32]。在枯草芽孢杆菌发酵黑豆的过程中产生的β-葡萄糖苷酶可水解酚苷元并释放出酚羟基[6]。采用解淀粉芽孢杆菌发酵红小豆的总酚含量提高了3.3倍(表1)。酚类化合物通常以结合形态存在于食品原料中,而结合型酚类化合物的生物活性通常低于游离型酚类化合物[31,33]。解淀粉芽孢杆菌发酵红小豆过程中β-葡萄糖苷酶从0.01 U·g-1提高至2.19 U·g-1(数据未列出)。因此,发酵红小豆中总酚含量的增加可能是由于细胞壁释放的结合型酚类物质引起的[23,31]。
如表1所示,发酵红小豆的SOD活性显著高于未发酵红小豆,未发酵和解淀粉芽孢杆菌发酵红小豆的SOD活性分别为55.3 U·g-1干重和263.6 U·g-1干重,经解淀粉芽孢杆菌发酵后红小豆的SOD活性提高了4.8倍。SOD具有特殊的生理活性,是生物体内清除自由基的主要物质[34]。纳豆和发酵黑豆的SOD活性较未发酵显著提高[35,36]。
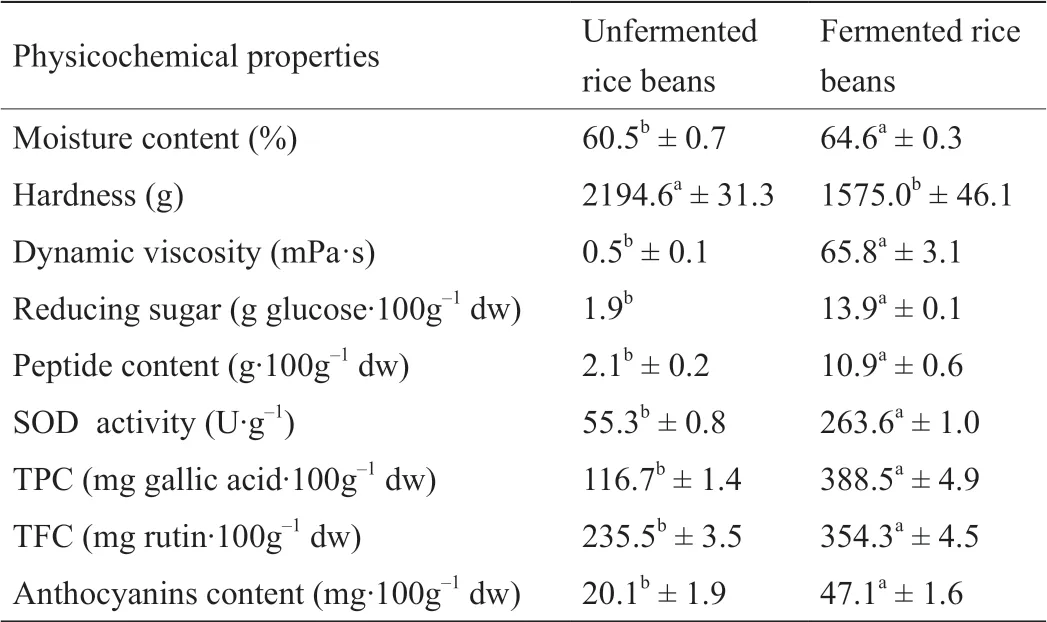
表1 未发酵和发酵红小豆的理化特性
未发酵红小豆与解淀粉芽孢杆菌发酵红小豆的氨基酸组成及含量的结果如表2所示。两个样品都富含谷氨酸(34.8 mg·g-1和42.4 mg·g-1)和天冬氨酸(24.8 mg·g-1和24.2 mg·g-1),以及必需氨基酸亮氨酸(17.7 mg·g-1和17.9 mg·g-1)和赖氨酸(16.4 mg·g-1和16.4 mg·g-1)。发酵后红小豆中精氨酸含量下降(7.8%),谷氨酸、丙氨酸、半胱氨酸、蛋氨酸和苯丙氨酸的含量分别提高了21.8%、7.8%、35.0%、38.1%和3.2%。
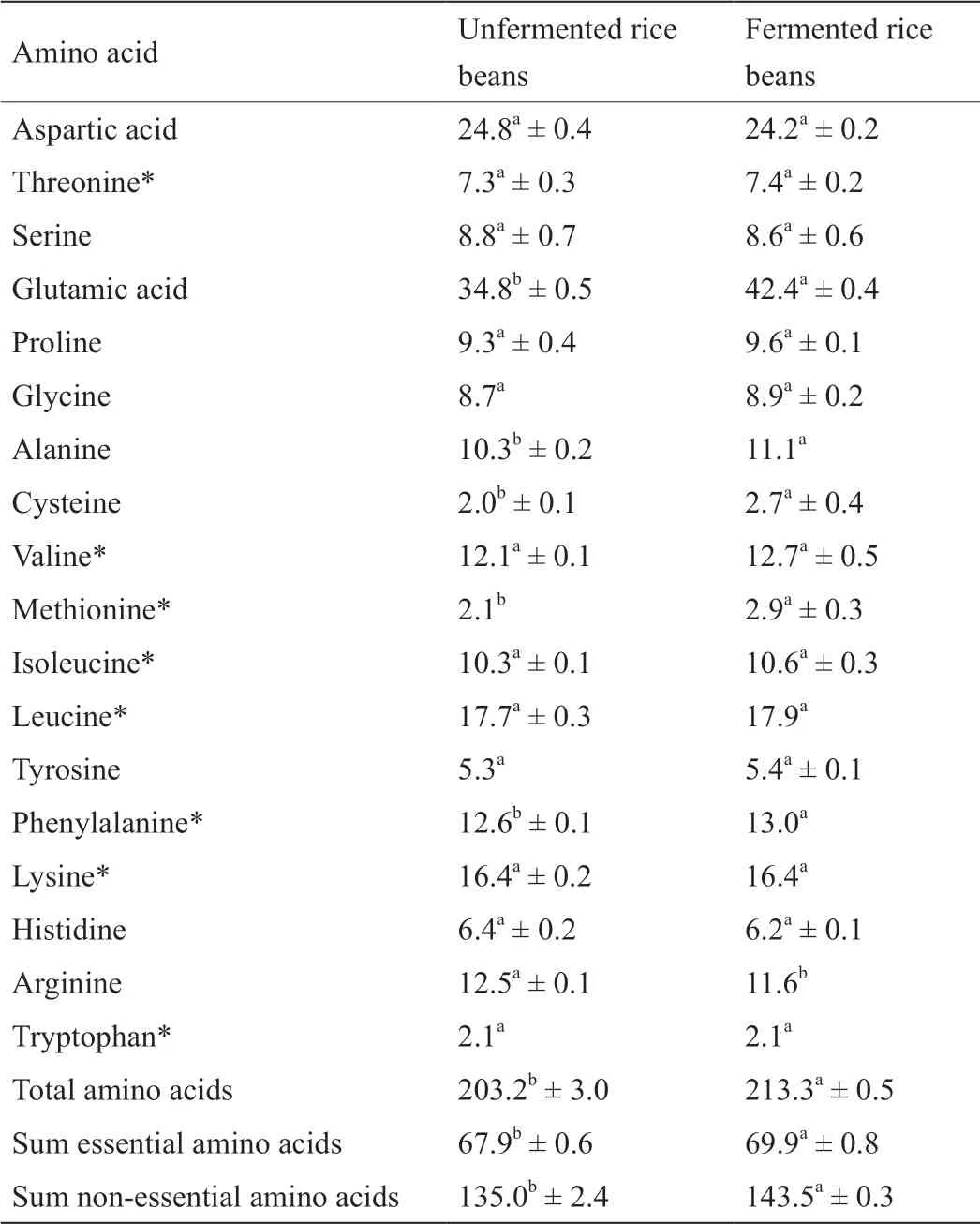
表2 未发酵和发酵红小豆的氨基酸组成
红小豆发酵前后的扫描电镜图如图2所示。可见,未发酵红小豆和发酵红小豆的表面微观结构存在显著差异。未发酵红小豆的表面虽然不平滑,但结构完整紧密[图2(a)]。而发酵红小豆颗粒骨架结构出现大面积剥落,表面结构被破坏,形成大量碎片,变得粗糙疏松,孔隙不均匀[图2(b)]。

图2. 未发酵(a)和发酵(b)红小豆冻干粉扫描电镜观察图,5 kV加速电压,放大倍数为1000×。
3.3. 发酵对红小豆生物活性的影响
3.3.1. 抗氧化活性
表3显示了未发酵和发酵红小豆的抗氧化活性。发酵红小豆的醇提物(乙醇)具有最高的DPPH(17.1 μmol Trolox·g-1)和ABTS(185.5 μmol Trolox·g-1)清除活性,以及最高的FRAP值(28.8 μmol Trolox·g-1),其次是发酵红小豆的水提物(分别为13.3 μmol Trolox·g-1、138.3 μmol Trolox·g-1和21.0 μmol Trolox·g-1)、未发酵红小豆的醇提物(乙醇)(6.9 μmol Trolox·g-1、38.6 μmol Trolox·g-1和15.2 μmol Trolox·g-1)和未发酵红小豆的水提物(3.9 μmol Trolox·g-1、29.0 μmol Trolox·g-1和10.1 μmol Trolox·g-1)。
由于自由基清除方法具有稳定的重复性和高度的准确性,许多研究都将其作为评价抗氧化活性的模型[37]。芽孢杆菌发酵鹰嘴豆的醇提物(甲醇)DPPH清除活性显著高于未发酵的鹰嘴豆[6]。用枯草芽孢杆菌发酵木豆,可提升其水提物的DPPH和ABTS清除活性以及FRAP值。红小豆经解淀粉芽孢杆菌固体发酵后,其醇提物(乙醇)的DPPH、ABTS清除活性和FRAP值分别提高了2.5倍、4.8倍和1.9倍,水提物的DPPH、ABTS清除活性和FRAP值则分别提升3.4倍、4.8倍和2.1倍。未发酵或发酵红小豆的醇提物(乙醇)的抗氧化活性显著高于其水提物(表3)。研究表明,发酵食品中的酚类化合物与抗氧化活性直接相关[37],红小豆含有多种酚类化合物,在醇提物(乙醇)中共检测到14种多酚类化合物,在水提物中共检测到10种多酚类化合物[19]。由于多酚类化合物的结构多样,不同溶剂提取的多酚类化合物组成也存在差异,这可能是解淀粉芽孢杆菌发酵红小豆的醇提物(乙醇)的抗氧化活性高于其水提物的原因。

表3 未发酵和发酵红小豆的抗氧化活性
3.3.2. α-葡萄糖苷酶抑制活性
发酵红小豆醇提物(乙醇)浓度为11.2 mg·mL-1(88.9%)时,α-葡萄糖苷酶抑制活性是未发酵红小豆(27.5%)的3.2倍[图3(a)]。
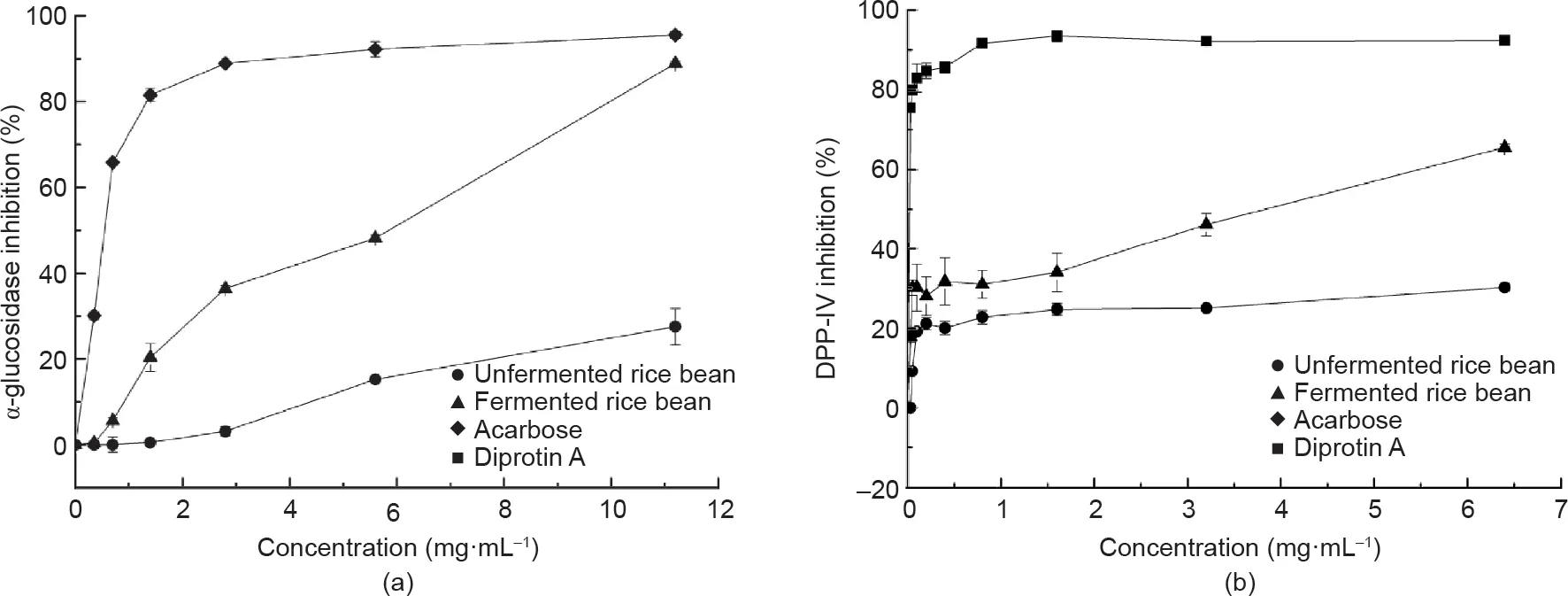
图3. 未发酵和发酵红小豆的α-葡萄糖苷酶抑制活性(a)和DPP-IV抑制活性(b),分别以阿卡波糖和抑二肽素A作为阳性对照。(a)和(b)中的样品浓度分别为0.35~11.2 mg·mL-1和0.03~6.4 mg·mL-1。
α-葡萄糖苷酶抑制剂可改善2型糖尿病[24]。多酚类物质是常见的α-淀粉酶和α-葡萄糖苷酶抑制剂[37]。研究表明,红小豆具有良好的抗糖尿病潜力[13]。解淀粉芽孢杆菌发酵处理提高了红小豆醇提物(乙醇)(11.2 mg·mL-1)的α-葡萄糖苷酶抑制活性[27.5%~88.9%;图3(a)]。红小豆醇提物(乙醇)中的多酚类和黄酮类化合物等生物活性物质随着发酵时间的增加而增加(表 1)。未发酵和发酵红小豆的水提物在同等浓度下并没有检测出α-葡萄糖苷酶抑制活性(数据未列出)。Shukla等[24]分析了多种发酵黄豆酱水提物(50 mg·mL-1)的α-葡萄糖苷酶抑制活性,然而其抑制活性较低(58.93~62.25%)。发酵红小豆的α-葡萄糖苷酶抑制活性低于阳性对照阿卡波糖[图3(a)]。与药物相比,发酵红小豆作为食品级α-葡萄糖苷酶抑制剂具有较大应用潜力。
3.3.3. DPP-Ⅳ抑制活性
红小豆水提物的DPP-Ⅳ抑制活性如图3(b)所示。在相同浓度下(6.4 mg·mL-1),发酵红小豆水提物的DPP-Ⅳ抑制率(65.6%)显著高于未发酵红小豆水提物(30.2%)。DPP-IV可抑制胰岛素分泌,通常用于预防和治疗2型糖尿病[25]。豇豆、四季豆和班巴拉豆等已用于生产DPP-Ⅳ抑制肽[38-40]。与未发酵红小豆相比,解淀粉芽孢杆菌发酵红小豆的DPP-Ⅳ抑制活性显著提高1.6~2.2倍[图3(b)]。此外,发酵红小豆中含有较多的多肽(10.1 g·100 g-1)和多酚类化合物(388.5 mg没食子酸·100 g-1;表1)。研究报道的食源性DPP-Ⅳ抑制剂多为蛋白质水解物、黄酮和酚酸类物质[41]。因此,发酵红小豆可作为潜在具有DPP-Ⅳ抑制活性或预防2型糖尿病的功能性食品原料。
3.3.4. 抗凝血活性
未发酵和发酵红小豆水提物的抗凝血活性如图4所示。发酵红小豆水提物抑制纤维蛋白的形成能力随浓度的增加而增强(14.6%~98.2%)。未发酵红小豆水提物的抗凝血活性(0~6.3%)显著低于发酵红小豆。发酵红小豆可通过抑制凝血酶活性,阻碍纤维蛋白原转变为纤维蛋白从而抑制凝血。凝血是引起血栓性疾病的重要因素,安全低价的抗凝血功能食品备受关注[42]。研究表明,碱性蛋白酶水解花生蛋白的产物在40 mg·mL-1时表现出95%的高抗凝活性[26]。由解淀粉芽孢杆菌发酵的鹰嘴豆在1 mg·mL-1时具有80%的抗凝活性,但仍低于阳性对照肝素钠[6]。本研究中,由解淀粉芽孢杆菌发酵的红小豆的水提物浓度为1 mg·mL-1时,抗凝血活性为98.2%(图4),显著高于阳性对照肝素钠(在1 mg·mL-1下为57.7%;图4)。迄今,尚无解淀粉芽孢杆菌发酵红小豆的抗凝血活性的相关报道。在临床,肝素钠、华法林和阿司匹林是常用的抗凝血药物。这些药物存在安全性问题,可引发病患严重出血[43]。从发酵大豆中分离出的纳豆激酶已被证明具有抗血栓作用[44],且动物试验和人体临床试验表明其为安全的抗血栓物质[6,9]。发酵红小豆水提物具有抗凝血活性(图4)和纤溶酶活性 (图1),可作为膳食补充剂用于血栓性疾病的预防。

图4. 未发酵和发酵红小豆的抗凝血活性。肝素钠作为阳性对照。样品浓度范围为0.03~1.0 mg·mL-1。
4. 结论
解淀粉芽孢杆菌可用于制作红小豆发酵食品的发酵剂。发酵显著改变了红小豆的理化特性。发酵红小豆的抗氧化活性、DPP-Ⅳ抑制活性和α-葡萄糖苷酶抑制活性均高于未发酵红小豆。此外,发酵红小豆的抗凝血活性也显著提高。结果表明,解淀粉芽孢杆菌发酵红小豆具有开发功能性食品的潜力。
致谢
本研究得到了“十三五”国家重点研发计划“现代食品加工及粮食收储运技术与装备”重点专项(2018YFD0400404)的资助。
Compliance with ethics guidelines
Shan Wu, Shuai Lu, Jun Liu, Shaoqing Yang, Qiaojuan Yan, and Zhengqiang Jiang declare that they have no conflict of interest or financial conflicts to disclose.

