毛竹根系解磷细菌的解磷条件和解磷特性
杨 豆,李广强,吕永财,李 冬,万松泽,张 扬
(1.江西农业大学 a.林学院;b.国家林业和草原局鄱阳湖流域森林生态系统保护与修复重点实验室,江西 南昌 330045;2.山东省枣庄市农业农村事业发展中心,山东 枣庄 277000;3.山东省烟台市芝罘林场,山东 烟台 264002)
磷是植物体内多种有机化合物的主要组成部分,在植物生长代谢过程中扮演着不可或缺的角色[1-2]。存在于土壤中的磷主要有难溶性磷和可溶性磷两种[2]。目前,我国土壤中全磷的含量分布不均,整体自西北方向东南方呈递减趋势[3]。其中,南方丘陵红壤地区其独特的土壤性质导致土壤中可溶性磷的含量过低,完全不能满足植物生长的需求,磷元素已成为该地区森林生态系统生产力提升的重要限制因子之一[4]。毛竹Phyllostachys edulis(Carrière)J.Houz.是我国南方地区重要的竹材树种之一,其种植面积广、材质优良且生长繁殖能力强[5],在森林生态系统中扮演着重要的角色[6]。然而,我国丘陵红壤地区土壤有效养分的缺乏限制了竹林的可持续经营和发展,其中磷元素为其主要限制因子之一[7-8]。为了改善这种状态,林农常通过施用大量磷肥来缓解土壤缺磷问题,而大量肥料中的可溶性磷进入土壤后仅有不超过30%的磷素被植物吸收,剩余部分被土壤中金属离子鳌合成难溶性磷酸盐而固定在土壤中[9]。采用这种方法施肥,不仅会导致磷素利用率低,还会引起土壤板结和水体污染等一系列环境问题的发生[10]。由于长期施用磷肥,土壤中的全磷含量较高,潜在磷库较大[11],故有效开发该磷库,进而提升土壤磷肥的有效性,可以缓解毛竹林地磷素缺乏的问题。
随着有关植物—微生物—土壤间互作关系的研究的深入,有关微生物对土壤有效养分含量提升的影响方面的研究渐渐成为相关研究的热点。而且,与大量化学肥料相比,生物肥的绿色、高效等优点已逐渐成为人们偏好施用的重要原因之一。生物肥中的解磷微生物除了具有能促使难溶性磷酸盐转变为可溶性磷的能力外,还具有增强植株抗逆性等优点[2,12],因此,施用生物肥是一条解决竹林土壤养分缺乏问题的有效生物途径。目前,有关根际土壤解磷微生物筛选的研究已有不少报道:如张晶晶等[13]从核桃根际土壤中筛选出了11 株定殖能力较强的解磷细菌;庄馥璐等[14]从苹果根际土壤中分离出了10 株具有不同解磷能力的解磷细菌;邓小军等[15]从林木根际土壤中筛选出了6 株透明圈直径(D)和菌落直径(d)的比值大于1.2 的溶解无机磷的菌株。然而,内生细菌生存于寄主植物组织内,与根际土壤内筛选出的菌株相比,具有较强定植能力与适应性,同时可调节寄主植物体内的微平衡[16]。越来越多的证据证明,根系作为植物体内氮、磷等养分的重要吸收组织,存在着丰富的内生细菌[17],并通过分泌相关激素和酶等功能来增强植物对土壤中有效养分的吸收能力[18-20]。因此,从毛竹根系中筛选出具有高效解磷能力的内生菌株,并将之研制成为生物肥料,这是一条缓解我国南方丘陵地区毛竹磷限制问题、提升竹林生产力的有效途径之一。而不同菌剂对其生长环境的嗜好不同,其解磷能力也随着环境的变化而变化,因此,有必要探讨解磷菌株在不同营养因子和不同环境条件下的解磷特性。为此,本课题组前期从毛竹根系中筛选到了具有多种生物功能的拉塔伯克霍尔德菌Burkholderia lataPN1,但关于该菌株的解磷特性尚不清楚。为了掌握B.lataPN1 菌株的解磷特性,从而为其在生产中的应用提供理论依据和技术指导,本研究对该菌株的解磷特性及解磷条件进行了研究,现将研究结果分析报道如下。
1 材料与方法
1.1 供试菌株
菌株PN1 由本课题组分离自江西省奉新县大港林场内毛竹根系,前期鉴定为拉塔伯克霍尔德菌Burkholderia lataPN1,保存于中国典型培养物保藏中心,菌株保藏号为CCTCC NO:M 2019880。
1.2 供试培养基
供试的营养琼脂(NB)培养基的配方为:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,pH 值为7.2~7.4。
供试的由国际植物研究所研制的磷酸盐生长液体培养基(NBRIP)的配方为:Ca3(PO4)25 g,葡萄糖10 g,KCl 0.2 g,MgCl25 g,MgSO4·7H2O 0.25 g,(NH4)2SO40.1 g,水1 000 mL,pH 值为7.2~7.4。
1.3 试验设计与试验方法
1.3.1 不同碳、氮源对菌株PN1 解磷能力的影响试验
分别以可溶性淀粉、果糖、麦芽糖、蔗糖和葡萄糖为碳源配制NBRIP 液体培养基,保持培养基中其他成分不变;分别以牛肉膏、酵母粉、蛋白胨、KNO3和(NH4)2SO4为氮源配制NBRIP 液体培养基,培养基中其他成分也保留不变。将所有配制后的培养基分别放置于100 mL的锥形瓶中,将菌株PN1 于NB 培养基内活化后制备种子液,并以1%的接种量将菌株PN1 分别接种至上述装有培养基的锥形瓶内。以等体积的没有接种菌株的培养基为对照,每个处理组各设3 个重复。将各处理锥形瓶均置于温度为30 ℃、转速为180 r/min的条件下分别振荡培养3 和6 d,然后取培养液置于温度为4 ℃、转速为10 000 r/min 的条件下离心10 min,吸取离心后的上清液0.1 mL 置于50 mL的容量瓶中,以2,4-二硝基酚为指示剂,采用钼锑抗比色法[21]测定上清液中可溶性磷的浓度。
1.3.2 初始pH 值对菌株PN1 解磷能力的影响试验
将NBRIP 培养基的初始pH 值分别调至1.5、2.5、3.5、4.5、5.5、6.5 这6 个水平,但NBRIP培养基的成分保持不变;以1%的接种量将菌株PN1 分别接种至上述不同初始pH 值的NBRIP 液体培养基内,以等体积的没有接种菌株的培养基为对照,每个处理各设3 个重复进行培养。培养条件及上清液的测定方法与1.3.1 中所述的均同。
1.3.3 装液量对菌株PN1 解磷能力的影响试验
分别将40、50、60、80 mL 的NBRIP 培养基加入到100 mL 的锥形瓶中,设装液量与锥形瓶的体积比分别为2/5、1/2、3/5、4/5,并以1%的接种量将菌株PN1 分别接种至上述培养基内,以等体积的没有接种菌株的培养基为对照,每个处理各设3 个重复进行培养。培养条件及上清液的测定方法与1.3.1 中所述的均同。
1.3.4 菌株PN1 对5 种难溶性磷酸盐溶解能力的影响试验
在NBRIP 培养基的其他成分保留不变的前提下,分别以Ca3(PO4)2、FePO4、CaHPO4、AlPO4和植酸钙5 种磷源配制NBRIP 培养基,以1%的接种量将种子液分别接入不同磷源的培养基中,对照为等体积的没有接种菌株的培养基,每个处理各设3 个重复进行培养。培养条件及上清液的测定方法与1.3.1 中所述的均同。
1.4 数据处理
采用SPSS 18.0 和Origin 2018 等软件进行数据分析和作图。采用单因素方差分析法(ANOVA)检验养分及环境因子对菌株PN1 解磷能力影响的差异(P<0.05);采用T检验法检验同一磷源不同处理天数间解磷能力的差异(P<0.05)。
2 结果与分析
2.1 碳源对菌株PN1 解磷能力的影响
NBRIP 培养基中的不同碳源对菌株PN1 溶磷效果的影响情况如图1所示。由图1可知,以果糖为唯一碳源时,菌株PN1 的解磷效果最好,培养3 和6 d 后发酵液中可溶性磷的浓度分别为176.83 与234.17 mg·L-1;其次为葡萄糖;蔗糖的解磷能力最差,培养3 和6 d 后发酵液中可溶性磷的浓度仅分别为37.00 和95.17 mg·L-1。此外,仅有以麦芽糖和蔗糖为碳源的培养时间存在显著差异,且培养6 d 的菌株PN1 对磷酸三钙的溶解能力最强。试验结果表明,用以果糖为碳源的NBRIP 培养基培养6 d,菌株PN1 的溶磷效果最好。

图1 以添加不同碳源的培养液分别培养3 和6 d 后培养液中可溶性磷的浓度Fig.1 The soluble phosphorus concentration in the culture solution after 3 and 6 d of incubation with different carbon sources
2.2 氮源对菌株PN1 解磷能力的影响
不同氮源对菌株PN1 溶磷效果的影响情况如图2所示。由图2可知,以(NH4)2SO4为唯一氮源时,菌株PN1 的解磷能力最好,分别培养3 和6 d后其解磷浓度分别为142.83 与109.83 mg·L-1;以KNO3为氮源时,菌株PN1 的解磷能力次之;当唯一氮源为酵母粉时,其解磷能力较低,培养6 d后其解磷浓度仅有53.00 mg·L-1;当氮源分别为牛肉膏与蛋白胨时,菌株PN1 的解磷能力在相同的培养时间里无显著差异,两者可相互作为等效氮源使用。因此,菌株PN1 最适氮源为(NH4)2SO4且其培养时间为3 d。

图2 以添加不同氮源的培养液分别培养3 和6 d 后培养液中可溶性磷的浓度Fig.2 The soluble phosphorus concentration in the culture solution after 3 and 6 d of incubation with different nitrogen sources
2.3 初始pH 值对菌株PN1 解磷能力的影响
在不同初始pH 值的培养液中菌株PN1 对磷酸三钙的溶解能力具有显著差异(图3)。当培养时间为3 d 时,菌株PN1 在初始pH 值为1.5 的培养液中具有最大解磷浓度,培养液中可溶性磷的浓度为190.50 mg·L-1;而当培养液的初始pH 值为2.5~6.5 时,菌株PN1 对磷酸三钙的溶解能力几乎没有影响,其解磷浓度为121.00~148.67 mg·L-1。当培养时间为6 d 时,在初始pH 值为5.5 的培养液中菌株PN1 的解磷浓度为119.83 mg·L-1,显著高于其余几个初始pH 值处理的解磷浓度。当培养时间分别为3 和6 d 时,菌株PN1 在不同酸性环境下均有较好的解磷能力,试验结果显示,该菌株能适应不同程度的酸性环境。
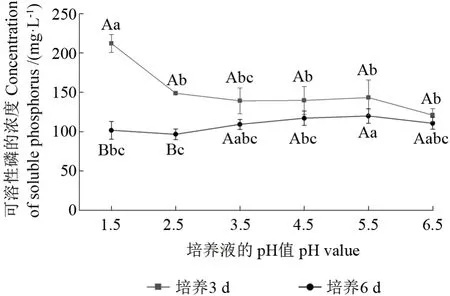
图3 以不同初始pH 值的培养液分别培养3 和6 d 后培养液中可溶性磷的浓度Fig.3 Concentration of soluble phosphorus in the medium after 3 and 6 d of incubation at different initial pH
2.4 装液量对菌株PN1 解磷能力的影响
不同装液量间菌株PN1 对磷酸三钙的溶解能力具有显著差异(图4)。培养3 d 后,当装液量为锥形瓶体积的4/5 时,其解磷效果最好,解磷浓度为136.17 mg·L-1;当装液量为锥形瓶体积的1/2时,培养3 和6 d 的解磷浓度相近;培养6 d 后,当装液量为锥形瓶体积的2/5 时,其解磷效果最好,解磷浓度为187.33 mg·L-1。这一试验结果说明,培养后期菌株PN1 对环境氧量有较高的需求。

图4 不同装液量条件下培养3 和6 d 后培养液中可溶性磷的浓度Fig.4 Concentration of soluble phosphorus in the medium after 3 and 6 d of incubation at different liquid volume ratio
2.5 菌株PN1 对5 种难溶性磷酸盐的溶解能力
以添加不同磷源的培养液分别培养3 和6 d 后培养液中可溶性磷的浓度如图5所示。由图5可知,菌株PN1 对5 种磷源的溶解能力有着显著差异。其对无机磷源CaHPO4的解磷能力最好,培养3 和6 d 后其解磷浓度分别为480.00 与161.00 mg·L-1;其次为Ca3(PO4)2,培养6 d 后其解磷能力最好,其解磷浓度为117.50 mg·L-1。菌株PN1 不仅对无机磷源表现出较好的溶解能力,同时对有机磷源植酸钙也具有较好的溶解能力,培养3 和6 d 后其解磷浓度分别为82.00 与5.99 mg·L-1。但是,菌株PN1 对磷源AlPO4和FePO4均无溶解能力。

图5 以添加不同磷源的培养液分别培养3 和6 d 后培养液中可溶性磷的浓度Fig.5 The soluble phosphorus concentration in the culture solution after 3 and 6 d of incubation with different phosphorus sources
3 结论与讨论
碳水化合物是所有异养微生物的能源物质之一,对微生物生长和繁殖具有不可替代的作用,且不同碳水化合物对其生长发育速度的影响有着显著差异[22]。有关研究结果表明,解磷微生物主要通过葡萄糖氧化代谢途径分泌有机酸来溶解不溶性矿质磷酸盐[23];菌丝分泌物中的果糖不仅能为植株提供碳源,还能作为信号分子提高细菌磷酸酶相关基因的表达[24]。研究中发现,菌株PN1在碳源为果糖或葡萄糖的培养液中的解磷能力最好。由此推测,该菌株可能是通过吸收利用果糖来提高磷酸酶相关基因表达的,或者通过吸收利用葡萄糖进入氧化代谢途径,进而更好地促进溶解难溶性的磷酸盐的功能。不同的解磷菌株对碳源的适应性不同。陈言柳等[25]发现,菌株NC285的最佳碳源为葡萄糖;郑喜清等[26]发现,菌株PB3 在以葡萄糖或果糖为碳源的条件下其解磷效果最显著。供试菌株PN1 对不同碳源条件表现出不同的溶解能力且其差异显著,但其具体的代谢途径和机理还有待进一步研究。氮是构成微生物细胞蛋白质和核酸等物质的重要元素,对微生物的繁殖和代谢均有重要影响,也显著影响着微生物生长繁殖的速度[27]。Wenzel 等[28]对从Telopea speciosissima(Sm.) R.Br.的根际中分离到的解磷细菌进行了氮源影响试验,结果发现,当氮源为NH4+时其解磷能力较强,而用NO3-替换NH4+作为氮源时其几乎没有解磷活性。研究结果虽然验证了菌株PN1 在氮源为NH4+时其对磷酸盐具有较好的溶解能力这一结论,然而,该菌株在氮源为NO3-时也表现出较好的解磷能力,这表明该菌株对不同氮源的适应性均较强,其对氮源的可利用范围更宽。
除营养条件外,环境条件也会直接影响解磷微生物的解磷特性[29],如培养液的初始pH 值、装液量、磷源等因素。上官亦卿等[30]在对菌株JYP9解磷特性的研究中发现,除最适pH 值外,过酸或过碱的条件都会显著影响其解磷量。我国南方土壤环境因子复杂,土壤酸度、氧气浓度等变化均较大。而试验结果显示,菌株PN1 在培养液的初始pH 值为2.5~6.5 的条件下其解磷能力并无显著差异,这表明该菌株能够适应较广的土壤酸度。此外,菌株的生长要经历延滞期、对数期和衰退期等阶段,试验观测结果显示,菌株PN1 在不同时间段其解磷功效会发生显著变化。因此,今后在对该菌株发酵培养时,还应将发酵时间当作一个重要因子加以考虑,以获得更高的解磷功效。
目前关于解磷微生物的解磷机制存在不同的说法[31-32]。部分研究者认为,它通过以解磷过程中释放出的有机酸结合土壤中金属离子的螯合作用来增强土壤中磷酸根离子的活性[33-34];也有研究者认为,其通过向外分泌各种与溶解磷酸盐有关的酶(如磷酸酶、植酸酶、核酸酶等)来增加土壤有效磷酸盐的浓度[35];但也存在菌株同时具有这两种解磷机制的研究结论[36]。以往的研究结果表明,解磷微生物对不同土壤类型中Ca3(PO4)2、FePO4和AlPO4等难溶性磷酸盐的溶解能力具有显著差异[31,37],其原因可能是,解磷微生物对Ca3(PO4)2的溶解可通过分泌有机酸和质子来络合和溶解难溶性磷酸盐,而对AlPO4、FePO4等的溶解仅能通过络合作用进行[38]。本研究初步探析了菌株PN1 的溶解特性,但该菌株对5 种难溶性磷酸盐的溶解机制尚不清晰,同时该菌株是否具有分泌有机酸或各种酶类物质等功能还有待进一步研究。我国丘陵红壤区中无机态磷主要以闭蓄态Fe-P 和Al-P 为主,碱性石灰土中主要以Ca-P 为主。研究结果显示,菌株PN1 更适用于石灰土或Ca-P含量较多的土壤。本研究采用单因素试验对菌株PN1 的广适性进行了初步探讨,研究结果为后续的正交或响应面试验中发酵条件的优化提供了参考数据,也为该菌株的推广利用提供了基础数据。

