Verisyse虹膜固定型人工晶状体植入术后10年角膜内皮丢失影响因素分析
陈亦路 戴伟 陆燕 王春红 曹茜 汪萍 黄振平
有晶状体眼人工晶状体(phakic intraocular lenses ,PIOL)包括房角支撑型、后房型以及虹膜固定型,大量研究表明它们的植入都与角膜内皮细胞加速丢失相关[1],因此PIOL植入术后的角膜内皮丢失在评估晶状体安全性方面的价值被广泛重视。2006年法国卫生安全和健康产品委员会(AFSSAPS)因角膜内皮细胞的过度丢失取消了房角支撑型PIOL的使用[2]。2016年美国眼科学会(AAO)提出了全新的PIOL植入术后的临床观察终点,即与术前相比角膜内皮细胞的丢失等于或超过25%[3]。虹膜固定型人工晶状体从应用于高度近视患者开始,就有学者担心这种PIOL会损伤角膜内皮[4]。多个短期研究表明[5-9],只要严格界定纳入标准,虹膜固定型人工晶状体是安全有效的。然而,术后长期角膜内皮细胞的丢失仍然是需要讨论的焦点,尤其是针对术后10年这部分人群的观察在国内是匮乏的。
眼前节相干光层析成像术(anterior segment optical coherence tomography,AS-OCT)已被证实是一种良好的成像工具,能可视化人工晶状体在前房位置、分析其与角膜内皮和晶状体的距离[10,11]。Kohnen等[12]主要研究了PIOL 与中央角膜内皮之间的距离,认为其达到2.0 mm是避免角膜内皮失代偿的安全距离,而Verisyse虹膜固定型人工晶状体的横截面在眼内呈“桥拱”形,这意味着人工晶状体边缘更接近外周角膜内皮细胞。Baikoff等[10]指出,AS-OCT测量的晶状体边缘到角膜内皮之间的距离≥1.5 mm(鼻侧与颞侧取较小值)为安全距离。因此,术后长期检查的关注重点除了角膜内皮细胞外,还应包括前房形态的长期评估[13]。
在此次研究中,我们主要观察植入Verisyse虹膜固定型人工晶状体术后10年角膜内皮状态,应用AS-OCT评估晶状体在前房中的位置,分析可能与角膜内皮加速丢失相关的影响因素。
资料与方法
一、一般资料
选择2008年9月至2010年7月就诊于东部战区总医院的高度近视患者31例(58只眼),男性14例(26只眼),女性17例(32只眼)。年龄28~54岁,平均(36.9±7.61)岁,术前裸眼视力1.0~2.0,平均(1.27±0.44,logMAR),术前最佳矫正视力0.0~2.0,平均(0.20±0.32,logMAR),术前角膜内皮细胞计数2309~3504个/mm2,平均(2841.9±259.73)个/mm2,术前眼压9.0~20.0 mmHg(1 mmHg=0.133 kPa),平均(13.21±2.86)mmHg,植入IOL屈光度-7~-23.5 D,平均(-13.22±4.12)D。所有患者均于术前签署知情同意书。
二、入选及排除标准
纳入标准:年满18周岁;屈光度数稳定至少2年;前房深度≥2.8 mm;角膜内皮细胞计数≥2000个/mm2;术前眼压10~21 mmHg;有强烈脱镜意愿及接受屈光手术的主观愿望者。排除标准:青光眼、葡萄膜炎,影响视力的角膜、晶状体、视网膜病史,暗光下瞳孔直径大于6 mm,有糖尿病、自身免疫性疾病或其他系统性疾病。
三、材料
Verisyse IOL是美国眼力健(AMO)公司生产的一片式晶状体,主要是由聚甲基丙烯酸甲酯(PMMA)制成的刚性透镜,总长8.5 mm,光学区直径是可变的。中央光学区直径为5 mm或6 mm,分别矫正度数范围为-16.0~-24.0 D和-3.0~-15.5 D,递进幅度0.5 D。IOL度数由制造商使用Van der Heijde公式进行计算。
四、手术方法
手术均由经验丰富的同一位医师完成。患者术前常规镇定、止血、缩瞳,以利多卡因与布比卡因等量混合后行球后麻醉,辅以表面麻醉。消毒、铺巾、置开睑器,于正上方沿角巩膜缘剪开结膜,暴露巩膜,电凝止血。作半月形长约5~6 mm的巩膜隧道外口,用15°穿刺刀于2点及10点在角膜缘作辅助切口,用3.0 mm角膜刀作隧道内口,前房内注入Discoviscoat黏弹剂后,行上方虹膜周边切除。用隧道刀扩大巩膜隧道至5~6 mm,植入Verisyse晶状体,调整晶状体位置,使光学中心与瞳孔中央同轴。巩膜隧道切口伸入专用夹持镊固定,两侧辅助切口分别伸人虹膜钩,将3点与9点周边部虹膜钩起嵌入IOL襻的爪子中,冲洗黏弹剂,注水形成前房,间断缝合巩膜外口2针,球结膜瓣复位。
五、测量指标及测量方法
统计患者术前术后验光结果(除标明logMAR视力,均为小数视力)、非接触眼压,中央角膜内皮细胞密度(endothelial cell density,ECD)(个/mm2)、内皮细胞变异系数、六角形细胞比例。术前与术后10年于相同的仪器测量以上相同指标,其中每个眼睛的ECD都是3次连续测量取平均值。术后应用Visante前节OCT(德国Zeiss公司)由同一位医师在相同光线条件下测量前房深度(anterior chamber deptch,ACD)、人工晶状体后表面到自然晶状体前表面的距离、晶状体前表面中央及边缘到角膜内皮的最短距离(鼻侧与颞侧取最小值[13])等评估Verisyse IOL在眼内的相对位置(图1)。裂隙灯及眼底镜下检查角膜状态、有无人工晶状体脱位、移位或表面色素沉着,有无虹膜萎缩,眼底出血及视网膜脱离等并发症。

图1 前节OCT测量IOL到角膜内皮中央及边缘的最短距离以及到自然晶状体前表面的距离
六、统计学方法

结 果
纳入的58只眼于随访时间截止IOL均在位:其中1只眼于术后7年发生视网膜脱离,遂行视网膜复位术;2只眼IOL偏位,发生角膜内皮失代偿,后行IOL取出术;2只眼受外伤,1只眼术后9年篮球砸伤后晶状体脱位行复位术,1只眼术后10年拳击伤致前房积血但晶状体仍固定良好;1只眼因核性白内障行Verisyse IOL取出术联合白内障超声乳化人工晶状体植入术;4只眼Verisyse IOL夹持处虹膜色素脱失。
一、视力、屈光状态及眼压
术后10年裸眼视力与最佳矫正视力与术前相比均有明显提高且差异有统计学意义(P<0.001)。术后10年患者裸眼视力≥0.5占总人数的56.90%,≥0.8占17.24%,≥1.0占8.62%。术后残余球镜度(-1.35±2.17)D。术后眼压(13.22±2.66)mmHg,与术前(13.21±2.86)mmHg相比,差异无统计学意义(P=0.973>0.05)。见表1。

表1 术前与术后10年视力(logMAR)、球镜度、眼压的比较
二、角膜内皮形态
术后角膜内皮细胞变异系数为(54.88±10.36),与术前(54.35±11.72)相比小幅度上升,但差异无统计学意义(t=0.254,P=0.8>0.05)。术后六角形细胞比例(33.62±6.40)%,与术前(34.59±7.06)%相比小幅度下降,但差异无统计学意义(t=0.769,P=0.44>0.05),见表2。术前、术后1年、术后10年的中央角膜内皮细胞密度(ECD)数值见表3,术后1年ECD为(2793.4±270.88)个/mm2与术前相比差异无统计学意义(P=0.422>0.05),术后10年ECD(2512.8±418.19)个/mm2于术前相比明显减少(P<0.001)。角膜内皮细胞术后1年、10年的丢失率分别是(1.7±2.43)%和(11.56±12.01)%,其中5.17%(3例)术后角膜内皮细胞丢失率≥25%。
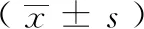
表2 术前与术后10年变异系数、六角形细胞比例的比较

表3 术前、术后1年、术后10年ECD计数及丢失率
三、AS-OCT测量值
术后10年应用Visante前节OCT评估IOL在眼内相对位置:前房深度为(3.06±0.27)mm,IOL前表面中央到角膜内皮的最短距离为(2.13±0.23)mm,IOL边缘到角膜内皮的最短距离为(1.30±0.21)mm,IOL后表面到自然晶状体前表面的距离(0.70±0.13)mm。分析IOL前表面中央及边缘到角膜内皮的最短距离、IOL后表面到自然晶状体前表面的距离与年龄均无明显相关性(P>0.05)。
四、影响因素
分别计算各个影响因素与术后10年角膜内皮细胞丢失率的Pearson相关性,进行变量单因素筛选:前房深度(r=-0.713,P<0.001)、IOL前表面中央到角膜内皮的最短距离(r=-0.696,P<0.001)、IOL边缘到角膜内皮的最短距离(r=-0.699,P<0.001)与角膜内皮丢失率呈负相关。术前有佩戴隐形眼镜史的患者角膜内皮丢失率较低(r=0.269,P=0.047)。而术前ECD储备量、年龄、性别、眼别、IOL的屈光度及型号与术后10年角膜内皮丢失率无明显相关性(P=0.88、0.372、0.275、0.233、0.823、0.518)。P<0.2的因素纳入多元线性回归,结果提示IOL前表面中央(X1)及边缘(X2)到角膜内皮的最短距离、隐形眼镜佩戴史(X3)为术后10年角膜内皮丢失率Y的影响因素,见表4。得出多元线性回归方程Y=0.451-0.129X1-0.072X2+0.008X3(R2=0.937,容许度>0.1,VIF<10)。

表4 后10年角膜内皮细胞丢失影响因素
讨 论
Verisyse IOL是第一个获得美国 FDA 批准的用于近视治疗的人工晶状体,在关于Verisyse虹膜固定型人工晶状体的研究中关注角膜内皮的长期丢失问题是至关重要的[12]。国内外已经有很多研究[6, 9, 14]证实了Verisyse植入术后短期的安全性和有效性。本回顾性研究的目的是评估术后10年Verisyse IOL在眼内的位置,以及分析角膜内皮细胞丢失的影响因素。
临床上通常以角膜内皮细胞计数<1500个/mm2为阈值作为PIOL的取出标准,据此2016年AAO 提出了新的临床随访终点:与术前相比角膜内皮细胞丢失率达到或超过25%[3]。此外AAO还提出对于术后丢失率为20%~25%或ECD<1500个/mm2的患者应建立每4~6个月的密切随访。因此术后角膜内皮细胞丢失率须被重视,回顾国内外文献,我们发现聚焦Verisyse IOL植入术后角膜内皮细丢失率的报道有很多,但各有不同,不完全统计:术后1年有[1]-0.87%[5]、无差异[6,7]、7.21%[4]等;术后2年有-0.78%[5]、1.28%[13]、9.22%[15]等;术后3年有5.50%[16]、10.90%[4]等;术后4年的有13.42[15]等;术后5年有3%[8]、8.30%[17]等,但关于其术后角膜内皮细胞变化达到或者超过10年的报道仍很少。2018年Jonker等[2]报道Verisyse IOL植入术后10年角膜内皮丢失率为16.6%。
我们的研究表明术后10年ECD丢失率平均11.56%,年平均丢失率1.16%。相较于其他针对角膜内皮细胞的10年随访:无疾病及手术史的ECD年自然丢失率为0.6%[18],白内障超声乳化术后中央ECD年平均丢失率2.5%[19],我们认为Verisyse IOL植入术后的ECD年丢失率是可以接受的。与Jonker等[2]报道的结果10年前后测量设备不同,我们改进使用了同一台非接触式角膜内皮镜进行测量,术后ECD采集使用了AAO提出的对角膜中央进行连续3次测量[3]。以AAO提出的临床随访终点进行评估,3只眼术后10年角膜内皮丢失率≥25%,其中1只眼术后9年篮球砸伤致PIOL脱位,2只眼发生角膜内皮失代偿,这与AAO提出的标准互为印证。无疾病及手术史人群的角膜内皮细胞10年后变异系数增加、六边形细胞比例下降[18]。但在我们研究中术后10年变异系数及六角形细胞比例与术前相比差异均无统计学意义,这与其它PIOL植入术后研究相似[5, 13, 16, 20]。归因于:(1)术前角膜接触镜的佩戴及术后的停止佩戴[21];(2)创伤刺激下的角膜内皮重组[20]。遗憾的是我们缺失了大部分患者1~10年间变异系数和六边形细胞比例的数据,因此无法确定该数值是否在波动后回归术前水平,因此需要更长时间的随访。
AS-OCT测得IOL前表面中央到角膜内皮的最短距离小于Kohnen等[12]认为的安全距离2.0 mm的患者占27.58%,晶状体边缘到角膜内皮之间距离小于Baikoff等[10]指出的安全距离1.5 mm的患者占81.03%,其中2只眼发生角膜内皮失代偿。IOL后表面与自然晶状体前表面均无接触(0.39~1.02 mm)。近来许多研究聚焦PIOL在眼内的相对位置与时间的关系。随着每一个屈光度的调节,晶状体的前极向前移动30 μm,Güell等[22]认为在调节过程中,Verisyse IOL和自然晶状体之间的距离保持不变,年轻人调节力较强[11],日间PIOL可能更靠近角膜内皮。Doors等[13]发现随着年龄增长,Verisyse IOL和自然晶状体之间的距离每年减少3.1 μm,IOL也会同步向前移动。因此应用AS-OCT长期观察Verisyse IOL在眼内的相对位置对评估术后远期安全性也尤为重要。
针对术后10年ECD丢失率的多元线性回归模型提示:人工晶状体的前表面中央及边缘与角膜内皮之间的距离越短,角膜内皮细胞丢失就越多,危险因素与其它研究相同[13,14]。相较于单纯框架眼镜佩戴者,有角膜接触镜佩戴史者10年角膜内皮丢失率较低,这可能是因为术后停戴而导致内皮细胞从角膜外周向中央逆转[21],Pop等[5]也得出了相同的结论。有意思的是,单因素分析ACD与10年角膜内皮丢失率相关,多元线性回归中却不是影响因素,因为根据前房的解剖结构ACD与人工晶状体的前表面中央及边缘与角膜内皮之间的最短距离相关,即存在共线性,所以单因素分析具有相关性。因此相较于其他单因素分析ACD与ECD关系的研究,我们的多元线性回归模型将更为精确。
本研究表明,在Verisyse IOL的长期随访中,除了要关注角膜内皮细胞的丢失率,还应该关注人工晶状体在前房的位置,以评估其安全性。遗憾的是,术后1~10年间我们并没有进行密切的随访,在未来我们将继续关注这批患者,在更远的将来及更多眼的随访之后提供更准确的数据,希望为Verisyse虹膜固定型人工晶状体术后远期的随访提供建议。

