miR-711靶向下调CD44抑制胃癌干细胞干性特征的研究
李建刚 李亮 帕合热迪尼·玉素莆 马博
胃癌是消化道常见恶性肿瘤之一,中晚期病人疗效不佳,预后差[1]。肿瘤干细胞(cancer stem cells,CSCs)是肿瘤复发、侵袭、转移及耐药的根源,已在多种恶性肿瘤中发现CSCs的存在[2]。研究发现,多种miRNAs参与调控胃癌干细胞(gastric cancer stem cells,GCSCs)的恶性生物学行为[3]。miR-711是最近发现的一种miRNA,在多种恶性肿瘤组织中低表达[4-6]。近年来研究发现,过表达miR-711能抑制SGC-7901细胞的干性指标SOX2的表达,同时抑制与肿瘤耐药相关的基质金属蛋白酶9(MMP-9)的表达[7]。我们从TCGA及Metabolic gEne Rapid Visualizer等数据库分析显示胃癌组织和胃癌细胞株中miR-711低表达,正常胃黏膜组织中miR-711高表达。但是miR-711是否可影响GCSCs的干性目前尚不清楚。本研究分析miR-711对GCSCs干性特征的影响。
材料与方法
一、主要试剂、细胞株及仪器
人胃癌干细胞CSC-G、人胃癌细胞株 MKN-45(美国ATCC细胞库)。RPM11640培养基、胰蛋白酶、胎牛血清、双抗(Gibco,美国);miR-711 mimics、miR-NC对照质粒、引物序列、MUT-CD44和 WT-CD44(上海生物工程公司);兔抗人Bmi1、Sox2、Oct4、CD44、β-actin多克隆一抗、鼠抗兔单克隆二抗(Jackson公司,美国);荧光素酶检测试剂盒(BioVision公司,美国);Western Blot试剂盒,LipofectAMINE 2000脂质体转染试剂盒(上海碧云天生物公司);PCR试剂盒(Sigma公司,美国);酶标仪(上海仪电分析仪器有限公司);SDS-PAGE 凝胶电泳及转移装置(上海优宁维生物科技股份有限公司),LAS400凝胶成像系统(GE公司,美国);ABI 7900PCR扩增仪(上海仪电分析仪器有限公司)。
二、方法
1.癌症基因组图谱数据集:从癌症基因组图谱数据库(TCGA,2020年11月)的门户下载了1 053个胃癌组织和89个正常胃黏膜组织的miRNA数据。
2.细胞培养:用含10% FBS和青、链霉素各100 U/L的RPM11640培养基培养MKN-45,无血清RPM11640培养基培养CSC-G,常规培养于37 ℃,5% CO2培养箱。待细胞铺满培养瓶后,用0.25%胰酶消化,制备单细胞悬液,继续培养,定期更换培养基、传代。
3.细胞转染:使用Lipofeetamine 2000试剂对CSC-G细胞进行转染,分为:miR-NC组(转染miR-NC),miR-711组(转染miR-711-mimics)及CSC-G组(未转染)。各组细胞继续培养48小时,用于后续实验。
4.实时荧光定量PCR(Quantitative Real-time PCR)检测各组细胞miR-711 mRNA表达:取转染后培养48小时的各组细胞,胰酶消化,离心。加入Trizol提取细胞总RNA,检测合格后将RNA转录成cDNA进行PCR。引物序列见表1。反应体系:SYBR® Premix Ex TaqTM(2×)12.5 μl+上下游引物10 μm各1 μl,加反应水至总体积为25 μl。反应参数:95 ℃预变性4分钟;95 ℃变性30 s,52 ℃退火30秒,72 ℃延伸30秒,30个循环,72 ℃延伸10分钟。读取荧光,构建溶解曲线。2-△△Ct法计算目标引物mRNA的相对表达量。
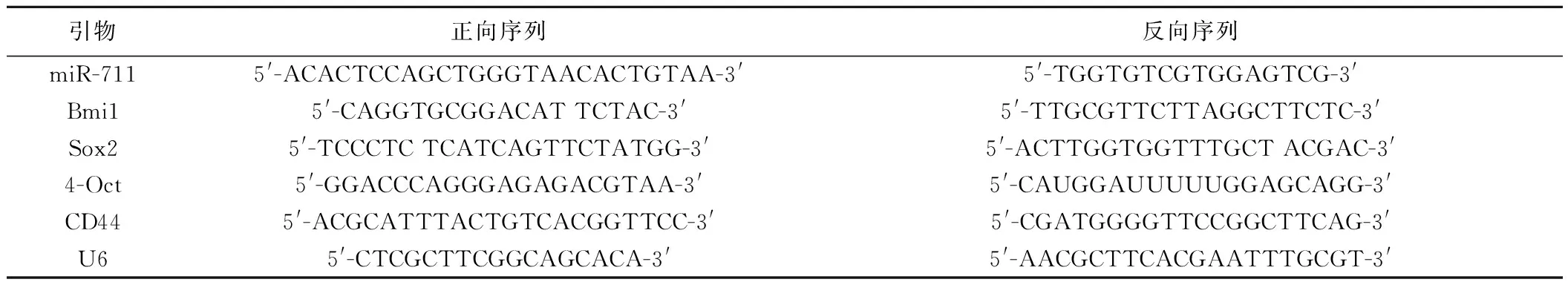
表1 目标引物序列和大小
5.Western Blot检测Bmi1、Sox2、Oct4及CD44蛋白量表达:取转染后培养48小时的各组细胞,去除培养基后每空加入500 μl蛋白裂解液进行,超声裂解30分钟,40 ℃ 1 500 r/min离心5分钟,把上层液体10 μl移入EP管中,蛋白浓度检测。配胶,上样,电泳,经湿转将蛋白转移至 PVDF 膜,封闭液封闭1小时,逐次兔抗人Bmi1(1∶500)、Sox2(1∶500)、Oct4(1∶1 000)、CD44(1∶500)、β-actin(1∶1 000)多克隆一抗、鼠抗兔单克隆二抗(1∶100)。曝光成像,Quantity One V4软件进行分析。结果以目标蛋白光密度值/β-actin光密度值表示。
6.悬浮肿瘤球形成实验检测CSC-G干性:将各组细胞接种于96孔板中,细胞浓度调整为5×102个/孔,加入无血清RPMI1640培养基200 μl,常规培养于37 ℃,5% CO2培养箱,每天观察肿瘤球数量,培养2周时,显微镜下拍照。
7.荧光素酶实验验证miR-711与CD44的靶向关系:参照脂质体转染说明书将CD44野生型或突变型的荧光素酶报告基因质粒载体与miR-NC、miR-711-mimic一起转入细胞,培养48小时,参照双荧光素酶报告基因检测试剂盒说明书进行检测。
三、统计学方法

结果
1.人胃癌组织中miR-711的表达见图1。利用TCGA数据库分析了miR-711在人胃癌组织的表达水平,结果显示,与正常胃黏膜组织相比,miR-711在胃癌组织中的表达水平更低,差异有统计学意义(P< 0.05)。
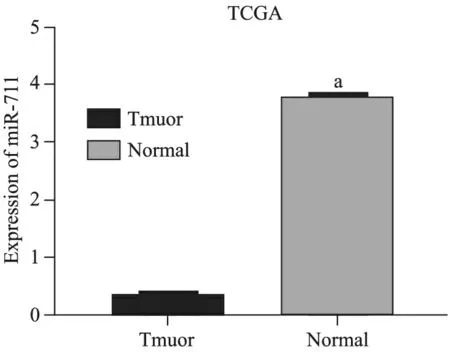
与胃癌组织比较,a P<0.000 1
2.各组miR-711 mRNA表达:见图2。与miR-711组比较,CSC-G组、MKN-45组、miR-NC组细胞miR-711平降低(P<0.01);与MKN-45组比较,CSC-G组细胞miR-711水平降低(P<0.01)。
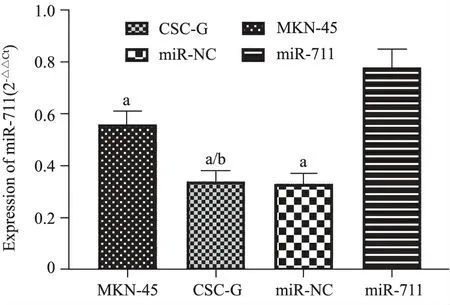
与miR-711组比较,a P<0.01;与MKN-45组比较,b P<0.01
3.过表达miR-711对CSC-G细胞肿瘤球形成能力的影响见图3。培养1周、2周时,miR-711组悬浮细胞球百分比低于CSC-G组、miR-NC组(P<0.01),且细胞球形态较小。说明miR-711过表达抑制了干细胞的肿瘤球形成能力。

A:培养1周、2周各组肿瘤球形成情况(×20);B:统计学分析。与miR-711组比较,a P<0.01
4.miR-711过表达对Bmi1、Sox2、Oct4蛋白及基因mNRA表达的影响见图4。miR-711组Bmi1、Sox2、Oct4蛋白及基因mNRA水平低于CSC-G组、miR-NC组,差异均有统计学意义(P均<0.01)。
5.miR-711与CD44的靶向关系见图5。生物信息分析,miR-711与CD44存在一定的互补碱基对。miR-711组CD44蛋白及mNRA水平低于CSC-G组、miR-NC组(P均<0.01)与WT-CD44组相比,miR-711+WT-CD44组细胞荧光素酶活性明显降低(P<0.01)。
讨论
胃癌是消化道系统最常见的恶性肿瘤,尽管手术、放疗、化疗及免疫靶向治疗等手段取得了长足的进步,但胃癌的复发转移问题仍未得到解决。CSCs是一群具有多向分化能力、无限增殖能力的细胞,被认为是肿瘤转移复发的根本原因[8]。近年来,已从多种恶性肿瘤组织及细胞株中分离出CSCs,并证实了其生物学性能[9]。研究显示,胃癌中同样存在肿瘤干细胞[10]。因此,抑制CSCs的干细胞特性对于预防胃癌的转移复发,提高病人的预后具有重要意义。
研究显示,miRNAs与肿瘤干细胞的增殖、侵袭、转移及多向分化密切相关,miR-196a-5p通过靶向Smad4基因抑制GCSCs的上皮间质转化(epithelial-mesenchymal transition,EMT)和侵袭过程[11],miR-876-3p可靶向TMED3基因增强胃癌细胞的顺铂敏感性,抑制干细胞特征[12],以及miR-7-5p 可靶向上调Smo、Hes1基因,促进GCSCs的侵袭[13]。因此,miRNAs可通过CSCs成为胃癌的有意义的治疗靶点。miR-711作为一种抑癌基因,与多种肿瘤细胞的恶性行为有关。Xiao等[14]研究发现,miR-711在胃癌组织中低表达,可靶向CD44调控胃癌细胞的EMT过程。但其对GCSCs特性的影响尚不清楚。本研究分析了miR-711在胃癌细胞及CSC中的表达,结果显示,miR-711在CSC细胞中的表达水低于胃癌细胞株细胞中的表达水平,表明miR-711在胃癌CSC中是一种抑癌因子。为探索miR-711是否调控胃癌CSC的干性,我们将miR-711转染至CSC中,观察干细胞的肿瘤球形成能力的改变,结果显示,过表达miR-711组细胞的肿瘤球形成能力低于其他两组,提示miR-711可抑制GCSCs肿瘤球形成能力。Bmil、Sox2、Oct4作为肿瘤干细胞标志物,是维持干细胞干性所必需的。有研究证实,GCSCs同样高表达Bmil、Sox2、Oct4蛋白[15]。基于此,本研究中我们选择Bmil、Sox2、Oct4进行研究,Western Blot及q-PCR结果均表明,上调miR-711后,胃癌干细胞CSC-G中Bmil、Sox2、Oct4表达均显著降低。以上结果说明,过表达miR-711可抑制GCSCs的干性特性。

A、B:Western Blot结果;C:mNRA表达;与miR-711组比较,a P<0.01
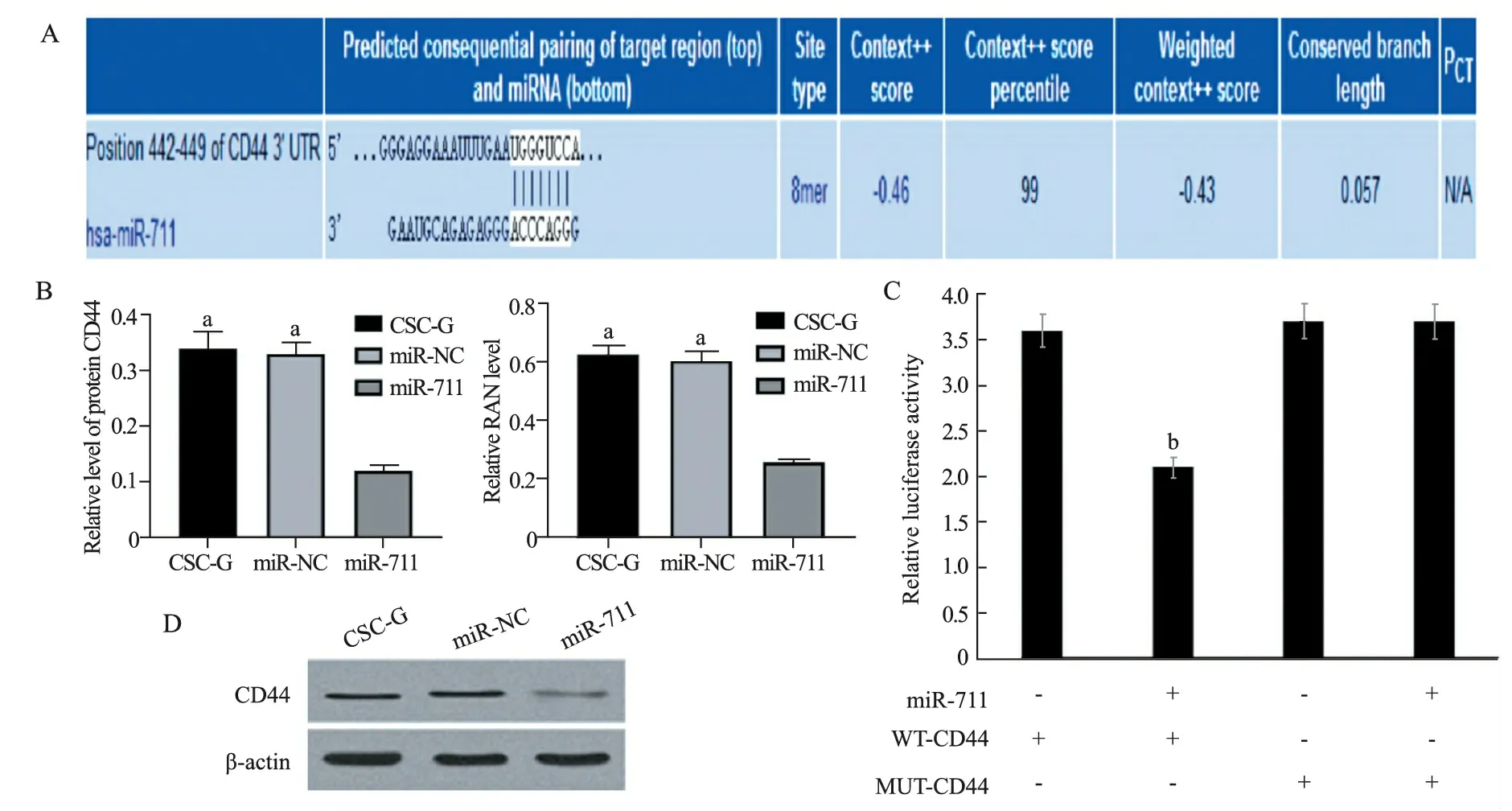
A:生物信息分析结果;B:CD44蛋白及mNRA表达结果;C:荧光素酶实验;D:Western Blot结果。与miR-711组比较,a P<0.01;与WT- CD44组比较,b P<0.01
在观察到过表达miR-711抑制CSC-G细胞干性后,还需要进一步研究其具体机制。miRNAs调控下游靶基因的方式主要是通过与基因mRNA的3'UTR区结合完成。我们通过在线生物信息网站预测到miR-711的靶基因存在上百个,其中CD44属于干细胞标记物,在多种肿瘤组织中高表达,在干细胞干性维持中发挥重要的作用[16-18]。尹磊等[19]研究发现,胃癌间质干细胞可通过Wnt /β-catenin通路激活下游CD44蛋白的表达进而促进癌细胞的侵袭。刘罡等[20]研究结果显示,miR-34a可靶向调控CD44 抑制肺癌干细胞肿瘤成球、侵袭能力。因此我们推测miR-711可能通过靶向下调CD44 抑制GCSCs的干性,首先,Western Blot及q-PCR结果均表明,上调miR-711后,胃癌干细胞CSC-G中CD44表达均显著降低。同时双荧光素酶实验结果表明,CD44为miR-711直接调控的靶基因。但其深人的作用机制需在后续研究中进行探讨。
综上所述,miR-711过表达可抑制胃癌CSC的干性特征,其初步机制可能是与下调CD44有关,提示miR-711有望成为胃癌治疗的有效靶点。但本次研究为初步探索,miR-711对胃癌干细胞的其他生物学行为的影响及机制需要更深入、全面研究。

