实验性先天性巨结肠症大鼠结肠神经节细胞中PHOX2B的免疫组织化学表达特征
李霁伟,谢余澄,武红芳,阿智祥,高燕,周军
(昆明市儿童医院病理学科,昆明 650228)
先天性巨结肠症(Hirschsprung’s disease,HD)是小儿常见的肠道疾病,新生儿中发病率约为1/4000~1/5000,居先天性消化道畸形第二位。HD主要病理改变是远端的狭窄肠管内肌间神经丛(Auerbach丛)和粘膜下神经丛(Meissner丛)内神经节细胞缺如,神经纤维增粗[1]。HD的发病机制尚不十分清楚,一般认为是胚胎发育过程中肠神经嵴细胞迁移障碍或迁移后不能正常生长分化所致[2]。为了发现更特异的诊断HD的方法,本研究应用免疫组织化学方法比较了同源异型盒蛋白2B(pairedlike homebox 2B,PHOX2B)、calretinin和S-100在HD肠壁的表达特征。
材料与方法
1 动物
40只SPF级SD大鼠,2月龄,体重(220±10)g,雌雄各半,购自于昆明医科大学动物实验室,并委托饲养至性成熟后繁殖幼鼠。取4至5日龄80只,雌雄不限,随机分为模型组和空白对照组2组,每组40只:模型组采用0.5% BAC处理乙状结肠;空白对照组采用5ml 0.9%生理盐水处理乙状结肠。
2 试剂
实验中的主要试剂见表1。
表1 实验试剂Tab. 1 Experimental reagents
3 HD乳鼠动物模型建立
于1978年有学者利用BAC成功建立大鼠无神经节细胞症模型[3],之后该动物模型和实验方法也广泛用于去神经方面的研究。本研究在经典的HD动物模型基础上[4-6],根据儿童生理特点,利用乳鼠模拟建立HD动物模型,从而更贴合儿童HD病理生理状态。
新生4~5d龄SD乳鼠40只,在无菌条件下腹部正中1%利多卡因局部麻醉,麻醉处切口提出乙状结肠(距离肛门1~1.5cm处),将0.5%BAC溶液浸泡过滤纸条(1.5cm×0.5cm)紧贴肠壁环形包绕乙状结肠,每10min滴加50µl的0.5% BAC溶液于滤纸上,保持滤纸湿润,60min后移去滤纸条,清洁腹腔,还纳肠管,关闭腹腔,注射用青霉素钠粉剂涂切口,每天1次。空白对照组40只乳鼠的手术方式同模型组,用0.9%生理盐水代替0.5% BAC溶液,作用时间及计量同实验组。恒温下人工饲养,术后第1周模型组开始出现腹胀,至术后第2周模型组均出现不同程度的排便减少,腹胀,精神萎靡,消瘦,粪便颗粒比对照组和空白组干燥且明显变小,随机处死后大体解剖可见 BAC 处理结肠段肠管狭窄痉挛,无蠕动,病变近端肠管扩张,肠腔内容物潴留,症状与临床先天性巨结肠一致。截取处死后模型组狭窄段肠道标本用4%福尔马林溶液固定保存,常规脱水透明石蜡包埋,切片厚为4µm,常规HE染色。镜下肠道粘膜内和肌层内神经丛增生、增大(>40μm),缺乏明确神经节细胞,符合HD病理诊断。
处死空白对照组和模型组乳鼠,分别截取空白组乙状结肠正常肠道标本40例,模型组狭窄段标本40例和移行段标本40例,均用4%福尔马林溶液固定后石蜡包埋切片备用。
4 免疫组织化学染色
免疫组织化学染色操作步骤:石蜡切片高压锅100℃修复3min,自然冷却,PBS洗5min×3次;3%H202室温孵育10min,PBS洗2min×3次;滴加抗PHOX2B(1:4000)、抗calretinin(1:50)和抗S-100(1:100)单克隆抗体,室温孵育2~3h,PBS洗2min×3次;滴加反应增强剂,25℃孵育20min,PBS洗2min×3次;滴加二抗(1:100);25℃30min,PBS洗2min×3次;含0.05% DAB和0.01% H2O2的0.05mol/L Tris-HCl显色液显色10min,苏木精复染1min,分化、返蓝、梯度乙醇脱水、二甲苯透明、中性树胶封固。
5 结果判定
定性分析:选择黏膜下神经丛,分别记录3种神经标志物的表达特点,免疫组织化学染色后显微镜下观察肠道组织着色情况, PHOX2B胞核棕色判为阳性,calretinin及S-100胞质棕色判为阳性。
定量分析:对不同组标本均进行高倍显微镜下神经节细胞数量统计。再采用半定量方法记录不同组的各种标志物在细胞体的表达强度,++为强阳性;+为阳性;—为阴性。
6 统计学分析
采用SPSS22.0软件对数据进行分析。单因素方差分析考察PHOX2B、calretinin与S-100对照组肠壁内神经细胞数量的差异;PHOX2B、calretinin与S-100在HD的移行段内神经细胞数量的差异。在进行方差分析之前,要求数据方差齐性。不满足方差齐性的情况时,使用Welch’s Anova分析,并使用Games-Howell test来进行方差不齐情况下的两两比较。所有统计均以P<0.05为差异有统计学意义。
结 果
正常对照组肠壁中,PHOX2B特异性表达于神经节细胞胞核,calretinin表达于神经节细胞质、施旺细胞和周围细胞,S-100表达于神经纤维、施旺细胞和周围细胞,呈现特异的“空泡状”(图1;表2)。在HD移行段肠壁, PHOX2B、calretinin和 S-100的免疫组织化学表达与正常对照基本一致,但强度和密度较低(图1中)。HD狭窄段肠壁 ,PHOX2B无免疫组织化学表达,但calretinin和S-100仍呈免疫反应阳性,尤其S-100呈较强表达(图1)。
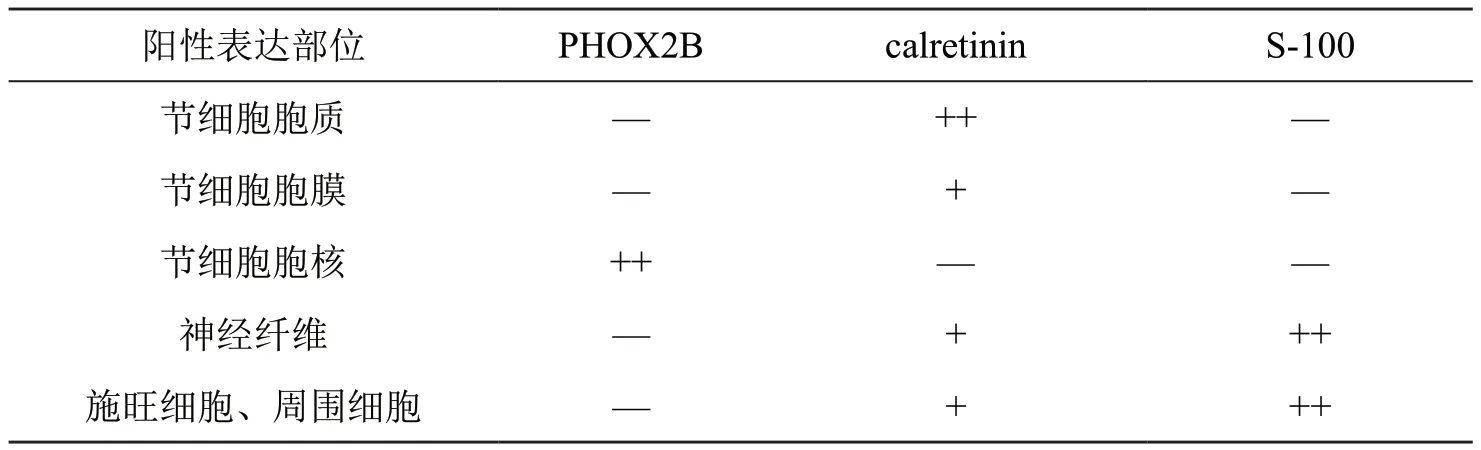
表2 PHOX2B、calretinin和S-100在正常肠壁神经组织中的免疫组织化学表达特点Tab. 2 Immunohistochemical expression features of PHOX2B, calretinin and S-100 in nerve tissues of the normal colonic walls
计数含有细胞核切面的完整节细胞,40例对照组粘膜下神经节
细胞中, PHOX2B免疫反应阳性节细胞数5.7±1.244,calretinin免疫反应阳性节细胞数3.0±0.816,S-100免疫反应阳性节细胞数3.525±0.96。3种标记物阳性神经节细胞数量不满足方差齐性(F=7.535,P=0.001),使用Welch’s Anova分析显示,各组之间节细胞数量差异显著(P=0.001);通过Games-Howell test进行两两比较显示,calretinin免疫反应阳性节细胞数与S-100免疫反应阳性节细胞数差异也具有显著性(0.01<P<0.05)(表3)。40例移行段粘膜下神经节细胞中,PHOX2B免疫反应阳性节细胞数2.9±0.672,calretinin免疫反应阳性节细胞数1.925±0.656,S-100免疫反应阳性节细胞数2.075±0.655。3种标记物阳性神经节细胞数量满足方差齐性(F=0.068,P=0.934),通过方差分析显示,PHOX2B免疫反应阳性节细胞数与calretinin组和S-100组均有明显差异(P<0.001),calretinin免疫反应阳性节细胞数与S-100免疫反应阳性节细胞数之间无差异(P>0.05)(表4)。
讨 论
不同成熟状态的神经节细胞有着形态和数量上的明显区别。显微镜下,正常成熟的神经节细胞呈簇状或单个分布,多边形,细胞核居中,核仁明显,大而圆,嗜酸,细胞质较宽,嗜酸淡染。相比较下,未成熟神经节细胞较小,胞质窄,核仁存在但不明显。 而HD狭窄段肠壁间可见显著增生、增粗的神经纤维(>40μm),束索状排列,但缺乏神经节细胞。此外,在日常病理诊断工作中我们还发现,未成熟神经节细胞往往与血管内皮细胞、周围的组织细胞及神经丛内的施旺细胞等难以区别。因此,我们引入免疫组织化学染色技术检测一些标志物,如calretinin和S-100等经典标志物,来区分难以辨别的神经节细胞。calretinin的主要优点是表达于正常肠管黏膜下层、黏膜肌层及肌间神经节细胞,定位在细胞胞质,强阳性表达,特异性相对较强。同样作为经典标志物之一的S-100,其优势是表达于神经胶质细胞和神经纤维,增生粗大的神经纤维表达水平更高,而神经节细胞呈阴性,呈现一种特异的“空泡状”表达。然而这一类经典标志物诊断针对HD移行段和狭窄段肠壁中的神经纤维、施旺细胞和周围细胞也呈阳性表达,容易造成假阳性结果,对观察不同成熟状态的节细胞和诊断HD带来极大的干扰。

图1 PHOX2B,calretinin,S-100在实验性先天性巨结肠症大鼠肠壁及正常对照大鼠肠壁中表达特征的免疫组织化学检测。正常对照和HD移行段比例尺,20μm;HD狭窄段比例尺,40μmFig.1 Immunohistochemical detection of PHOX2B, calretinin, S-100 in the colonic walls of experimental Hirschsprung’s disease rats and healthy control rats. Scale bar, 20μm in normal controls and transitional segments of HD colons and 40μm in narrow segments of HD colons

表3 正常结肠壁PHOX2B、calretinin 或S-100阳性神经节细胞计数Tab. 3 Number of ganglion cells positive for PHOX2B, calretinin or S-100 in the normal colonic walls

表4 实验性先天性巨结肠症移行段结肠壁PHOX2B、calretinin 或S-100免疫反应阳性神经节细胞计数Tab. 4 Number of ganglion cells positive for PHOX2B, calretinin or S-100 in the transitional segments of Hirschsprung’s disease colons
PHOX2B是近年来针对先天性中枢性低通气综合征(congenital central hypoventilation syndrome,CCHS)和神经母细胞瘤(neuroblastoma, NB)诊断推出的一种新的标记物。研究发现,PHOX2B是由位于第 4 对常染色体上的配对同源盒基因编码的有314个氨基酸的同源域蛋白(homeodomain protein),与调节心肺活动及消化系统的多种非肾上腺素能神经元的发育有密切相关[7-9]。此外,PHOX2B主要表达于副交感神经和肠神经的节前神经元[10]。在正常胚胎早期神经嵴发育过程中,一些转录因子如PHOX2B、Hand-2及锌指蛋白 GATA2等[11-14],具有诱导酪氨酸羟化酶(tyrosine hydroxylase,TH)和多巴胺羟化酶(dopamine β-hydroxylase,DBH)表达[15-17],并促进神经嵴细胞分化成为成熟的交感神经元的功能,其中PHOX2B在嗜铬细胞及交感神经元发育过程中最为重要[18]。小鼠胚胎学动物模型研究中发现,一旦成肠细胞进入到前肠间叶,即有PHOX2B蛋白表达,并仅在神经嵴细胞中最先移行到前肠的迷走神经嵴细胞中表达,而且贯穿肠神经元发育的始终。PHOX2B基因突变纯合子小鼠全胃肠道缺乏神经元,这也提示该基因表达调控过程可能与HD病变机制相似,且密切相关[19]。
本研究在HD动物模型中,发现PHOX2B仅表达于正常肠管黏膜下层、黏膜肌层及肌间神经节细胞,定位在细胞胞核,棕黄色强阳性表达,具有独特的“有或无”染色模式,并且着色背景非常干净,没有神经纤维、施旺细胞和周围细胞的假阳性表达,使免疫染色结果容易解读,神经节细胞定性非常准确。同时,对肠道正常段和HD移行段肠壁神经节细胞的判读明显优于calretinin和S-100,即阳性染色神经节细胞核完全暴露,方便观察肠道不同阶段以及不同发育状态下的节细胞具体形态和数量,这为我们利用动物模型研究HD肠神经节细胞发育的演变以及HD发病机制,提供了优良的前期实验条件。识别PHOX2B的特异性较高的新抗体,将大幅度提高HD病理诊断的准确率,也为冰冻切片快速免疫组织化学诊断HD奠定实验基础。此外,精准的诊断势必为临床手术定位HD肠道近、远端提供更为明确的指征,将有效缩短手术时间,从而改善患儿治疗及预后等情况。
综上所述,通过PHOX2B免疫染色标记HD肠壁,对其诊断的敏感性大大提高,PHOX2B免疫染色可以作为HD诊断的一个重要特异性辅助指标。

