着丝粒蛋白U(CENPU)在卵巢癌中的高表达及其临床病理学意义
任英俊,张晶晶,刘志平
(1郑州大学附属郑州中心医院妇产科,郑州 450007;2新郑市公立人民医院妇产科,郑州 451100
据2018肿瘤年报统计,卵巢癌(ovarian cancer,OC)发病率居女性所有恶性肿瘤的第4位和死亡率居第3位[1]。近年来,虽然对OC的研究已取得重大进展,但OC患者的5年生存率仍不理想[2,3]。而阐明影响OC进展的关键分子标志物,对今后开发靶向治疗和改善OC患者的存活结果至关重要。
着丝粒蛋白U(centromere protein U,CENPU)也称为MLF1IP和KLIP1,是常驻性着丝粒结合蛋白之一,近来研究发现其在乳腺癌、肺癌和膀胱癌等多种恶性肿瘤中表达上调,且其表达水平与肿瘤进展与远端转移呈正相关[4-6],而其在OC中的恶性生物学功能与机制并不十分清楚。因此,本研究检测CENPU在OC中表达情况,分析其表达与OC临床病理特征的关系,并进一步观察OC细胞中CENPU 表达水平与细胞增殖、迁移和侵袭的关系及相关机制。
材料与方法
1 细胞与试剂
人正常卵巢上皮细胞 IOSE80由上海雅吉生物科技有限公司提供,卵巢癌细胞HO-8910和3AO由美国ATCC提供;胎牛血清和DMEM培养基购自美国Gibco公司,CENPU短发夹RNA(sh-CENPU)、对照短发夹RNA(sh-Con)、CENPU抗体和GAPDH抗体购自美国Santa Cruz公司,Lipofectamine 2000试剂购自美国Invitrogen公司,CCK-8试剂盒、增强性ECL化学发光试剂盒和HRP标记的抗兔或抗小鼠IgG二抗购自上海碧云天生物科技有限公司,PI3K、p-PI3K、AKT和p-AKT抗体购自美国Cell Signaling Technology公司,姬姆萨染色液、RIPA裂解液、BCA蛋白定量试剂盒和生物素-链霉卵白素免疫组织化学染色试剂盒购自均北京索莱宝生物科技有限公司。
2 临床标本收集
选取2018年5月—2019年10月间郑州大学附属郑州中心医院行肿瘤切除术的40例OC患者的OC组织和癌旁组织,分为两部分,一部分直接冻存于-80℃冰箱,另外一部分用石蜡包埋后留存。所有OC患者均首次确诊,未进行放化疗。本研究方案经郑州中心医院伦理委员会批准,且所有患者对本研究方案均知情同意并签署知情同意书。
3 免疫组织化学染色
将石蜡组织切成4μm厚度的切片,并经脱蜡、水化和3%双氧水除去内源性过氧化氢酶后,用10%山羊血清封闭30min,并滴加CENPU抗体(1∶200)室温孵育2h,用PBS洗片3min×3次;滴加生物素标记的山羊抗小鼠IgG二抗(1:200)室温孵育30min,用PBS洗片3min×3次;滴加HRP标记的链霉卵白素工作液(1:300),室温孵育30min,用PBS洗片3min×3次,用DAB显色5min,自来水充分冲洗,苏木素复染,脱水、透明和封片后,Nikon Eclipse TE2000-S显微镜下观察并拍照。
4 细胞培养与转染
IOSE80、HO-8910和3AO均维持在含10%胎牛血清的DMEM培养基中,并置于37℃和5%CO2的细胞孵育箱中培养。收集处于生长期的HO-8910和3AO细胞,并按照5×105个/ml的密度重新接种于6孔板,次日观察细胞状态(约80%左右汇合)后,用Lipofectamine 2000试剂分别将30nmol/L的sh-CENPU和sh-Con转染至细胞,转染48h后收集细胞。
5 细胞增殖检测
将已转染sh-CENPU和sh-Con的HO-8910和3AO细胞按5×103个/孔的密度分别接种在96孔板中,并分别培养24、48和72h后,每孔加10μl CCK-8试剂并在37℃下孵育2h,用酶标仪测量450nm波长处的光密度(OD)值。
6 Transwell细胞侵袭实验
首先,用基质胶将Transwell小室(24孔,插入式)的聚碳酸酯膜(8.0μm孔径)涂覆。然后,取已转染sh-CENPU和sh-Con的HO-8910和3AO细胞,并分别用无血清培养基制备成浓度为1×105个/ml的细胞悬液,并分别取对应的细胞悬液(100μl)加到Transwell小室的上室侧;最后取600μl含10%胎牛血清的培养基加入到下室,培养细胞24h。取出Transwell小室插入物,并擦除膜上表面的细胞,然后将膜下表面的细胞用4%多聚甲醛固定后,用姬姆萨染色,用Nikon Eclipse TE2000-S显微镜拍照并对细胞计数。
7 划痕愈合实验
将已转染sh-CENPU和sh-Con的HO-8910和3AO细胞按照5×105个/ml的密度接种于6孔板,当细胞单层汇合时,用10μl枪头尖端沿着直径划一条直线,并用PBS洗除划下的细胞,继续培养24h。在0(基线)和24h时,用Nikon Eclipse TE2000-S显微镜拍照,并用Image J软件分析愈合的间隙区域的面积。
8 Western blot分析
用RIPA裂解缓冲液裂解细胞提取蛋白,经BCA蛋白定量试剂盒测定蛋白质浓度后,将等量的蛋白质通过8%-12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,随后转移至聚偏二氟乙烯(PVDF)膜。用5%脱脂乳封闭膜后,特异性一抗室温孵育2h(CENPU、AKT、PI3K抗体均1:2000,p-PI3K、p-AKT抗体均1:1000,GAPDH抗体1:10000),洗涤3次后,HRP标记的抗兔或抗小鼠IgG(1:2000)室温孵育1h,再次洗涤3次后,用增强型ECL化学发光试剂盒使得目的条带发光,并通过BioSpectrum凝胶成像系统(Bio-Rad,美国)成像。以GAPDH为内参,用Image J软件量化目的蛋白的相对表达量。
9 统计分析
结 果
1 卵巢癌组织和卵巢癌细胞高表达CENPU
首先用免疫组织化学和Western blot检测了OC组织和癌旁正常组织中的CENPU的表达情况,结果显示,相对于癌旁正常组织,CENPU在OC组织中表达水平明显增加(图1A、B)。相对于人正常卵巢上皮细胞 IOSE80,CENPU在卵巢癌细胞HO-8910和3AO中表达水平也明显增加(图1C)。对CENPU表达与OC临床病理特征的关系分析显示,CENPU表达与患者年龄无关,但与肿瘤的大小、转移和FIGO分期呈正相关(表1)。
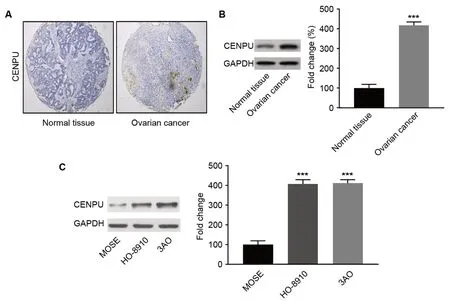
图1 CENPU在OC组织和OC细胞中的表达。A,癌旁正常组织和OC组织中CENPU代表性的免疫组织化学检测结果。B,检测癌旁正常组织和OC组织中CENPU水平的代表性Western blot检测结果与统计学分析;与癌旁正常组织相比:***P<0.001;n=40。C,Western blot检测卵巢上皮细胞和OC细胞中CENPU水平的代表性Western blot检测结果与统计学分析;与MOSE细胞相比:***P<0.001;n=3Fig. 1 Expression of CENPU in OC tissues and OC cells. A, representative immunohistochemical staining images of CENPU expression in the paracancer normal tissues and OC tissues; B, representative Western blot detection results and statistical analysis of CENPU levels in the paracancer normal tissues and OC tissues; ***P<0.001, compared with the normal tissue group; n=40; C, representative Western blot detection results and statistical analysis of CENPU levels in the ovarian epithelial cells and OC cells; ***P<0.001, compared with the MOSE cells; n=3
2 敲低CENPU抑制卵巢癌细胞的增殖、迁移与侵袭
为了分析CENPU对卵巢癌细胞系细胞生长的影响,我们采用sh-CENPU干扰OC细胞中CENPU的表达(图2),然后应用CCK-8、Transwell和细胞划痕愈合实验分别检测了细胞增殖、侵袭与迁移情况。结果显示,相比于sh-Con组,sh-CENPU组中HO-8910和3AO细胞的增殖(图3A、B)、侵袭(图3C、D)与迁移(图3E-G)能力均显著降低。
3 敲低CENPU抑制卵巢癌细胞的PI3K/AKT信号活性
PI3K/AKT信号广泛参与肿瘤细胞的恶性增殖、迁移和侵袭,为了研究敲低CENPU对OC细胞抑制增殖、迁移与侵袭的潜在机制,我们检测了敲低CENPU对OC细胞的PI3K/AKT信号活性的影响。Western blot检测显示,相比于sh-Con组,sh-CENPU组中HO-8910和3AO细胞的p-PI3K和p-AKT水平均显著降低(图4)。

表1 CENPU表达与OC临床病理特征的关系Tab. 1 Relationship between CENPU expression and clinical pathological features of OC patients
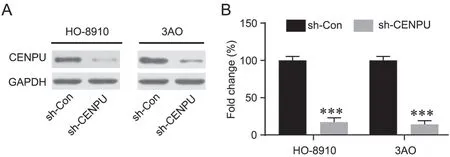
图2 sh-CENPU干扰效率鉴定。A,sh-CENPU干扰效率代表性Western blo检测结果。B,CENPU水平定量统计分析;与sh-Con组相比:***P<0.001;n=3Fig. 2 Qualification of CENPU knocking-down efficiency. A, representative Western blot detection results of CENPU knocking-down efficiency. B,quantitative and statistical analysis of CENPU level; ***P<0.001, compared with the sh-Con group; n=3
讨 论
肿瘤复发、化疗耐药和转移的问题仍然是OC临床治疗的挑战[7,8]。因此,鉴定OC转移的分子驱动因素对OC的新型靶向治疗的发展至关重要[9]。已有研究[4-6]表明,CENPU的表达与多种恶性肿瘤的进展密切相关。然而,CENPU在OC中的表达作用与意义却没有得到充分的关注。本研究检测到CENPU在OC组织和OC细胞中明显上调,且其水平与OC肿瘤大小、淋巴结转移和FIGO分期呈正相关,因此,推测CENPU水平与OC进展相关。随后研究发现,靶向抑制CENPU的OC细胞的增殖、迁移和侵袭能力受损,提示靶向抑制CENPU表达可能是一个潜在的OC治疗策略。
已有研究表明,包含OC在内的多种恶性肿瘤细胞中存在异常激活的PI3K/AKT信号,其高活性能促进肿瘤细胞包含恶性增殖、迁移、侵袭和化疗耐药等多种恶性生物学行为[10,11]。且已有文献[12,13]表明,在OC细胞中,抑制PI3K/AKT信号活性能抑制OC细胞增殖、迁移与侵袭。本研究显示,敲低CENPU能抑制OC细胞的PI3K/AKT信号活性,这提示敲低CENPU发挥抑制OC细胞增殖、迁移和侵袭的作用可能与其抑制细胞中PI3K/AKT信号活性有关。
综上,本研究结果显示CENPU在OC中高表达,且抑制其表达能降低OC细胞增殖、迁移与侵袭的能力,且这一作用可能与抑制PI3K/AKT信号活性相关。因此本研究进一步揭示了CENPU在OC中的功能,并为OC转移的机制提供了新的解释,并为靶向抑制CENPU表达治疗OC的策略提供了依据。

图3 敲低CENPU对OC细胞增殖、迁移与侵袭的影响。A和B,细胞增殖CCK-8法检测的统计学分析;C和D,细胞侵袭代表性Transwell法检测结果和统计学分析;E—G,细胞迁移代表性细胞划痕愈合法检测结果和统计学分析;与sh-Con组相比,**P<0.01,***P<0.001;n=3Fig. 3. Effect of CENPU knockdown on the proliferation, migration and invasion of OC cells. A and B, statistical analysis for cell proliferation detected by CCK-8 assay; C and D, representative results and statistical analysis of cell invasion detected by Transwell assay; E to G, representative results and statistical analysis of cell migration detected by cell scratch wound assay; **P<0.01, ***P<0.001, compared with the sh-Con group; n=3

图4 敲低CENPU对OC细胞的PI3K/AKT信号活性的影响。A,p-PI3K、PI3K、p-AKT和AKT水平的代表性Western blot检测结果;B,p-PI3K水平的统计学分析;C,p-AKT水平的统计学分析;与sh-Con组相比:***P<0.001;n=3Fig. 4 Effect of CENPU knockdown on the PI3K/AKT signaling activity in OC cells. A, representative results of p-PI3K, PI3K, p-AKT and AKT detected by Western blot; B, statistical analysis of the p-PI3K level; C, statistical analysis of the p-AKT level; ***P<0.001, compared with the sh-Con group; n=3

