Circ_0072088通过靶向miR-223-3p/PFN2轴促进乳腺癌细胞的生长
李海云,杨东光,洪秀丽,李金波,王辉
(河北省涿州市医院普外科,涿州 072750)
乳腺癌(breast cancer,BC)是全世界女性最常见的癌症之一,占所有女性癌症的30%[1]。每年约有167万名女性被诊断出患有BC,占所有癌症的25%,其中约有500000例死亡病例,BC是女性因癌症死亡的第二大主要原因[2,3]。目前,BC的治疗手段包括手术切除、放射治疗、化疗、内分泌治疗和靶向药物治疗等[4]。尽管由于早期诊断手段的进步和晚期治疗策略的改善,BC的死亡率已大大降低,然而,多重耐药性和复发转移仍然导致BC患者预后不良[5]。因此,为了提高BC患者的治愈率和生存率,寻找更多特异的BC生物标志物具有重要的意义。
长期以来,大量的非编码RNA被认为是基因组转录的没有确定的生物学功能副产物[6]。然而,越来越多的证据表明,非编码RNA广泛参与各种重要的生命活动的调节,包括癌症的发生与发展[7]。环状RNA(circRNA)是一类单链闭合非编码RNA分子,由真核生物中数千个基因的前体mRNA反剪接或跳转而形成,具有高度的稳定性、丰富性和物种间的进化保守性[8]。随着研究的不断深入,大量研究表明circRNA参与肿瘤的多种生物学过程,包括肿瘤细胞的增殖、侵袭和转移等[9,10]。例如,circ_0001073在BC中表达下调,其低表达水平与BC患者的不良预后显著相关;进一步研究显示,circ_0001073过表达能够显著抑制BC细胞的增殖并诱导癌细胞凋亡[11]。而circRAD18则被发现在BC组织和细胞中高表达,敲低circRAD18能够降低BC细胞的细胞活力,抑制集落形成以及癌细胞迁移、侵袭、上皮间充质转化和糖酵解,同时促进癌细胞的凋亡[12]。circ_0072088作为circ家族的一员,被发现在非小细胞肺癌中表达上调,进一步研究表明敲低circ_0072088抑制了非小细胞肺癌的增殖和转移[13]。然而circ_0072088在BC进展中的作用机制尚不清楚。
既往研究表明,微小RNA223-3p(micro RNA-223-3p,miR-223-3p)在BC中表达下调,且能够抑制BC细胞的增殖、糖酵解和集落形成[14]。而肌动蛋白结合蛋白profilin2(PFN2)在BC组织和细胞中表达明显上调,其异常上调与BC患者的不良预后有关,同时,高表达的PFN2能够促进BC细胞的迁移和侵袭能力[15]。本研究中,我们通过生物信息学预测和相关机制实验证实了miR-223-3p直接靶向PFN2,而miR-223-3p的表达又受到circ_0072088的靶向调控。我们首次发现了circ_0072088通过调控miR-223-3p/PFN2轴从而参与促进BC细胞的增殖、迁移和侵袭。
材料和方法
1 主要材料和试剂
非转移性人乳腺上皮细胞系MCF-10A和4种BC细胞系(BCAP-37、MDA-MB-231、T47D、BT-20)均购于中国科学院典型培养物保藏委员会细胞会(Wuhan, China)。DMEM培养基购于Hyclone公司(Logan,UT,USA);10%胎牛血清购于Thermo Fisher Scientific公司(MA,USA);青霉素,链霉素,核质分离PARIS Kit,胰蛋白酶和脂质体Lipofectamine 2000购于Invitrogen公司(Carlsbad,CA,USA);cDNA逆转录试剂盒、BCA蛋白定量试剂盒和RIPA蛋白裂解液购于Beyotime公司(Shanghai,China),细胞计数试剂盒-8(Cell Counting Kit-8,CCK-8)购于上海碧云天生物(Beyotime Biotechnology,Shanghai, China);抗profilin 2(ab191054)、抗 β-actin(ab6276,1:1000)和山羊抗兔抗体(ab205718)购于Abcam公司(Shanghai,China),双荧光素酶报告基因检测试剂盒购于Promega公司(Madison,WI,USA);MmagnaRIP RNA结合蛋白免疫沉淀试剂盒购于Millipore公司(Billerica,MA,USA)。
2 细胞培养和转染
将所有细胞接种于DMEM培养液中,并加入10%FBS和1%青霉素,并置于37℃和5%CO2的环境下培养。定期观察细胞生长情况,每2~3天换液,选取对数生长期的细胞用作后续实验。使用Lipofectamine 2000分别将circ_0072088过表达质粒、靶向circ_0072088的siRNA(si- circ_0072088)、miR-223-3p模拟物(miR-223-3p mimics)和miR-223-3p抑制剂(miR-223-3p inhibitors)转染BT-20细胞,同时转染空质粒作为对照组。
3 实时定量PCR (qRT-PCR)
用TRIzol试剂提取BC细胞系中的miRNA和circRNA,或用核质分离PARIS Kit分别提取细胞核和细胞质中的RNA,分别用One Step PrimeS-cript miRNA cDNA合成试剂盒、PrimeScript RT试剂盒将miRNA、mRNA逆转录成cDNA,然后用SYBR GreenPCR试剂和ABI7500 FAST Real-Time PCR 仪进行实时 qRT-PCR。采用 2-ΔΔCt方法评估miR-223-3p和circ_0072088(两者分别用U6、GAPDH作内参校正后)的表达水平,U6主要在细胞核中表达,GAPDH主要在细胞质中表达。引物序列如下:circ_0072088(正向:5’-GACCTCTGTCAGCGAGTTCC-3’; 反 向:5’-CTGCCTGTAACTCCTCTTCAGT-3’);miR-223-3p( 正向:5’-ACACTCCAGCTGGGTGTCAGTTTGTCAAAT-3’;反向: 5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTGGGGTAT-3’)GAPDH(正向:5’-AGAAGGCTGGGGCTCATTTG-3’;反向:5’-AGGGGCCATCCACAGTCTTC-3’)U6(正向:5’-CGCTTCGGCAGCACATATAC-3’;反向:5’-AAATATGGAACGCTTCACGA-3’)。
4 CCK-8实验
将各组细胞转染48h后,用胰蛋白酶消化并重悬细胞,调整细胞密度为2×103个/mL,并接种于96孔板中(每孔接种100 μl悬液),每组设5个复孔。随后,将培养板置于细胞培养箱中,继续培养24h、36h、48h和72h,每个时间点取一组细胞,每孔加入10μL CCK-8溶液,继续培养1.5h,在酶标仪波长450nm处测各孔的吸光度(OD)值,实验重复3次。
5 细胞划痕实验
分别取对数生长期的BT-20细胞,以2.5×105个/孔的密度接种于24孔板中,并置于37℃、5% CO2培养箱内培养。培养24h后,弃掉培养液,PBS冲洗2次,用200μl吸头垂直均匀用力划线,每孔约划3~4条线,再用PBS冲洗3遍后,每孔加入1mL无血清培养液,将24孔板放于倒置显微镜下观察并照相;将细胞重新放回37℃、5% CO2培养箱内培养,24h后采用同样的方法观察并照相。
6 Transwell实验
Transwell小室在实验前首先添加稀释后的基质胶(基质胶用DMEM按照1:8比例稀释),在37℃孵育1h。细胞转染24h后,用胰酶消化、并收集细胞。随后,用无血清DMEM完全培养基重悬细胞,细胞密度为1×105个/ml,将细胞接种于8μm孔径膜的Transwell小室上室,下室为500μl含10%PBS的DMEM完全培养基,继续培养6h。随后,用棉签擦拭掉膜上未迁移细胞,迁移并黏附在下室的细胞用4%多聚甲醛固定,进行结晶紫染色。随机选取膜上有代表性的5个高倍镜下视野计数穿膜细胞数,取3个复孔的均值表示肿瘤细胞的侵袭能力。
7 Western blot
含蛋白酶抑制剂的RIPA裂解缓冲液提取癌细胞的蛋白质,BCA试剂盒检测分离得到的蛋白质浓度。SDS-聚丙烯酰胺凝胶电泳分离蛋白质后将其转移至硝酸纤维素滤膜,5%脱脂奶粉封闭1h,分别加入抗体:抗PFN2和抗β-actin于4℃孵育过夜。洗涤滤膜后用结合过氧化物酶的二抗室温孵育1h。最后用ECL试剂盒显影条带。
8 双荧光素酶报告基因实验
首先分别通过生物信息预测miR-223-3p在circ_0072088和PFN2 mRNA的3′端非翻译区(3’UTR)上的结合位点,并用PCR对circ_0072088和PFN2 mRNA的3’UTR上miR-223-3p的结合位点进行扩增。随后将扩增片段插入到pmiR-GLO report载体,构建circ_0072088和PFN2野生型质粒(circ_0072088 WT和PFN2 WT)。用基因突变技术将部分核苷酸突变,构建circ_0072088和PFN2突变型质粒(circ_0072088 MUT和PFN2 MUT)。随后,分别将circ_0072088 WT、circ_0072088 MUT、PFN2 WT和PFN2 MUT与miR-223-3p mimics共转染细胞,用荧光素酶检测试剂盒进行检测,最后检测各组荧光素酶活性。
9 RNA immunoprecipitation (RIP) assay
使用Magna RIPTMRNA结合蛋白免疫沉淀试剂盒进行RIP分析。用miR-223-3p mimics或阴性对照转染BT-20细胞。48h后,将细胞在完全RNA裂解缓冲液中裂解。然后,将包括与人抗Argonaute2(Ago2)抗体或阴性对照抗体欧联的磁珠和RIP免疫沉淀缓冲液添加到细胞裂解物中。随后,将裂解物旋转过夜。第2d,于蛋白酶K孵育30min后,提取免疫沉淀的RNA。最后,进行qRT-PCR的琼脂糖凝胶电泳以鉴定circ_0072088和miR-223-3p的表达。
10 统计学分析
采用SPSS22.0统计软件进行统计学处理。符合正态分布的数据用均数±标准差()表示,两组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用 LSD-t法,P<0.05为差异有统计学意义。
结 果
1 Circ_0072088在BC组织中高表达
从公共基因芯片数据库Gene Expression Omnibus (GEO)下载GSE101123数据集,随后通过GEO2R分析差异基因,结果显示,circ_0072088在BC组织样本中显著高表达(图1 A、B)。
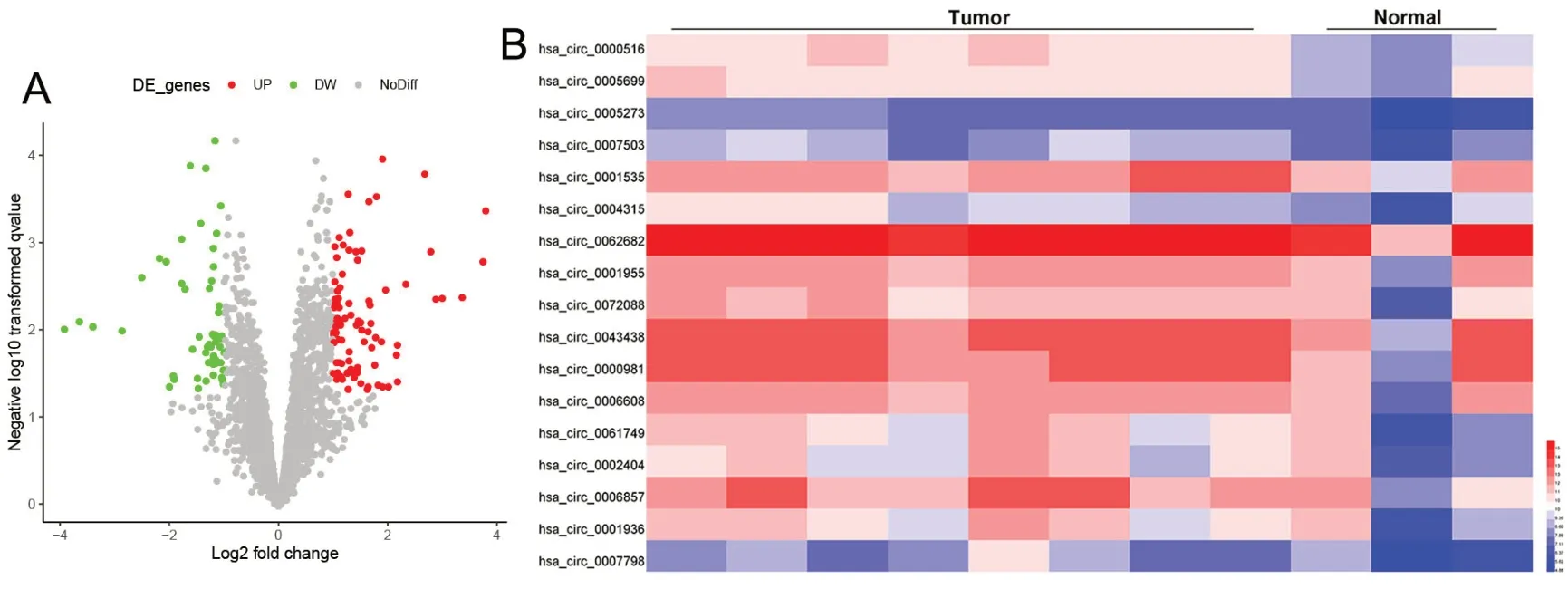
图1 从GEO数据库中下载基因芯片数据集GSE101123,分析BC组织样本和正常组织样本中circRNA的表达差异。A,火山图显示circRNAs表达水平;B,热图显示circRNAs的表达水平Fig. 1 The gene-chip dataset GSE101123 was downloaded from GEO database to analyze the circRNA expression in BC and normal tissues. A, volcano map showing the expression of circRNAs; B, heat map showing the expression of circRNAs
2 过表达circ_0072088促进BC细胞增殖、迁移和侵袭
首先我们通过qRT-PCR检测了circ_0072088在BC细胞中的表达水平,结果发现circ_0072088在4种BC细胞中的表达均显著高于非转移性人乳腺上皮细胞系MCF-10A(图2 A)。为了进一步验证circ_0072088对BC细胞生物学功能的影响,我们将circ_0072088过表达质粒转染BT-20细胞用于构建circ_0026344过表达的细胞模型(图2 B)。随后我们通过CCK-8法检测了细胞的增殖,结果发现,与对照组相比,circ_0072088过表达显著促进了BT-20的增殖(图2 C)。细胞划痕实验显示过表达circ_0072088显著促进BT-20细胞的迁移(图2D)。进一步,通过Transwell实验发现过表达circ_0072088显著促进BT-20细胞的侵袭(图2E)。
3 miR-223-3p是circ_0072088的直接靶标
qRT-PCR检测显示circ_0072088主要分布在细胞质中(图3 A)。为了进一步分析circ_0072088的作用机制,我们通过CircInteractome数据库(https://circinteractome.nia.nih.gov/)分析得知miR-223-3p和circ_0072088之间存在潜在的结合位点(图3 B)。随后,通过双荧光素酶报告实验发现转染miR-223-3p mimics能够显著抑制circ_0072088 WT的荧光素酶活性,而不影响circ_0072088 MUT的荧光素酶活性(图3 C)。通过RIP实验发现,miR-223-3p和circ_0072088在Ago2组中高度富集,而在IgG组中无明显富集(图3 D)。进一步检测发现,BT-20细胞中过表达circ_0072088显著抑制miR-223-3p的表达,而敲低circ_0072088则促进miR-223-3p的表达(图3 E)。
4 Circ_0072088通过吸附miR-223-3p促进BC细胞增殖、迁移和侵袭
为了进一步明确circ_0072088/miR-223-3p轴在BC细胞中的作用,我们在过表达circ_0072088的BT-20细胞中转染miR-223-3p mimics、qRT-PCR检测转染成功后(图4 A),通过CCK-8法、细胞划痕实验和Transwell实验分析miR-223-3p mimics对过表达circ_0072088促进BC细胞增殖、迁移和侵袭作用的影响,发现过表达circ_0072088促进BC细胞增殖、迁移和侵袭促进作用可被miR-223-3p mimics削弱(图4 B—D)。
5 circ_0072088通过吸附miR-223-3p促进PFN2表达
接下来我们通过StarBase在线分析数据库(http://starbase.sysu.edu.cn/)分析发现miR-223-3p和PFN2之间存在潜在的结合位点(图5 A)。随后我们通过双荧光素酶报告基因实验证实miR-223-3p可显著抑制野生型PFN2的荧光素酶活性,而对突变型PFN2的荧光素酶活性没有显著影响(图5 B)。最后我们通过Western blot实验检测证实过表达的circ_0072088可显著促进PFN2的表达,而上调miR-223-3p可部分逆转此作用(图5 C)。
讨 论
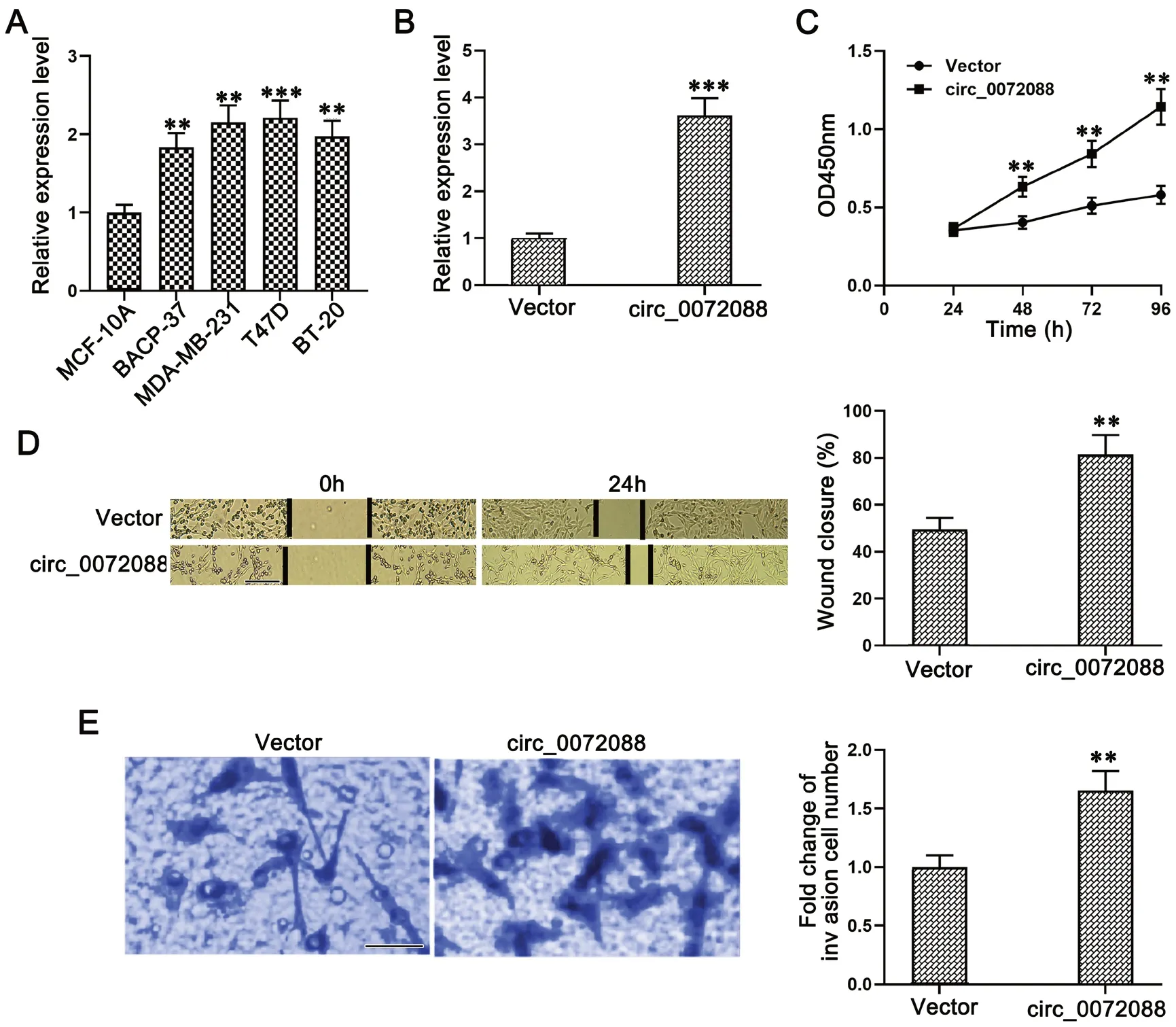
图2 过表达circ_0072088 对BC 细胞增殖、迁移和侵袭的影响。A,qRT-PCR 检测circ_0072088 表达;B,qRT-PCR 检测circ_0072088 转染效率;C,CCK-8 检测细胞增殖;D,细胞划痕实验检测细胞迁移(比例尺,100μm);E,Transwell 检测细胞侵袭,比例尺,25μm。与对照组比较:**0.01<P<0.01;***P<0.001Fig.2 The effect of circ_0072088 overexpression on the proliferation, migration and invasion of BC cells. A, circ_0072088 expression was detected by qRT-PCR; B, the transfection efficiency of circ_0072088 was detect by qRT-PCR; C, CCK-8 was used to detect cell proliferation; D, cell wound healing assay was used to detect cell migration (scale bar = 100μm); E, transwell assay was used to detect cell invasion (scale bar = 25μm). Compared with the control group: **P<0.01; ***P<0.001
circRNAs是一种稳定表达的非编码RNA,由于其具有环状结构,circRNA具有更高的稳定性,可以稳定存在于人体细胞核中,避免被RNA酶降解[16]。circ可作为基因表达的调节因子,可通过吸附miRNAs间接调节下游基因的转录,也可通过直接调节转录和干扰剪接调节下游基因的表达[17]。越来越多的证据表明,circRNA的异常表达与多种癌症的恶性行为有关,包括结直肠癌[18]、肝细胞癌[19]、肺癌[20]和BC[21]等。有研究表明,circ-HuR在胃癌中表达下调,且过表达的circ-HuR能够抑制胃癌细胞的生长和侵袭[22]。circ-SMAD7在卵巢癌中表达上调,进一步研究证实circ_SMAD7能够促进卵巢癌细胞的增殖、迁移和侵袭[23]。既往研究表明,多种circRNA在BC中异常表达,且具有不同的生物学功能[24]。例如,在BC组织和细胞中circ_0007255表达上调,而敲低circ_0007255则会抑制BC细胞的集落形成、细胞迁移和侵袭,这表明circ_0007255在BC的进展中作为肿瘤促进因子发挥作用[25]。而circ_0068033在BC组织和细胞系中表达下调,其过表达则会抑制BC细胞的生长、增殖、迁移、侵袭和肿瘤形成,并诱导细胞凋亡,这表明circ_0068033在BC中发挥抑癌作用[26]。circ_0072088在结直肠癌中表达下调,并与不良临床病理特征相关;circ_0072088通过调控miR-532-3p / FOXO4轴抑制肿瘤细胞的生长和转移[27]。然而,circ_0072088在NSCLC中表达上调,并与MAPK信号通路和PI3K-AKT信号通路的活性有关[28]。Circ_0072088通过调控miR-377-5p/NOVA2分子轴促进NSCLC的发生和发展[13]。在本研究中,我们首次发现了circ_0072088在BC中表达上调,进一步研究发现circ_0072088能够显著促进BC细胞的增殖、迁移和侵袭,这些实验结果表明circ_0072088在BC中发挥促癌作用,可能成为新的BC治疗靶点。
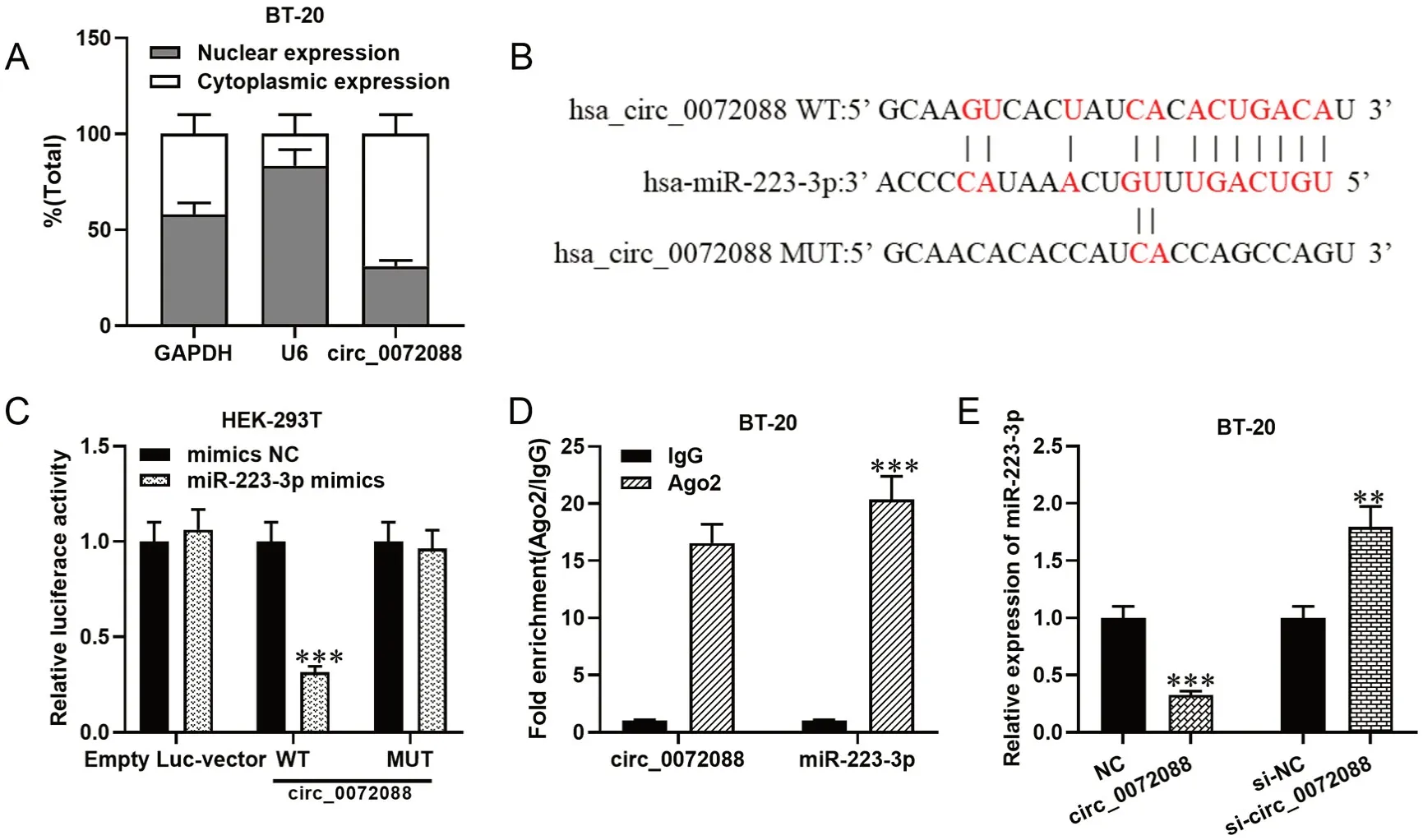
图3 circ_0072088作用靶标分析。A,qRT-PCR检测circ_0072088在细胞内的定位;B, CircInteractome数据库分析circ_0072088和miR-223-3p的潜在结合位点;C和D,双荧光素酶报告基因实验和RIP实验验证miR-223-3p与circ_0072088之间的靶向关系;E,qRT-PCR检测过表达或敲低circ_0072088对miR-223-3p表达影响;与对照组相比:**P<0.01; ***P<0.001Fig. 3 The analysis of the downstream targets of circ_0072088. A, the mainly epressed location of circ_0072088 in cells was determined by qRT-PCR.B, the binding site of circ_0072088 with miR-223-3p was analyzed with CircInteractome database; C and D, the targetting relationship between miR-223-3p and circ_0072088 was analyzed with dual luciferase reporter gene experiment (C) and RIP experiment (D); E, the effects of overexpression or knockdown of circ_0072088 on miR-223-3p expression were detected by qRT-PCR; Compared with the control group: **P<0.01; ***P<0.001
microRNA(miRNA)是一种短链RNA分子,长度为19到25个核苷酸,可通过结合靶基因mRNA的3′UTR区抑制靶基因的转录[29]。单个miRNA可以靶向数百个mRNA,并影响许多基因的表达,这些基因通常与功能性相互作用途径有关[29]。多种研究表明,miRNA参与肿瘤的各种生物学进程,包括癌细胞的增殖、凋亡、迁移和侵袭[30]。例如,miR-22在人结肠癌细胞中表达下调,进一步研究表明,miR-22抑制结肠癌细胞的增殖、迁移和侵袭[31]。MiR-148a在体外抑制肝细胞癌细胞的迁移、侵袭和增殖能力[32]。在BC中,miR-1204的表达增加与BC的预后不良有关,miR-1204在体外和体内均可促进BC细胞的增殖、上皮-间质转化和侵袭[33]。MiR-196a通过靶向Sprouty-related EVH1 domain-containing protein 1(SPRED1)促进BC细胞的生长和转移[34]。此外,miRNA的表达还受到circRNAs的靶向调节,circ-UBE2D2可通过吸附miR-1236和miR-1287促进BC的恶性进展[35]。本研究中,我们首次发现在BC中作为肿瘤抑制因子发挥作用的miR-223-3p是circ_0072088的下游靶点[14],再次证实了miR-223-3p在BC细胞的生长和转移中发挥抑制作用,且miR-223-3p能够削弱过表达circ_0072088对BC细胞增殖和转移的促进作用。这表明circ_0072088可通过吸附miR-223-3p抑制BC的恶性进展。
Profilins(PFNs)是一个肌动蛋白结合蛋白家族,包含由PFN1、PFN2、PFN3和PFN49编码的4种异构体,它们通过调节肌动蛋白聚合的动力学和肌动蛋白细胞骨架的重组参与细胞运动和细胞形状的改变[36]。Profilin家族中,profilin 2(PFN2)是唯一在中枢神经系统表达的成员,PFN2的异常表达与各种肿瘤细胞的增殖和迁移密切相关[37]。例如,PFN2在肺癌和结直肠癌中均可促进肿瘤细胞的生长和转移[38,39]。此外,PFN2还被发现在多种癌症中受到miRNA的直接调控以及circRNA的间接调控,例如,miR-30a-5p通过靶向非小细胞肺癌中的PFN2从而抑制了癌肿瘤细胞的上皮-间质转化进程[40]。而在BC中,circABCB10通过直接靶向miR-223-3p,间接促进了PFN2的表达,从而促进了BC的进展[14]。本研究中我们同样发现PFN2是miR-223-3p的靶基因,受到miR-223-3p的直接调控,进一步研究发现circ_0072088通过吸附miR-223-3p上调了PFN2的表达,从而促进了BC的增殖、迁移和侵袭。

图4 Circ_0072088吸附miR-223-3p对BT-20细胞活力,迁移和侵袭的影响。A, qRT-PCR检测共转染效率; B,CCK-8检测细胞增殖; C,细胞划痕实验检测细胞迁移; D,Transwell实验检测细胞侵袭的变化。与对照组相比:*P<0.05;**P<0.01;***P<0.001Fig. 4 Effect of mir-223-3p adsorption by circ_0072088 on the viability, migration and invasion of BT-20 cells. A, co-transfection efficiency of circ_0072088 and miR-223-3p mimics detected by qRT-PCR; B, CCK-8 assay for cell proliferation; C, cell wound healing assay for cell migration; D,Transwell assay for cell invasion. Compared with the control group: *P<0.05; **P<0.01; ***P<0.001

图5 MiR-223-3p 和PFN2 的靶向关系。A,miR-223-3p 对PFN2 结合位点的StarBase 数据库分析;B,miR-223-3p 对PFN2 靶向关系的双荧光素酶报告基因分析;与对照组相比:***P<0.001;C,Western blot 检测circ_0072088 和miR-223-3p 对PFN2 表达的影响Fig.5 Targeting relationship between miR-223-3p and PFN2. A, StarBase database analysis for binding sites of miR-223-3p with PFN2; B, dual luciferase reporter gene assay for targeting relationship between miR-223-3p and PFN2; Compared with the control: ***P<0.001; C, the effects of circ_0072088 and miR-223-3p on PFN2 expression detected by Western blot
总之,本研究首次发现circ_0072088通过直接靶向miR-223-3p间接促进PFN2的表达,从而促进BC的恶行进展。本研究扩展了我们对BC发病机制的认识,circ_0072088有望为早期诊断和改善治疗BC提供新的思路。

