1例人工养殖子一代中华鲟雌雄同体现象的初步研究
郑跃平,王轶凡,范厚勇,徐嘉楠,庄 平
(1.上海海洋大学水产与生命学院,上海 201306;2.上海市水生野生动植物保护研究中心,上海 200092;3.中国水产科学研究院东海水产研究所,上海长江口渔业资源增殖和生态修复工程技术研究中心,上海 200090;4.长江口水生生物资源监测与保护联合实验室,上海 200092)
中华鲟(AcipensersinensisGray,1835)隶属硬骨鱼纲(Osteichthyes)辐鳍亚纲(Actinopterygii)鲟形目(Acipenseriformes)鲟科(Acipenseridae)鲟属,是一种大型溯河产卵洄游性鱼类,主要分布于我国东南沿海大陆架水域和长江中下游干流,在我国南海也见其踪迹,是17种鲟属鱼类中分布纬度最低的一个物种,能适应较高的水温[1]。中华鲟个体大、寿命长、洄游范围广,是长江流域水生态系统中的伞护种和旗舰种[2]。20世纪后期,由于涉水工程建设、过度捕捞、环境污染及航运等人类活动的干扰,中华鲟赖以生存的栖息生境不断退化或功能丧失,其自然种群严重衰退[3-4]。1988年中华鲟被列为国家一级重点保护动物,1997年被列入《濒危野生动植物种国际贸易公约》(CITES)附录Ⅱ保护物种,2010年被世界自然保护联盟(International Union for Conservation of Nature,IUCN)升级为极危级(CR)物种[1]。目前已知的唯一产卵场(葛洲坝下产卵场)内繁殖群体数量已不足100尾[5]。自2013年开始,中华鲟出现自然繁殖中断现象:2015年中断,2017—2019年连续中断,野生中华鲟种群岌岌可危[6],如果不采取针对性抢救和保护措施,中华鲟或将在未来10~20年灭绝(野外灭绝EW)[7]。
现阶段,在《中华鲟拯救行动计划(2015—2030)》[8]框架下,除了采取强有力的就地保护措施,加强产卵场、洄游通道、索饵场等关键栖息地保护之外,开展人工蓄养保种、全人工繁殖和扩大人工群体规模也是中华鲟保护的重要举措,这是采用人工条件保持物种延续的主要途径。我国科研人员对于中华鲟养殖环境[9-10]、养殖密度[11]、营养需求、驯化投喂[12]、亲本培育[13]、人工催产[14]、生理生化[15-17]等诸多方面已经开展了相关的科学研究,并在中华鲟全人工繁殖方面取得了突破,据报道,2013年成功繁育出二万三千余尾中华鲟幼鱼[18]。
关于中华鲟人工养殖个体的雌雄同体现象,迄今尚未见相关报道。柯福恩等[19]曾对1例野生中华鲟成鱼雌雄同体现象作过初步研究报道。而对于鲟鱼类雌雄同体的研究,仅俄罗斯鲟(A.gueldenstaedtii)[20]、大西洋鲟(A.oxyrinchus)[21]、小 体 鲟(A.ruthenus)[22]、密 西 西 比 铲 鲟(Scaphirhynchusplatorynchus)[23]有过少量报道。其中均提到,雌雄同体现象的出现可能与环境污染有关。因此有必要针对此次发现的雌雄同体中华鲟,通过分析其生长特征、性腺外观、性腺组织学特征等情况,既可为中华鲟雌雄同体现象提供佐证案例,也可为中华鲟人工养殖与繁殖工作中中华鲟雌雄同体的诱发机制研究提供参考。
1 材料与方法
1.1 实验用鱼
实验用鱼为人工养殖条件下偶然发现的1尾雌雄同体子一代中华鲟,该尾鱼系2004年人工繁殖的子一代,2005年从中华鲟人工繁殖机构引进,先后暂养于上海市水生野生动植物保护研究中心嘉定临时基地和崇明基地。该尾中华鲟于2019年3月因腹腔鳔背壁上方、脊索下脉管软骨骨裂引发背大动脉内出血死亡,死亡时体长163 cm,体质量51.54 kg,在死亡原因调查过程中发现该尾中华鲟存在雌雄同体现象。
1.2 生长情况分析
分析该尾鱼从引进到死亡的生长数据,采用Excel和SPSS 15.0对该尾中华鲟的生长指标进行统计分析,探究该尾鱼生命过程中的生长情况。
1.3 性腺组织影像观察及石蜡切片
参照文献[13]方法,从中华鲟精巢和卵巢分别采集1.5 cm×1.5 cm×0.3 cm的组织块,放置于10%中性甲醛溶液内固定,24 h后按照组织石蜡切片制备流程,经乙醇和二甲苯脱水、石蜡包埋、常规切片、HE染色、中性树脂封片后,于尼康光学显微镜(Nikon ECLIPSE 50i)下观察并拍照记录。
2 结果与讨论
2.1 生长情况
从该尾鱼引进至死亡的14年间,其全长由85 cm增至196 cm,体长由69 cm增至163 cm,体质量由3.76 kg增至51.54 kg。整体生长情况与研究中心其他中华鲟生长情况基本一致。1~6龄为该中华鲟全长、体长快速增长期,年均增长率均在16.26%以上,6龄后体长增长明显减缓,10龄后基本处于停滞状态。1~8龄为该中华鲟体质量快速增长期,年均增重率在21.12%以上,8龄后体质量增长减缓且进入波动期,存在负增长现象(表1)。
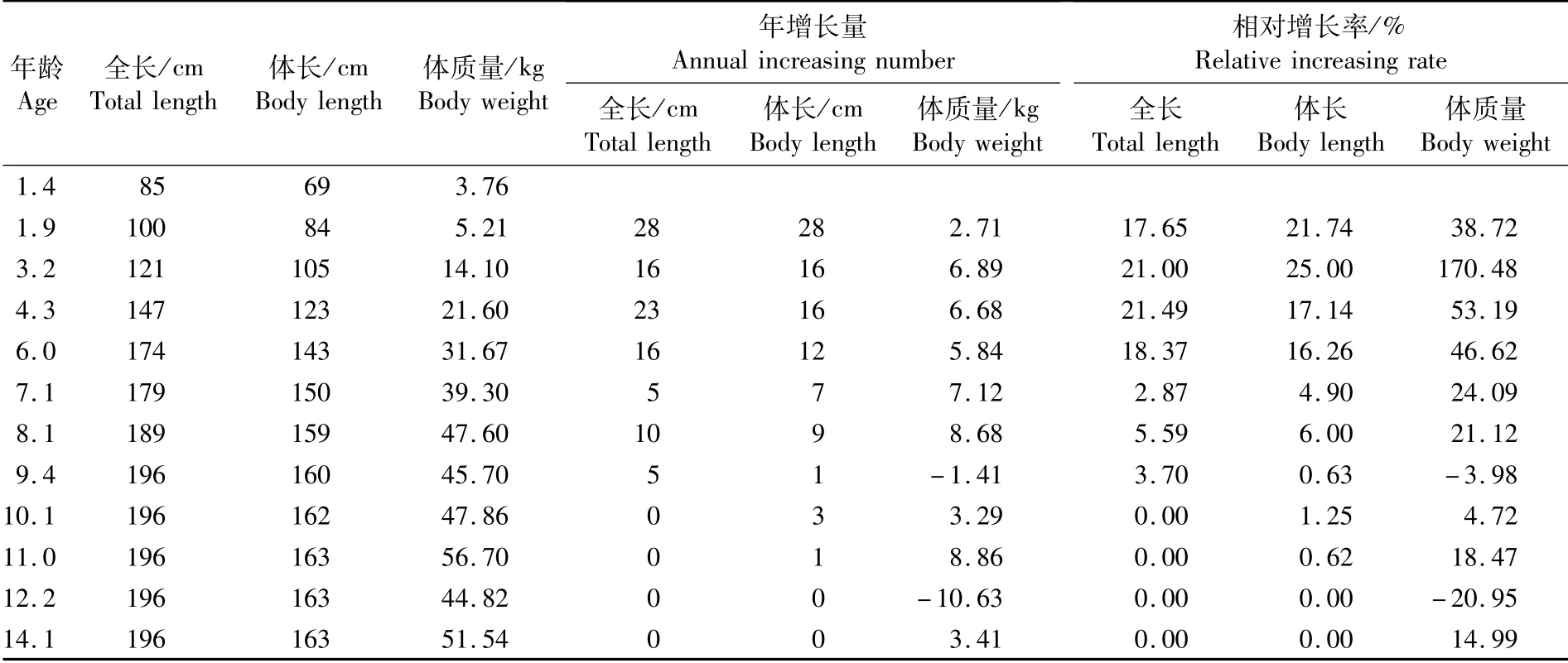
表1 实验用鱼生命周期内主要生长指标变化情况Tab.1 Changes of main growth indexes in life cycle of experimental fish
2.2 性腺基本外观
解剖观察可见,鱼腹腔背部两侧性腺,以精巢为主,卵巢间隔分布在精巢上(图1)。精巢白色,表面光滑,质地较硬,呈块状。卵巢淡黄色,表面点状凸起,质地柔软,肉眼隐约可见卵粒。取下两侧性腺,经测量称重,右侧性腺长64 cm、宽4.0~7.2 cm、重0.422 kg,左侧性腺长61 cm、宽3.6~8.5 cm、重0.436 kg。性腺上附着有占比较大的脂肪组织。

图1 雌雄同体中华鲟性腺外观Fig.1 Appearance of gonad of hermaphroditism Acipenser sinensis
有关鲟形目鱼类雌雄同体现象研究报道较少,柯福恩等[19]在1988年曾报道1例成熟的雌雄同体野生中华鲟,该鱼全长278 cm,体长236 cm,体质量115 kg,年龄17龄左右。本案例中华鲟为14+龄子一代中华鲟,为亚成体,两尾雌雄同体中华鲟均体型较大,且性腺均以精巢为主,精巢和卵巢发育期基本同步。本例中华鲟在体型和年龄上,较早期报道的案例小,性腺发育程度也不及早期报道的个体,但两个案例呈现基本的同质性,表现为性腺中均以精巢为主体,精卵巢发育基本同步。推测雌雄同体的现象极有可能是在性腺分化时期,直接分化为两种不同的性腺,而不是受外界因素诱导引起后期的性逆转。两个案例中的中华鲟个体生长环境不同,但雌雄同体现象表现形式相近。本案例的发现,为中华鲟雌雄同体研究提供了一定参考与方向。
2.3 性腺组织石蜡切片
通过性腺组织石蜡切片观察,可见性腺部分区域存在精卵共存的现象,在精细胞密集区可见精原细胞、初级精母细胞、育精囊,发育时相相当于Ⅱ期精巢,见到的卵细胞多为初级卵母细胞,卵母细胞卵径204~367μm,细胞核居中,细胞质中未见明显卵黄颗粒,发育时相相当于Ⅱ期卵巢(图2)。
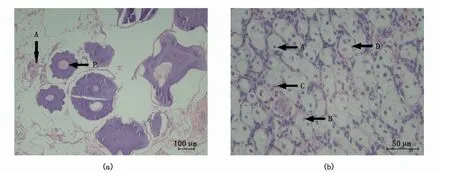
图2 雌雄同体中华鲟性腺组织切片Fig.2 Section of gonad tissue of hermaphroditism Acipenser sinensis
雌雄同体是指雌雄两性出现在同一个体上的现象,是鱼类性征多样性和特殊性的主要表现之一。世界上约有1%的脊椎动物存在雌雄同体现象,几乎都是鱼类[24-25]。鱼类由于其物种的多样性和长期适应栖居环境的变化,导致其生殖策略的多样性。鱼类的生殖现象包括但不限于雌雄异体、雌雄同体、卵生、胎生和卵胎生等。一些鱼类的性染色体尚处于分化的初始状态,这可能是鱼类性别分化易变的原因之一[25]。
已有报道的雌雄同体鱼类约四百六十多种,隶属17目41科,如鲻(Mugizcephazus)、鲤(Cyprinuscarpio)[26]、青鳉(Oryziaslatipes)[27]、黄鳝(Monopterusjavanensis)[24]、日本鳗鲡(Anguilla japonica)[28]、黑鲷(Acanthopagrusschlegeli)[29]等。其中,鮨科鱼类普遍存在功能性雌雄同体的现象,鲷科鱼类在特定年龄段存在性逆转现象,其余多数鱼类可以通过人工激素诱导或者在环境激素的影响下出现非功能性雌雄同体现象。
铃木克美和熊国强[30]对硬骨鱼类雌雄同体现象进行了较为深入的研究,提出了正常或常规性雌雄同体现象(normal hermaphroditism)、非正常或畸形性雌雄同体现象(abnormal hermaphroditism)、功能性雌雄同体现象(functional hermaphroditism)、非功能性雌雄同体现象(non-functional hermaphroditism)的划分法。对中华鲟雌雄同体现象分析发现,由于至今报道的雌雄同体中华鲟案例极少,可初步认定中华鲟雌雄同体为非正常或畸形性雌雄同体现象,而对于其雌雄同体是属于功能性还是非功能性雌雄同体,还需继续开展更多的案例分析。
激素及环境污染物是引起或影响鱼类雌雄同体现象的重要因素,革胡子鲇(Clariaslazera)在甲基睾丸酮的人工诱导下会出现能够自体繁殖的雌雄同体[31]。国外学者研究表明,小体鲟可以通过鲟鱼脑垂体的使用诱导出一定比例的雌雄同体[22],施氏鲟(A.sinensis)可以通过雌二醇诱导出雌雄同体[28],密西西比铲鲟在氯丹超标的密西西比河内也发现大量雌雄同体[23]。据此,是否在本研究雌雄同体中华鲟生活史的某个阶段,其生长环境中存在一定浓度的环境激素,进而引起中华鲟雌雄同体的产生,有待下一步深入研究。
人工养殖条件下雌雄同体中华鲟的发现,为中华鲟雌雄同体现象提供了一个例证,鲟鱼中雌雄同体的诱导及性别的转变已有报道,中华鲟雌雄同体样本的发现与研究,或许可为中华鲟的人工繁殖与亲本培育提供新的思路,为中华鲟的人工保种和物种保护提供新的研究方向,未来需要对此现象及其产生机制进行进一步的研究与分析。

