不同养殖密度条件下大黄鱼的生理响应及应激敏感指标的筛选
虞嘉玥,王 杰,孙 鹏,唐保军
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,农业农村部东海与远洋渔业资源开发利用重点实验室,上海 200090)
在水产养殖生产中,养殖人员常采取提高养殖品种养殖密度的方式来获得更高的经济效益。尽管高密度养殖可以提高水体利用率和单位面积的养殖产量,但同时也存在因养殖密度过高而引发应激反应的风险。养殖密度与鱼类的成长和健康状况等显著相关,由高密度引起的应激反应可能增加鱼体的能量消耗,降低机体的免疫能力,增加鱼类疾病发生的可能性,并导致养殖群体生长率和存活率的降低[1-3]。近年来,国内外学者针对海水鱼类密度应激开展了多项研究,涉及鱼类的生长、营养、代谢以及免疫调节等多个方面。例如,高密度环境可导致点带石斑鱼(Epinephelusmalabaricus)皮质醇和血糖含量升高,且过高或过低的养殖密度均会对其生长和代谢造成负面影响[1];对大菱鲆(Scophthalmus maximus)的研究发现,高密度养殖会降低其机体的免疫能力,而低密度环境则有助于提升其免疫力[4];黄姑鱼(Nibeaalbiflora)的饵料系数与养殖密度呈显著的负相关性,而鱼体血清中溶菌酶(lysozyme)活力随养殖密度的增高而降低,故高密度养殖会对黄姑鱼的代谢和非特异性免疫造成负面影响[2];此外,高密度养殖还会降低塞内加尔鳎(Soleasenegalensis)体内热激蛋白70(HSP70)基因、胰岛素样生长因子1(IGF-1)基因、溶菌酶以及抗菌肽(HAMP1)基因等多种基因的表达量,从而在应激适应、生长调节和非特异性免疫等方面影响鱼体[3]。可见,研究鱼类在不同密度环境下的生理变化,阐明鱼体密度应激的适应性调节规律,不仅有助于在生产实践中采用适当的养殖密度以提高养殖效益,还有助于鱼类密度应激监测指标的筛选。
大黄鱼(Larimichthyscrocea)属于近海暖温、集群洄游性鱼类,为我国东南沿海的重要海水网箱养殖鱼类。目前,其人工繁育与养殖技术已趋于成熟,实现了产业化养殖,养殖产量也居于我国海水养殖鱼类产量的前列。鉴于大黄鱼在我国海洋渔业中的重要性,近年来科研人员在诸如大黄鱼生理学等方面已经开展了许多研究[5-8],然而,目前对于大黄鱼密度应激适应机制的研究尚未见报道。本研究分析了不同养殖密度下大黄鱼体内生理指标的变化规律和重要基因的分子表达特征,探讨了应激状态下鱼体的适应性调节过程,以期为大黄鱼密度应激适应机制研究提供参考,为大黄鱼工厂化健康养殖生产和管理提供理论依据。
1 材料与方法
1.1 实验材料
实验用鱼为福建省宁德市富发水产有限公司人工培育的大黄鱼,平均体质量为(89.06±11.70)g。实验前于室内8 t的水泥池中暂养2周,所用海水经过砂滤处理,水温为(26.5±0.5)℃,盐度26.0±0.5;使用气泵进行连续充气,每天分别在上午(08∶00)和下午(13∶00)换水1次,换水量为总水体的3/4,每日上午(09∶00)和下午(14∶00)各投喂颗粒饲料1次。
1.2 实验设计
处理过程在12个0.5 t的PVE缸中进行,实验前根据网箱正常养殖密度设置300%、200%、100%和50%共4个密度梯度,每个密度梯度设3个平行,相应地将12个缸平均分为4组(A1~A3、B1~B3、C1~C3、D1~D3,其中C组为标准养殖密度对照组),并将暂养的大黄鱼转入。每个平行大黄鱼数目分别为390、260、130、65尾。处理和取样过程中记录各组大黄鱼的行为状况和死亡率,并根据存活情况和密度设置调换缸体和水位,以保证整个实验期间各组大黄鱼密度始终分别维持在34.2 kg·m-3(A组)、22.8 kg·m-3(B组)、11.4 kg·m-3(C组)和5.7 kg·m-3(D组)。
1.3 样品采集
分别在处理的0、6、12、24、48、72、96、120 h对实验用鱼进行取样,取样时每次从各缸中随机选取6尾大黄鱼个体,迅速用MS-222麻醉后进行尾静脉取血和解剖。无菌采集肝脏组织,一部分直接保存于液氮中,其余部分准确称重后经匀浆和离心(3 000 r·min-1,10 min)取得上清液用于酶活力等指标的测定;血液样品放置在4℃静置6 h后进行离心(4 000 r·min-1,10 min),收集上层血清用于皮质醇、血糖等指标测定;每个样品重复测定3次。皮质醇、生长激素(growth hormone,GH)和胰岛素样生长因子1指标采用ELISA方法测定,超氧化物歧化酶(superoxide dismutase,SOD)和血糖指标采用比色法测定,过氧化氢酶(catalase,CAT)、溶菌酶和乳酸等指标采用分光光度法测定,测定所用试剂盒购于南京建成生物工程研究所,具体测定方法参照说明书进行。
1.4 基因表达分析
取出液氮保存的肝脏组织样品,以C组0 h样品作为对照,对最高密度组(A组)样品进行基因表达分析。采用Trizol试剂(上海生工)提取大黄鱼总RNA,经完整性和纯度检测后反转成cDNA作为模板进行基因表达分析,所有操作均按照试剂盒说明书进行。本次基因表达分析选用3个基因,分别为葡萄糖-6-磷酸酶(G6pase)基因、胰岛素样生长因子-1(IGF-1)基因和C型溶菌酶(C-lysozyme)基因,涉及应激调控相关的能量代谢、生长调控和免疫调节等生物进程,并以β-actin作为内参。实验所涉及引物序列如表1所示,其中G6pase基因引物序列参考实验室已有大黄鱼基因组序列,采用Primer 5.0软件设计;其余两个基因IGF-1和C-lysozyme采用已有引物进行合成和扩增分析[9-10]。qPCR采用10μL反应体系,包含2×SYBR Premix ExTaq(TaKaRa)5 μL、正反向引物各0.5μL、cDNA模板0.5μL,并以灭菌水补足至10μL。反应条件为:95℃预变性2 min;95℃15 s,58℃30 s,72℃30 s,共计40个循环。

表1 定量PCR所用引物Tab.1 Primers used for qPCR analysis
1.4 数据分析
荧光定量实验结果从仪器读取,用2-△△CT法分析计算目的基因的相对表达量,用Excel软件对数据进行统计,数据以平均值±标准误(x±SE)的形式表示;利用SPSS 25.0软件对不同密度条件下各组样品生理指标数据进行单因素方差分析(one-way ANOVA),并对各组的差异数据做LSD多重比较,P<0.05表明差异显著。
2 结果与分析
2.1 不同养殖密度对大黄鱼死亡率和皮质醇变化的影响
实验期间C组和D组大黄鱼未出现死亡个体,A组和B组的死亡率变化趋势如图1所示。随着养殖密度的增高,死亡率也有所增加,而在处理6 h和72 h时,两组鱼死亡率出现显著性差异(P<0.05)。B组个体在处理6 h时开始出现死亡个体,最高死亡率出现在处理24 h时,之后便逐渐降低;而A组鱼在处理6 h时即出现最高死亡率,高死亡率出现的时间明显提前,在稳定一段时间后,到应激处理48 h至72 h时再次出现死亡高峰。

图1 密度胁迫下A组和B组大黄鱼的死亡率变化趋势Fig.1 Changes of mortality in Larimichthys crocea under density stress(group A and B)
如图2所示,A组大黄鱼血清皮质醇含量快速升高,在处理6 h时含量显著高于0 h(P<0.05),在处理12 h时达到最大值,且在6 h和12 h时均显著高于C组(P<0.05)。B组大黄鱼皮质醇先快速升高并在处理12 h时显著高于C组;随后,皮质醇含量逐渐降低,并最终与C组无显著差异(P>0.05)。在整个实验期间,C、D两组大黄鱼皮质醇含量均无显著性变化(P>0.05)。

图2 不同养殖密度下大黄鱼的皮质醇含量变化Fig.2 Changes of cortisol concentration in L.crocea under different stocking densities
2.2 不同养殖密度下大黄鱼血糖和乳酸等能量代谢指标变化
如图3-a所示,A组个体中血糖含量在处理12 h时显著高于C组(P<0.05),其峰值出现在处理72 h时;随后,在处理96 h血糖含量开始降低,并最终与C组无显著性差异(P>0.05)。B组大黄鱼血糖含量也与A组呈现相似的变化趋势,但峰值出现在处理48 h时。C组和D组大黄鱼血糖含量整个实验期间无显著性变化(P>0.05)。
A组大黄鱼血清中乳酸含量处理后快速升高(图3-b),处理6 h时,血清中乳酸含量显著高于C组(P<0.05),在处理12 h时达到最高值。在整个处理过程中,B组和C组乳酸含量无显著性变化(P>0.05)。D组乳酸含量在处理6 h时显著降低(P<0.05),之后又逐渐恢复到接近C组水平。
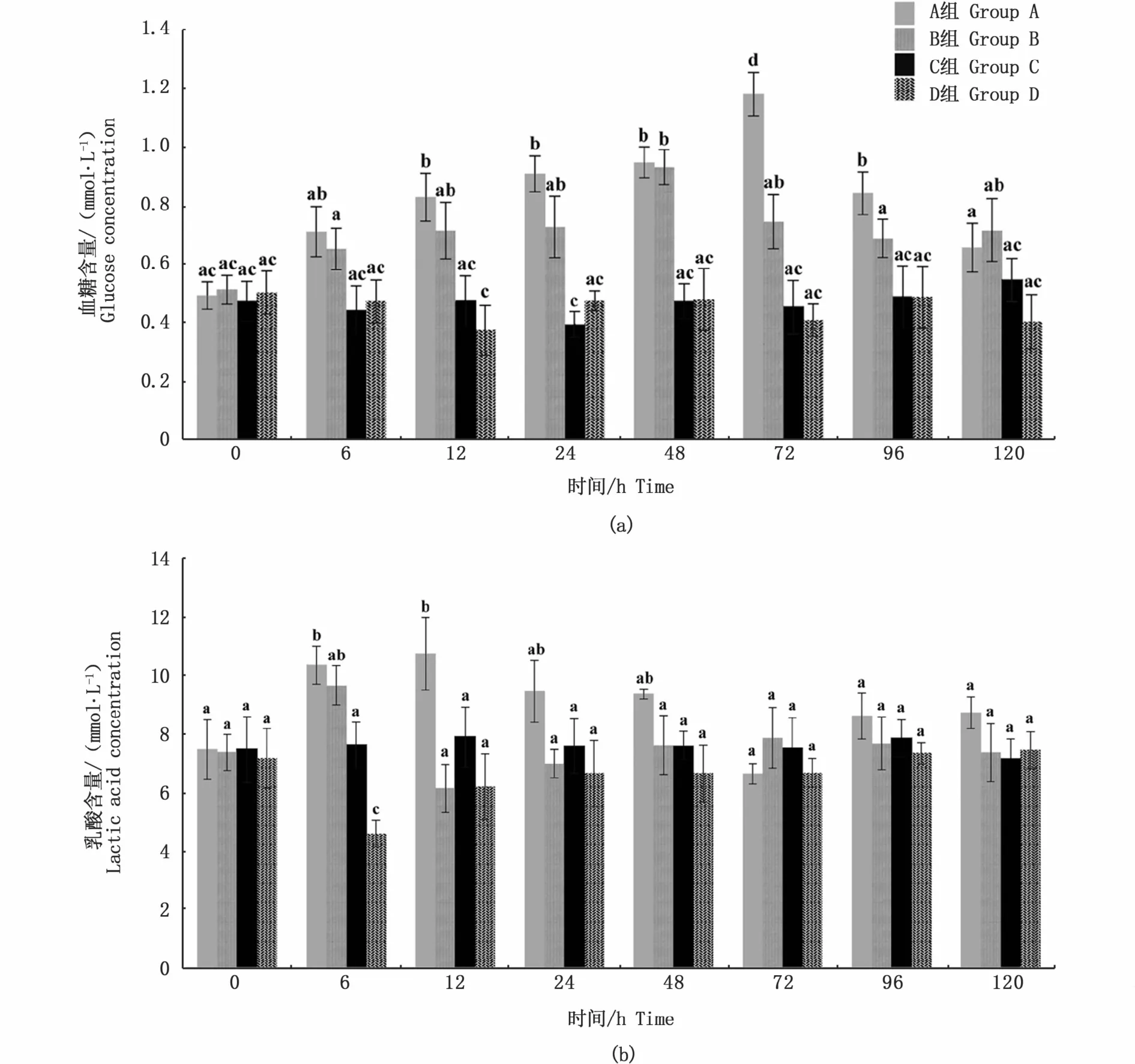
图3 不同养殖密度下大黄鱼的血糖和乳酸含量变化Fig.3 Changes of glucose and lactic acid concentration in L.crocea under different stocking densities
2.3 不同养殖密度下大黄鱼抗氧化能力变化
在处理24 h时,A组鱼肝脏中SOD活力快速升高并显著高于C组(P<0.05)(图4-a);随后,其活力逐渐降低并恢复至接近C组的水平。B组SOD活力也呈现与A组类似的趋势,但最大值出现在处理48 h时。C、D组SOD活力在整个处理过程中无显著性变化(P>0.05)。
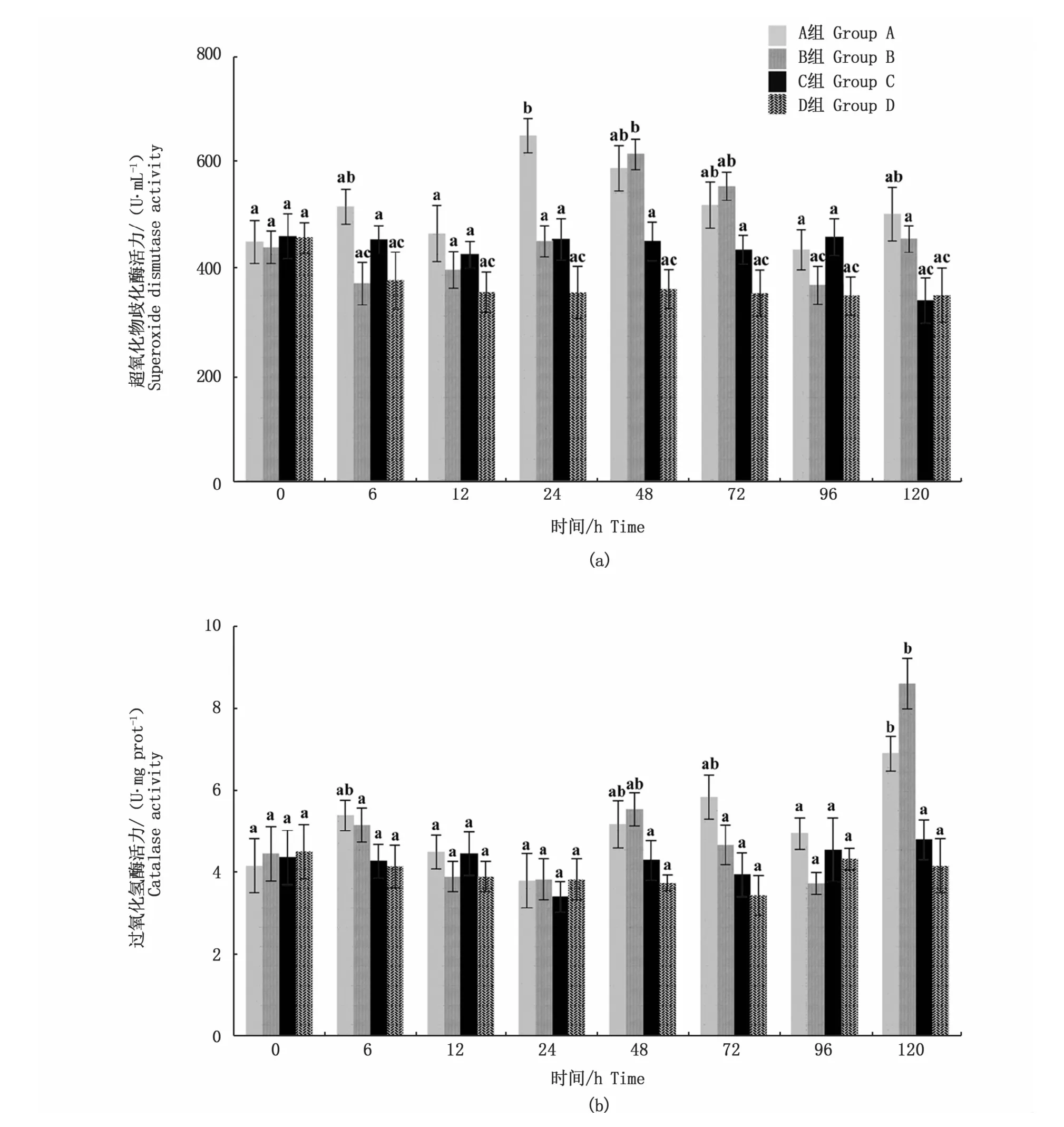
图4 不同养殖密度下大黄鱼超氧化物歧化酶和过氧化氢酶活力变化Fig.4 Changes of SOD and CAT activity in L.crocea under different stocking densities
A、B组大黄鱼CAT活力在处理120 h时均快速升高并显著高于C组(P<0.05)。C、D两组CAT活力在处理过程中未发生显著性变化(P>0.05)。
2.4 不同养殖密度下大黄鱼生长调控指标变化
如图5所示,各组大黄鱼血清中生长激素含量在整个处理过程中始终未发生显著性变化(P>0.05)。C、D两组血清胰岛素样生长因子-1含量整个处理过程无显著性变化(P>0.05),但A、B两组血清胰岛素样生长因子-1含量显著升高。A组血清胰岛素样生长因子-1在处理24 h至48 h阶段显著高于C组(P<0.05);B组血清胰岛素样生长因子-1含量在处理24 h及72~96 h阶段显著高于C组(P<0.05);随后,两组个体的血清胰岛素样生长因子-1含量又快速降低至与C组无显著差异(P>0.05)。

图5 不同养殖密度下大黄鱼生长激素和胰岛素样生长因子-1含量变化Fig.5 Changes of GH and IGF-1 concentration in L.crocea under different stocking densities
2.5 不同养殖密度下大黄鱼溶菌酶活力变化
C、D组大黄鱼血清中溶菌酶活力(图6)在整个处理阶段无显著性变化(P>0.05)。A、B组溶菌酶活力在处理6 h时显著降低(P<0.05),随后回升一段时间后又再次降低,并在处理120 h时显著低于C组(P<0.05)。
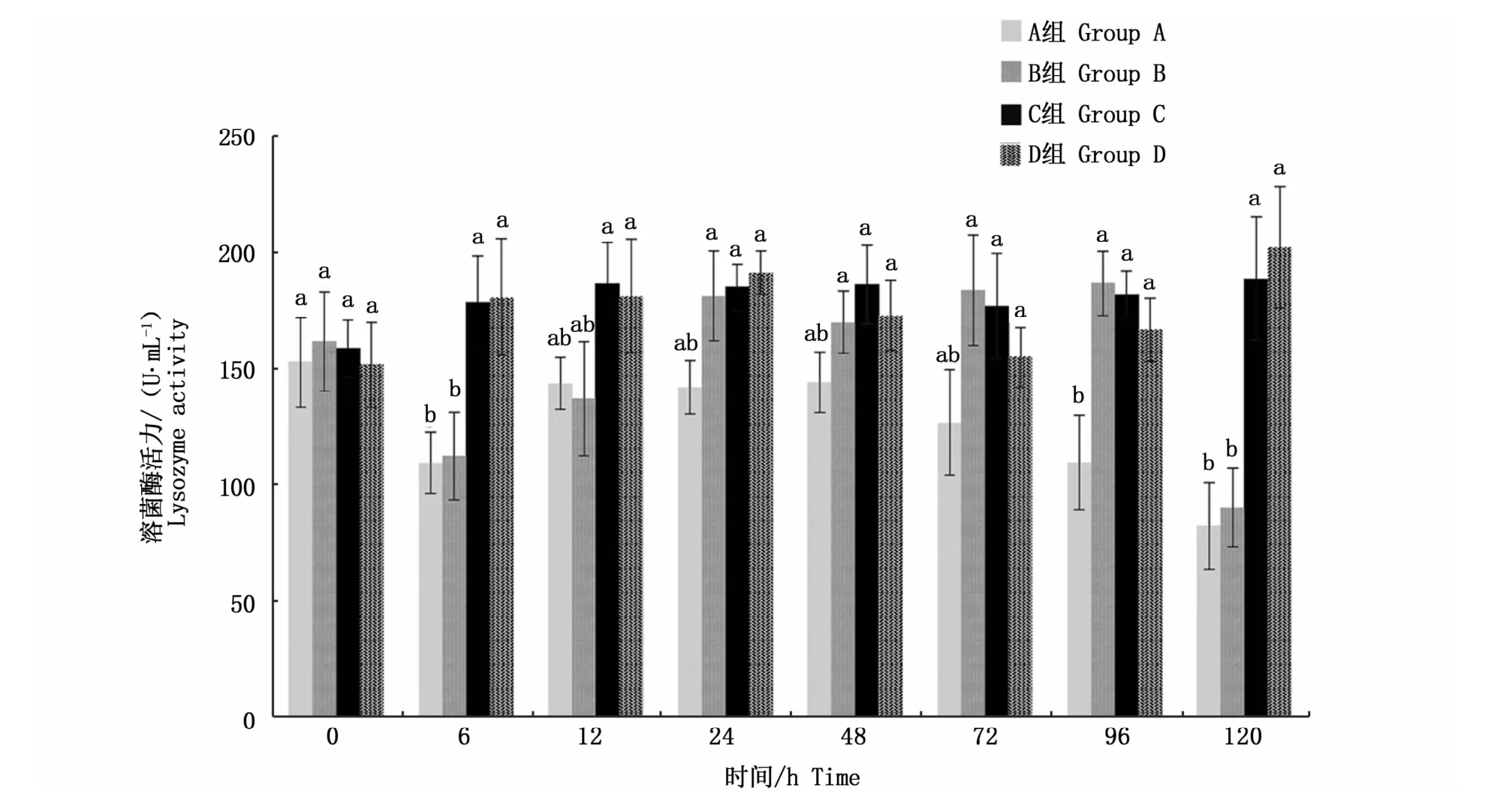
图6 不同养殖密度下大黄鱼溶菌酶活力变化Fig.6 Changes of lysozyme activity in L.crocea under different stocking densities
2.6 高养殖密度条件下大黄鱼代谢、生长和免疫相关基因表达规律
高密度应激状态下大黄鱼基因表达变化趋势如图7所示。其中,G6Pase基因表达在处理6 h时快速升高,直至处理96 h时表达量一直显著高于0 h(P<0.05);随后,表达量降低并在处理120 h时恢复至与0 h无显著性差异(P>0.05)。IGF-1基因表达量在处理24 h时达到最高值,随后开始逐渐降低,但直至处理结束时仍一直显著高于处理前水平(P<0.05)。C-lysozyme基因表达量在处理24 h时也迅速达到最高值(P<0.05),之后逐渐降低,并在处理120 h时恢复到0 h水平(P>0.05)。
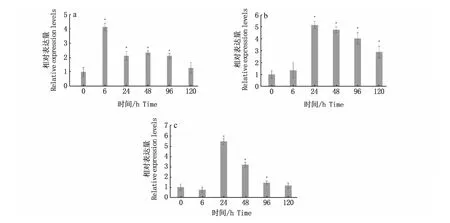
图7 高密度养殖状态下大黄鱼基因表达变化Fig.7 Changes of gene expression of L.crocea under high stocking density
3 讨论
3.1 不同养殖密度下大黄鱼的神经内分泌和代谢调节
鱼类在养殖生产过程中经常会处于各种外界因素胁迫中,养殖密度胁迫是其中之一。外界环境变化可引发鱼体的应激反应,进而影响其生长、免疫和繁殖等功能[11-16]。鱼体受到外界刺激时会产生皮质醇并释放到血液中,皮质醇是反映鱼类应激状态的重要指标,在鱼类遭受多种外界环境刺激后其含量都会快速升高。例如,银鲳(Pampusargenteus)[17]和大黄鱼[18]在运输胁迫后血清中皮质醇含量迅速上升;大西洋鲑(Salmo salar)[19]经操作胁迫处理后,皮质醇含量快速升高;同样,当点带石斑鱼[1]和塞内加尔鳎[3]养殖密度增高时,皮质醇含量也会显著增加。本研究中,在高密度养殖条件下,大黄鱼血清皮质醇含量也有类似的变化,这既是大黄鱼应对高密度胁迫的适应性调节,也反映出皮质醇作为大黄鱼密度应激反应指示指标的灵敏性。
SALAS-LEITON等[3]发现,养殖密度越高,越容易产生拥挤胁迫作用,从而导致鱼类能量需求的增强和能量储备的调动。作为鱼类体内各种生命活动所需能量的直接来源,血糖含量变化直接反映着鱼体的能量调动进程。在高密度条件下,大黄鱼血糖含量显著增加并一直持续到处理后期;同时,肝脏中葡萄糖-6-磷酸酶基因表达在处理6 h时也显著升高,直至处理120 h时才恢复到处理前水平,这与血糖指标的变化趋势基本一致。葡萄糖-6-磷酸酶是一种水解磷酸化合物的磷酸酶,在肝脏中通过水解葡萄糖-6-磷酸释放葡萄糖进入血液,以补充维持血糖平衡。高密度应激状态下,大黄鱼的高血糖含量表明适应性调节过程中的巨大能量需求,为此鱼体需要通过增加能量代谢、加速糖原分解来为机体供能。A组大黄鱼血清中乳酸含量显著升高,相似的情况还见于高密度状态下的点带石斑鱼[1];在运输胁迫过程中,大黄鱼血清乳酸含量也有类似变化[18]。
在整个处理过程中,大黄鱼血清中生长激素含量未发生明显变化,但A、B组个体中胰岛素样生长因子-1含量均显著升高。同样,高密度应激状态下大黄鱼肝脏IGF-1基因表达也出现相似的变化趋势,表达量在处理24 h时开始显著增加。鱼类的胰岛素样生长因子-1是一种由70个氨基酸组成的多肽,具有刺激生长和分化的作用;同时,在渗透压调节、繁殖、骨质平衡、免疫应答和新陈代谢等方面也发挥着重要的生理功能[20-22]。胰岛素样生长因子-1可显著提高不同养殖状态下鱼体的乳酸脱氢酶(一种糖酵解酶),催化乳酸氧化为丙酸,将氢转移给辅酶I(NAD)成为还原性辅酶I(NADH)[22]。因此,推测胰岛素样生长因子-1含量较高可能与大黄鱼应激状态下体内乳酸变化和能量代谢调节有关。
3.2 不同养殖密度下大黄鱼的抗氧化与免疫调节
应激过程中自由基会在鱼体内迅速积累,当其超过机体的清除能力时会对鱼体造成氧化损伤[20],SOD和CAT在清除自由基方面发挥着重要作用。A、B组大黄鱼肝脏SOD活力显著升高,意味着鱼体内自由基的大量积累。其中,B组大黄鱼肝脏SOD活力变化有一定的滞后性,推测与该组鱼体受胁迫程度和体内自由基的积累速度有关。与SOD活力变化情况不同,CAT活力是在处理后期开始升高。CAT主要负责催化SOD清除过程中产生的H2O2,故其调节过程可能迟于SOD。大黄鱼最终的高CAT活力状态表明,其体内自由基含量仍处于较高的水平,如果长期处于该状态将造成体内的细胞损伤,进而影响机体的正常生理机能。
溶菌酶在鱼类免疫防御方面发挥着重要作用。研究显示,大西洋鲑、虹鳟(Oncorhynchus mykiss)[23]、黄姑鱼[2]、塞内加尔鳎[24]和半滑舌鳎(Cynoglossussemilaevis)[25]等多种鱼类体内的溶菌酶活力均会在急性胁迫情况下发生显著变化。例如,在急性操作胁迫下,塞内加尔鳎溶菌酶活力呈现降低的趋势[24],而在浑浊水体中半滑舌鳎肝脏溶菌酶活力也随悬浮物浓度升高和处理时间延长而显著升高[25]。可见,溶菌酶活力的变化趋势和响应时间与外界胁迫因素的种类和强度有关;同时,也有可能因鱼种而异。在本研究中,A、B组大黄鱼血清溶菌酶活力显著低于其他密度组,这与密度胁迫状态下黄姑鱼的情况相似[2],推测密度胁迫对大黄鱼溶菌酶活力具有抑制作用。然而,本研究结果显示,溶菌酶的基因表达趋势与溶菌酶活力变化趋势存在差异。与溶菌酶活力下降不同,在处理24 h时溶菌酶基因表达量快速升高。考虑到大黄鱼体内存在着两种溶菌酶(C-type和G-type)[10],而试剂盒测定的是总溶菌酶的水解能力,故酶活力变化可能与基因表达量变化存在差异。同时,这也可能与基因的转录后调控以及机体所处的生理状态有关。
3.3 大黄鱼密度应激监测指示标记的筛选
目前,鱼类的应激信息常通过直接人为观察获得,因受观察者的主观条件影响而不容易及时发现出现的问题,故选择适当的生物效应标记(biomarker)进行鱼体健康监测是十分必要的。课题组在前期研究中发现,在惊扰应激状态下,大黄鱼部分生理指标会出现变化,而其中变化较为显著的有血糖、乳酸、溶菌酶以及SOD和CAT等,表明这些指标对惊扰应激具有较好的指示作用。然而,本研究与之相比,其中部分指标的变化规律有所不同;另有部分指标变化规律相似,但到达峰值的时间却存在差异[26]。可见,生物标记物会因物种和胁迫因素不同而存在差异,故特定物种应激敏感生物标记物的筛选也就变得十分重要。本研究通过分析养殖密度对大黄鱼的生理影响,探讨了大黄鱼在密度应激状态下的适应规律。研究表明,高密度应激可导致大黄鱼体内多种生理生化指标发生变化,其中皮质醇、血糖、SOD和CAT等的变化更为显著,显示了这些指标作为应激生物指示剂的潜力[27]。
在应激反应初期,大黄鱼可通过自身调节响应外界刺激,鱼体也努力地适应新环境。然而,若长期处于应激状态,则会影响其能量供给和细胞健康,最终导致生长和抗病等方面机能的降低。因此,根据大黄鱼应激指标变化对鱼体的状态进行监测、跟踪并采取必要的应对措施,将有助于改善养殖群体的生理状态,进而促进鱼体的健康成长。同时,值得注意的是,不同生理指标的变化趋势存在差异,故其应用于应激监测时还需结合具体情况进行分析。例如,研究显示,密度应激大黄鱼的皮质醇和血糖响应较为迅速,在高密度应激初期就显著升高,因此适合衡量急性胁迫情况下的鱼体生理状态;而CAT在应激初期并无显著变化,但在持续应激72 h至120 h时呈现显著升高的趋势,故适合用于衡量持续较长时间的密度应激或应激效应积累过程中的鱼体生理状态。

