基于线粒体基因cox1的中国近海褐斑鲬遗传多样性研究
黄志基,章 群,杨喜书,罗 纯,张玉宁
(暨南大学生命科学技术学院,广州 510632)
褐斑鲬(Platycephalussp.1)隶属于鲉形目(Scorpaeniformes)鲬科(Platycephalidae)鲬属,拉丁学名至今未定,故而采用Platycephalussp.1表示。褐斑鲬广泛分布于西北太平洋浅海泥沙质海底中[1-3],2龄达性成熟[4],于5—6月产浮性卵,受精卵在海水上层经35 d发育成幼鱼[5-6],之后潜入海底伏击捕食,年龄最高可达6龄[4],在海洋生态系统中具有重要作用。褐斑鲬是我国近海拖网渔业的重要渔获种类,在日本、韩国、东南亚等地则被视为高级食材,具有重要经济价值。研究表明,近年来由于过度捕捞、环境污染等因素影响,中国褐斑鲬出现了低龄化、生物量明显下降的现象[7],亟待加强种质资源保护。了解物种遗传多样性状况是种质资源保护的基础,因此对其进行遗传多样性研究具有重要的科学意义。
20世纪60年代,KAMEI和ISHIYAMAS[8]首次报道了褐斑鲬,之后其他学者通过分子方法验证了物种有效性[9-10],2013年QIN等[11]将其中文名定为褐斑鲬[1]。在种群遗传方面已有秦岩[1]、李玉龙等[12]、CHENG等[13]分别基于线粒体控制区(D-loop)和Cytb基因标记研究了褐斑鲬遗传多样性,但研究中部分样本为小群体或地理群体数量少,不足以全面反映中国近海褐斑鲬遗传背景。线粒体基因组为母系遗传,有效群体数量仅为核基因的1/4,变异速率是核基因的4~10倍,较小的群体数量即可表征群体遗传多样性和遗传结构;同时,还具有拷贝数高、双链环状结构、不易降解、易扩增等特点,使其成为种群遗传研究的首选分子标记。其中cox1是位于线粒体基因组上的细胞色素C氧化酶辅酶Ⅰ编码基因,适中的变异速率使得其能避免碱基替换饱和问题,不仅可作为标准条形码应用于动物物种鉴定,还适用于种群遗传多样性的分析。对蓝点马鲛(Scomberomorus niphonius)[14]、拟穴青蟹(Scylla paramamosain)[15]、中国鲳(Pampus chinensis)[16]等遗传多样性研究也证明,cox1是适合遗传多样性分析的有效分子标记。本文基于线粒体基因cox1对褐斑鲬进行遗传多样性分析,旨在更好地了解中国近海褐斑鲬遗传背景,为其种质资源的保护和开发利用提供科学依据。
1 材料与方法
1.1 实验材料
实验所用样品购自近海作业的渔民处,分别采集于山东潍坊羊口(潍坊群体)、辽宁大连金石滩(大连群体)、江苏连云港(连云港群体)、江苏南通吕四(南通群体)、福建福州平潭(福州群体)、广东揭阳惠来(揭阳群体)、广西防城港东兴(防城港群体)(表1)。样品运回实验室后取背部肌肉组织样本保存于95%乙醇溶液中备用。
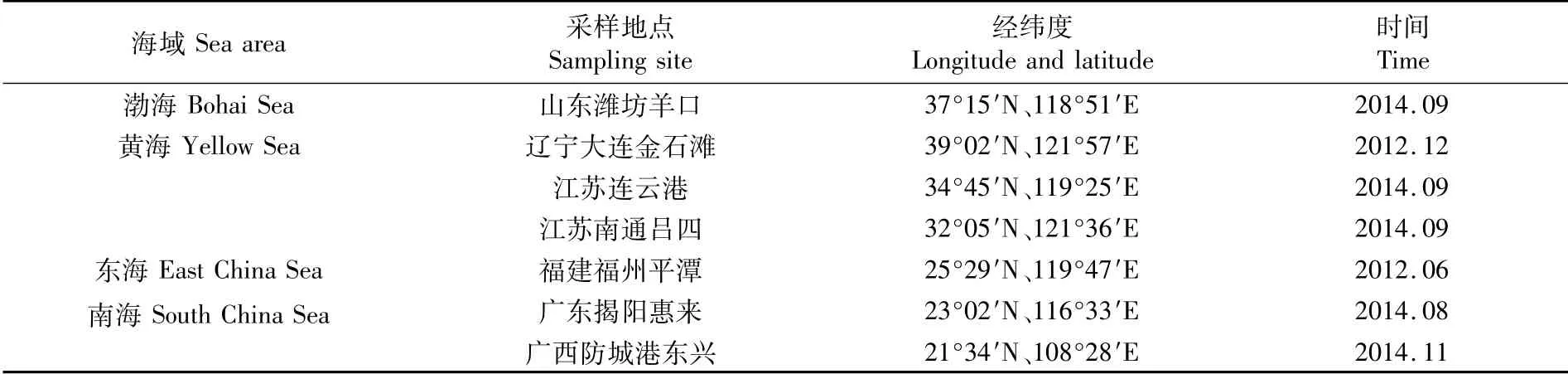
表1 中国近海褐斑鲬采样信息Tab.1 Information of Platycephalus sp.1 samples
1.2 实验方法
采用酚氯仿抽提法[17]提取肌肉组织样本的DNA。采用通用引物对FishF1-FishR1[18]和本实验室自行设计引物COIF:CTCAGCCATCCTACC TGTGG;COIR:TATTCCAAAGCCCGGGAGAA。PCR总反应体系为25μL,包括:10×PCR缓冲液2.5μL,两端引物各1μL(10μmol·mL-1),dNTP 2μL(200μmol·L-1),TaqDNA聚合酶0.15(5 U·μL-1);模板DNA 1μL,加超纯水至总体积25μL。PCR程序为:94℃预变性5 min;94℃变性30 s,54℃退火35 s,72℃延伸50 s,35个循环;然后72℃延伸7 min。电泳检测到目的片段后(cox15′端约750 bp),将PCR产物送至广州华大基因有限公司切胶纯化并测序。
1.3 数据处理
测定序列在BioEdit 7.0.9.0[19]中校对、对齐。由MEGA 10.0.5[20]计算序列特征数据。在DnaSP 6.12.03[21]中计算多态性位点信息和各地群体、4个海域群组及整体的变异位点数、单倍型数量、单倍型多样性(haplotype diversity,Hd)、核苷酸 多 样 性(nucleotide diversity,π)。采 用Arlequin 3.5[22]基于K2P-distance计算遗传分化系数Fst,以公式Nm=(1/Fst-1)/4计算基因流Nm;采用AMOVA(analysis of molecular variance)分析种群内部的层级结构。以TCS[23]构建单倍型网络图,分析单倍型地理结构和谱系结构。使用Arlequin中性检验模块的Tajima’sD和Fu’sFs计算出D和Fs值,结合歧点分布图(mismatch distribution)、单倍型网络图、Bayesian skyline plot(BSP),综合判断种群在历史上有没有出现扩张现象。根据扩张模型估算出τ值并通过公式计算种群扩张时间,公式分别为:

式中,τ为扩张时间参数;u=μk,μ为cox1基因的变异速率[(1%~3%)·Ma-1][24],k表示序列长度(652);t表示自扩张以来所经历的代数,T值即为最终所求的扩张时间,代时为该物种的生殖周期(约为1年)[5]。
同时,在BEAST 1.10.4[25]中设置参数为200 000 000 MCMC链长、变异速率1%·Ma-1和HBY碱基替换模型,分析绘制BSP(有效采样量ESS>200)以模拟有效种群大小的历史动态。
2 结果与分析
2.1 褐斑鲬cox1序列特征与遗传多样性
在155条652 bpcox1序列中,碱基比例为T:27.3%、C:30.5%、A:23.0%、G:19.2%,A+T含量(50.3%)稍高于G+C(49.7%)。无插入和缺失现象,变异位点28个,其中简约信息位点5个;定义28个单倍型,4个共享单倍型,24个独立单倍型。整体来看属于低单倍型多样性(0.428±0.051)、低核苷酸多样性(0.001 02±0.000 15)类型。各个群体变异位点数、单倍型数量、单倍型多样性和核苷酸多样性详见表2。其中,单倍型多样性数值分布在0.298~0.864,核苷酸多样性则是0.000 61~0.003 02。防城港群体遗传多样性最高(Hd=0.864±0.079,π=0.003 02±0.000 52);连云港群体单倍型多样性居次(Hd=0.489±0.112),福州群体单倍型多样性最低(Hd=0.298±0.133);大连群体核苷酸多样性居次(π=0.001 24±0.000 52),南通群体核苷酸多样性最低(π=0.000 61±0.000 25)。按4个海域划分,群体单倍型多样性为0.298~0.525、核苷酸多样性为0.000 65~0.001 46;其中,东海最低,南海最高。南海内部揭阳和防城港群体间差异较大。
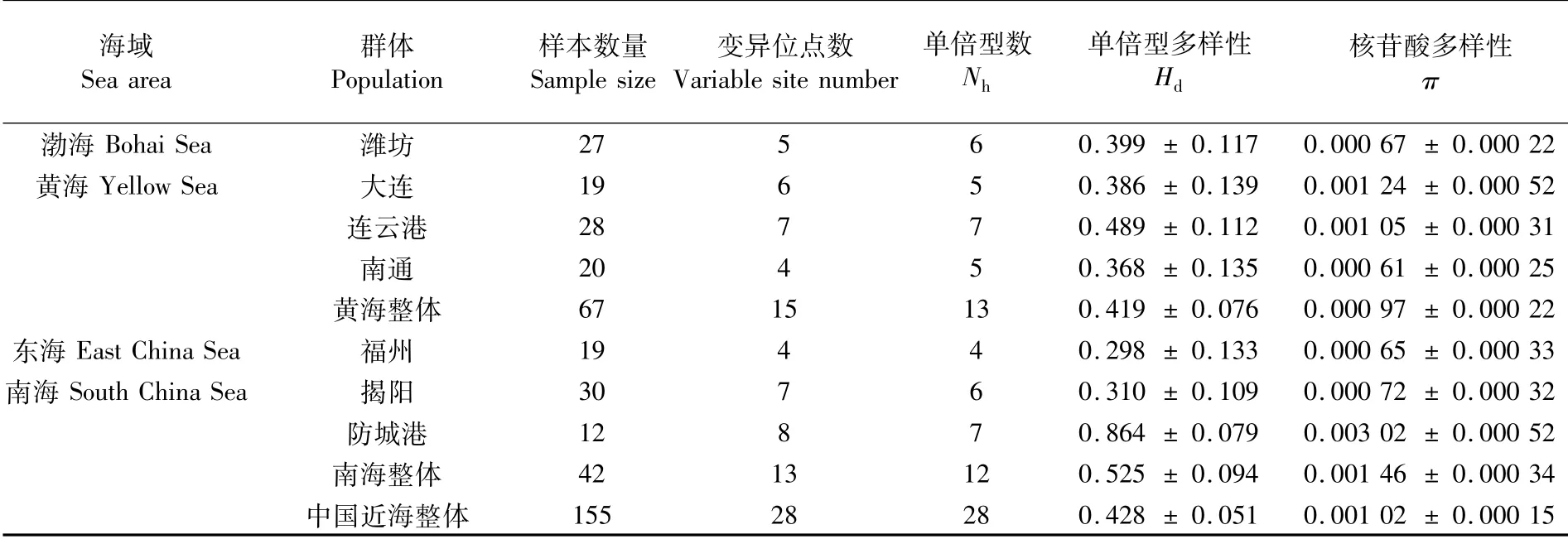
表2 褐斑鲬群体样本数量及遗传多样性Tab.2 Sample size and genetic diversity of Platycephalus sp.1 populations
2.2 褐斑鲬种群遗传结构
群体间分化系数Fst如表3所示,群体间Fst分布在-0.021 27~0.189 29范围内,防城港与其他地方群体间(Fst:0.088 61~0.189 29)存在显著至极显著的中度(0.05<Fst<0.15)到高度分化(0.15<Fst<0.25),其余群体之间则分化程度低(-0.021 27~0.027 49)。基因流Nm显示,防城港与其余群体之间基因交流较低(Nm<4),其余群体则形成自由交配的组群(表3)。
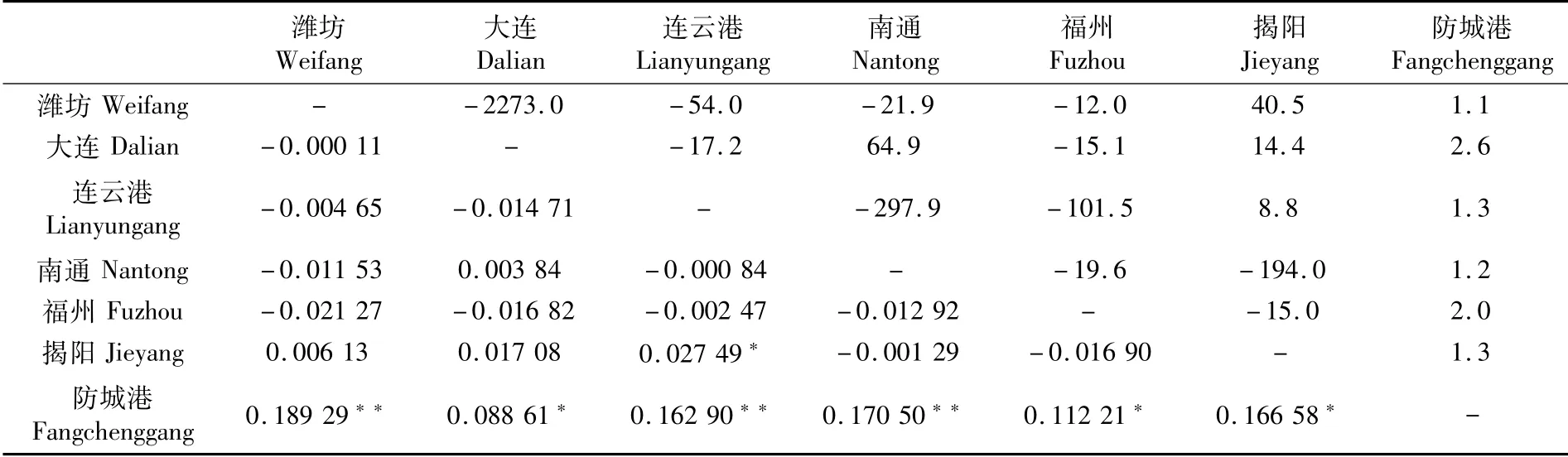
表3 褐斑鲬地理群体间遗传分化系数Fst与基因流NmTab.3 Genetic differentiation index(Fst)and gene flow(Nm)among Platycephalus sp.1 populations
分子方差分析(AMOVA)表明(表4),4个海域组群间Fct=0.038 39,对应P=0.500 49±0.016 56,变异比例为-3.84%,说明海域组群间具有较高的同质性,未出现明显的海域间结构,台湾海峡、渤海海峡和开放海域-边缘海域性质差异并非褐斑鲬群体遗传分化的成因;反观琼州海峡东西两侧群体间的Fct=0.244 12,对应P=0.153 47±0.011 15,变异比例占24.19%,与Fst呈现的结果相吻合,说明琼州海峡两侧群体间的差异虽然较大,但并未达到遗传结构的层次。
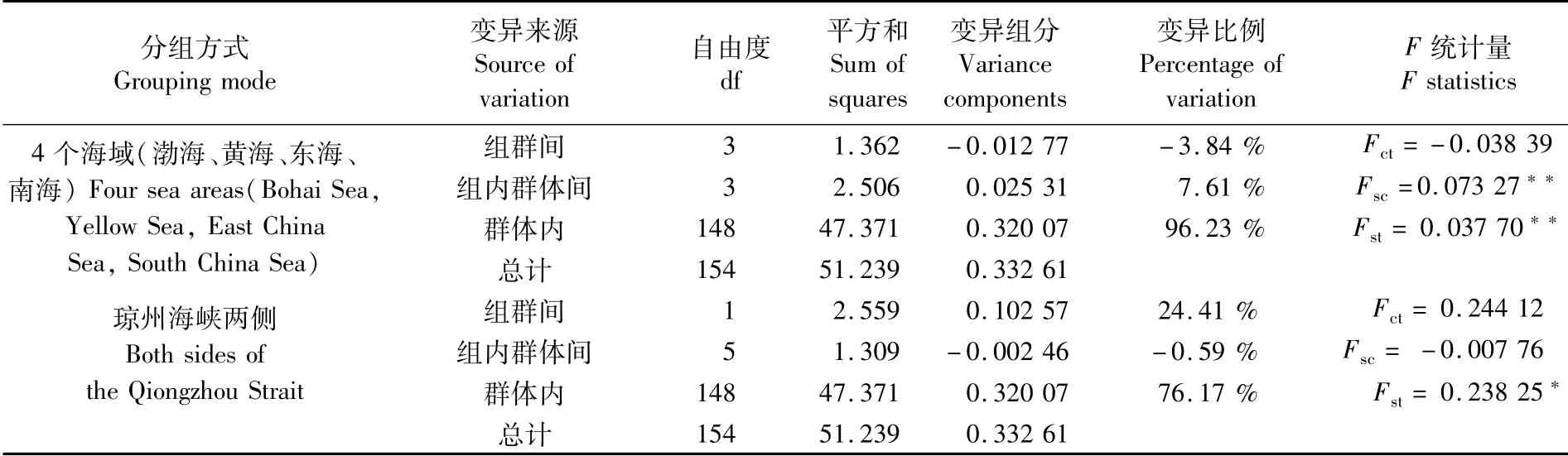
表4 中国近海褐斑鲬群体结构的分子方差分析Tab.4 AMOVA analysis of Platycephalus sp.1 population structure in coastal waters of China
单倍型网络结构(图1)显示,褐斑鲬单倍型总体呈星状结构,谱系结构不明显。主体单倍型为Hap_1,频数117,频率0.755,广泛分布于中国近海;Hap_2、Hap_6、Hap_18为共享单倍型,Hap_2由潍坊群体和福州群体共享,Hap_6仅在揭阳群体和防城港群体无分布,Hap_18由防城港群体和福州群体共享;其他单倍型为独立单倍型。星状结构代表褐斑鲬发生过种群扩张事件,即极可能以Hap_1为祖先单倍型辐射生成其他单倍型。
2.3 褐斑鲬种群历史动态
由于琼州海峡两侧群体间出现了中到高度遗传分化,基因交流较弱,因此设置防城港群体、琼州海峡东侧群体和中国近海整体3个组群分别分析种群历史动态。中性检验(Tajima’sD和Fu’sFs) 和基于Spatial扩张模型的估算结果见表5,岐点分布见图2,BSP种群历史动态分析见图3。
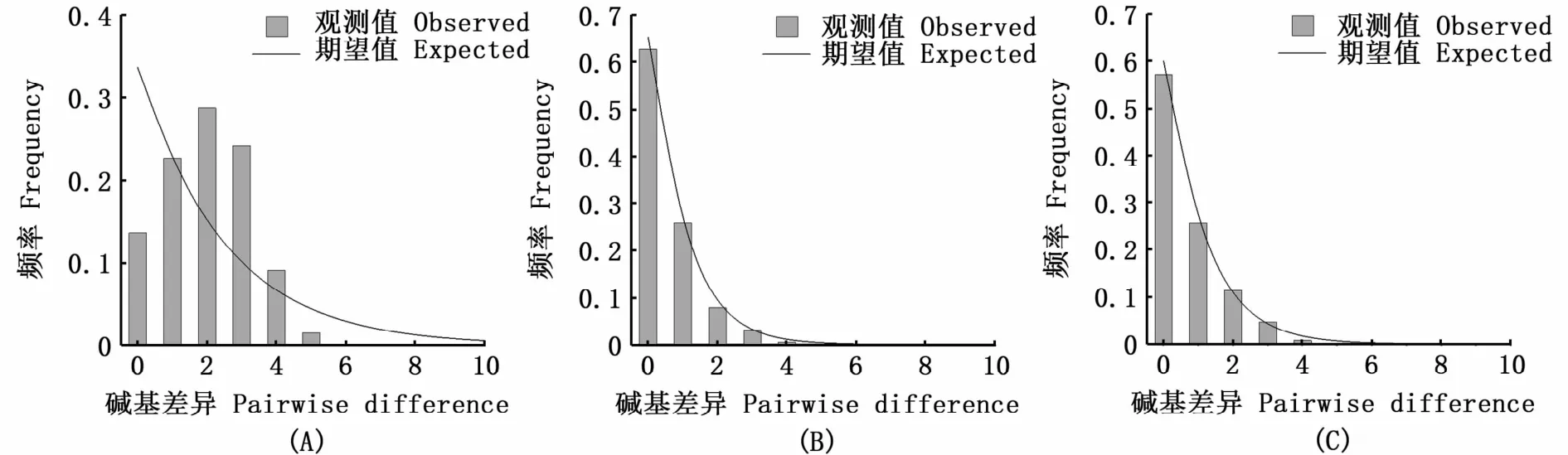
图2 基于cox1序列的褐斑鲬群体岐点分布图Fig.2 Distribution of pairwise differences for cox1 sequences within Platycephalus sp.1 populations
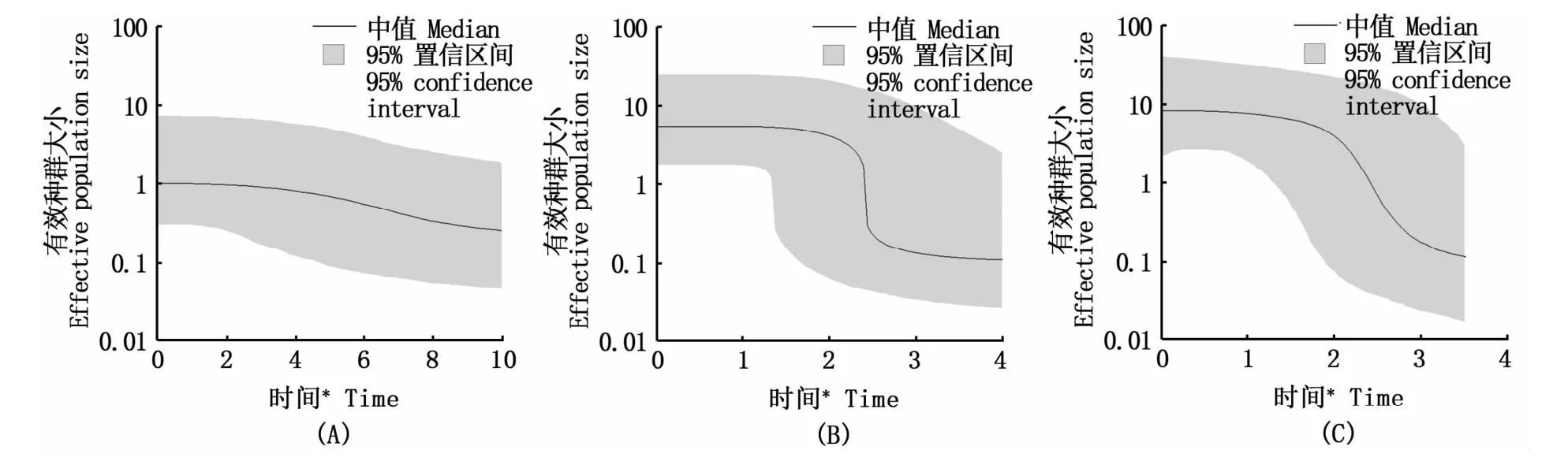
图3 褐斑鲬BSP种群历史动态分析Fig.3 Bayesian skyline plot of Platycephalus sp.1 populations
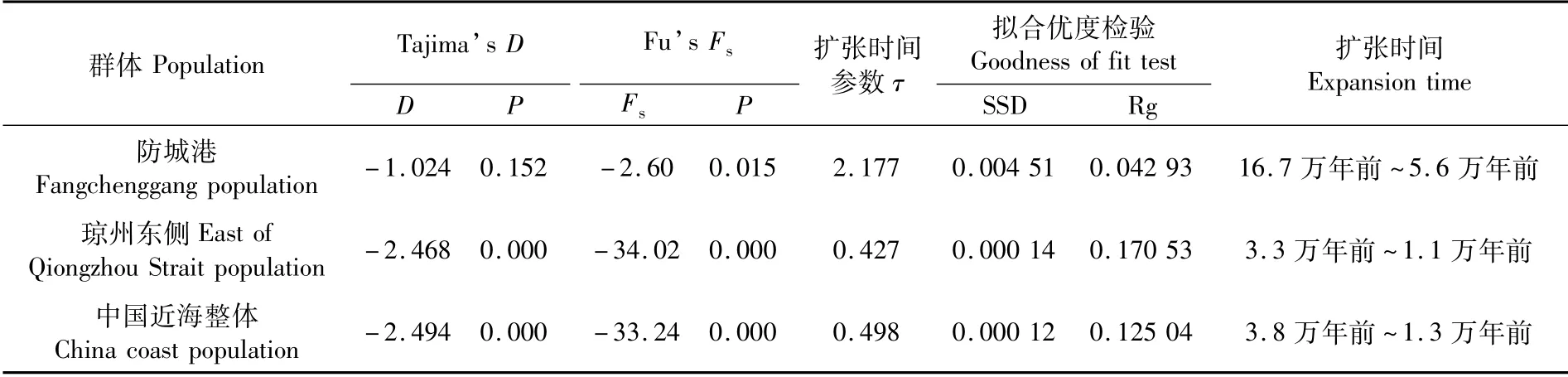
表5 褐斑鲬群体中性检验、不对称分析Tab.5 Neutrality test and mismatch analysis of Platycephalus sp.1 populations
中性检验结果显示,3个组群均发生过种群扩张。防城港群体岐点分布图(图2-A)为明显单峰,根据spatial expansion model估计扩张时间在16.7万年前~5.6万年前,属于晚更新世末次间冰期。琼州海峡以东群体扩张时间分布在3.3万年前~1.1万年前,BSP分析扩张时间约为2.5万年前,属于末次冰期中后期。中国褐斑鲬整体扩张时间在3.8万年前~1.3万年前,BSP分析扩张时间约为3万年前,属于末次冰期中后期。
3 讨论
3.1 种群历史动态
本研究中,中性检验结果为显著负值、星状单倍型网络结构和BSP分析结果表明,中国褐斑鲬琼州海峡两侧群体和中国近海整体历史上都经历了扩张事件。防城港群体扩张发生在末次间冰期,琼州海峡东侧群体和中国近海整体的扩张则发生在末次冰期中后期。冰期-间冰期回旋导致气温、海平面等升降变化,海洋生物种群数量发生波动[26]。就褐斑鲬而言,在末次间冰期,残存于边缘海的群体随着末次间冰期海平面上升带来的生存空间扩展而实现种群扩张;末次冰期袭来时,防城港群体回归避难所,待到末次冰期后期即冰消期时,伴随着海平面上升扩张到中国近海海域。一方面,琼州海峡两侧群体由于琼州海峡的阻隔,削弱了海流流动带来的群体基因交流,逐渐形成明显的遗传分化;另一方面,琼州海峡东侧群体则在洋流作用下趋向同质化,而更加广阔的生存空间仍然推动了种群的快速增长。已有研究也揭示,褐斑鲬种群在末次盛冰期后发生过扩张事件[1,13]。
3.2 褐斑鲬的遗传多样性与遗传分化
本研究中,中国褐斑鲬整体Hd=0.428、π=0.001 02,根据GRANT和BOWEN[27]的海洋鱼类遗传多样性分类方法,属于低单倍型多样性、低核苷酸多样性类型,其成因可能是种群近期经历了快速扩张,短时间内因少量的突变提高了单倍型数量,但没有足够的时间积累核苷酸突变。对比CHENG等[13]根据D-loop计算出的中国近海褐斑鲬Hd=0.78、π=0.004 1,可见cox1基因遗传多样性较低。由于cox1编码细胞色素C氧化酶辅酶Ⅰ参与了氧化磷酸化代谢过程,负责体内能量的转换,cox1基因序列会受其生物功能带来的纯化选择作用影响;而线粒体控制区不编码蛋白质,几乎不受功能基因选择压力的影响。因此二者变异速率不同,遗传多样性也有差异。对比具有相似地理分布范围且同样使用cox1分析的 近 海 鱼 类 蓝 圆 鲹[28](Hd=0.63、π=0.002 3)、蓝点马鲛[15](Hd=0.70、π=0.002 8)、银鲳[29](Hd=0.62、π=0.002)可见,褐斑鲬遗传多样性相对较小。推测可能的原因是:1)褐斑鲬经历近期种群快速扩张,种群建立时间短,尚未形成丰富的物种基因库;2)褐斑鲬经历了种群退化。
褐斑鲬受精卵在海水上层漂浮发育成幼鱼后着水底生活前[5-6],可随着海流跨越简单的地理障碍。褐斑鲬在繁殖期(5—6月),会从渤海内湾向南随沿大陆海岸流动的沿岸流南下,此时黑潮暖流支流和南海暖流汇合北上,两者于秋季(7—8月)在杭州湾附近汇合,存在于渤海、黄海和东海的由黑潮暖流、黄海暖流、黄海沿岸流、长江口冲淡水、南海暖流等组成的环流系统可携带褐斑鲬受精卵及幼体,以被动扩散的方式促进各地群体间的基因交流;另外可能还存在黄渤海海域褐斑鲬的生殖洄游行为[5],这些都是造成琼州海峡东侧群体同质化的可能原因。防城港群体所处的北部湾则由于其半封闭性海洋环境特征,表层海水在湾内形成季风环流,雷州半岛-琼州海峡-海南岛结构削弱了洋流流动带来的北部湾防城港群体和其他海域群体之间的基因交流。因而,中国近海褐斑鲬种群在这种不完全隔离的条件下,出现了琼州海峡两侧群体间的遗传分化。
3.3 褐斑鲬的保护与开发
遗传多样性是揭示物种适应环境压力的内在指标,总体上,高遗传多样性代表着对环境变化的适应能力较高,而低遗传多样性则可能预示着种群有衰退甚至灭绝的风险[30]。种群遗传结构也是种质资源管理、保护和开发的重要依据,明确种群遗传结构有利于设立管理单元、合理设置保护策略和开发方式。由于中国近海褐斑鲬北部湾防城港群体和琼州海峡以东群体间出现了显著至极显著的中度至高度遗传分化,应分作2个管理单元,以便采取更具针对性的种质资源保护与开发利用措施。北部湾防城港群体遗传多样性明显高于其他地方群体,应优先保护以便利用;琼州海峡东侧群组中,大连群体核苷酸多样性较高,建议将其设置为另一个重点保护群体;而南通群体核苷酸多样性最低,应采取有效措施,避免遗传多样性的进一步下降。本研究结果为制定和实施中国近海褐斑鲬种群保护和开发利用措施提供了科学依据。但仅采用母系遗传的分子标记进行分析,并不能反映褐斑鲬的双亲遗传特征,因此在后续的研究中可考虑使用高多态性的SSR和基于基因组或者转录组的SNPs,以揭示更加全面的遗传信息,反映环境条件差异和变化的影响情况;另外,受限于其中小部分样本数较少,本研究结果存在一定的不确定性,今后需要进一步针对南海北部近海褐斑鲬种群进行更多采样,分析其遗传背景,为制定精准的管理策略提供更加充分的科学根据。

